Распространенность ишемической болезни сердца (ИБС) у больных с сахарным диабетом 2-го типа (СД2) встречается в 2—4 раза чаще, чем в общей популяции, что связано с более ранним началом и агрессивным течением коронарного атеросклероза [1, 2]. В последние годы неуклонно растет число больных СД2, которым выполнены реваскуляризация и аортокоронарное шунтирование (АКШ), что обусловливает необходимость внедрения эффективных программ послеоперационного лечения пациентов данной категории [3].
Среди больных СД2 даже при успешной реваскуляризации и исчезновении признаков коронарной недостаточности частота больничных осложнений, послеоперационная смертность в отдаленный период и потребность в повторных реваскуляризациях достоверно выше, чем у пациентов без СД [3]. Наличие СД у пациентов, подвергшихся коронарному стентированию, уже через 9 мес увеличивает риск проведения повторной реваскуляризации в 1,27 раза [4]. Причиной столь высокого числа сердечно-сосудистых осложнений у больных СД2 является наличие помимо общих для всей популяции факторов риска специфических факторов риска — гипергликемии и диабетической дислипидемии, что определяет необходимость проведения активных и эффективных программ послеоперационного лечения и вторичной профилактики у больных данной категории [5]. Согласно «Национальным рекомендациям по диагностике и коррекции нарушений липидного обмена с целью профилактики и лечения атеросклероза» липидные нарушения при СД2 наиболее эффективно корректируются только при применении комбинированной гиполипидемической терапии, так как у этих больных имеется смешанная гиперлипидемия.
Результаты клинических исследований FIELD, DAIS, VA-HIT доказывают, что такая комбинированная терапия, как статины + фибраты, у больных с СД2 приводит к замедлению прогрессирования атеросклероза не менее чем на 42%, снижению уровня триглицеридов (ТГ) на 29% и повышению холестерина липопротеидов высокой плотности (ЛВП) на 6% [3]. Поэтому у больных СД2 уже на первом году наблюдения после коронарной эндоваскулярной реваскуляризации и АКШ целесообразна активная гиполипидемическая терапия и прежде всего, комбинированная.
Цель исследования: сравнить клинический статус, частоту возникновения коронарных осложнений и проведения повторных коронарных вмешательств у больных СД2 после коронарной эндоваскулярной реваскуляризации и АКШ в течение 12 мес наблюдения на фоне приема фенофибрата при различных сроках его назначения.
Материал и методы
В открытое продольное рандомизированное исследование были включены 30 больных СД2 со стабильной ИБС, которым была выполнена реваскуляризация миокарда методом чрескожной транслюминальной баллонной коронарной ангиопластики (ТБКА) или АКШ в период с 2009 по 2010 г.
В исследование включали больных мужчин и женщин в возрасте моложе 70 лет с СД2 в стадии компенсации и субкомпенсации обменных процессов, после проведения операции реваскуляризации миокарда или чрескожной ТБКА или АКШ. Критериями исключения были нарушения функции печени (уровень аспартатаминотрансферазы и аланинаминотрансферазы, превышающий более чем в 2 раза верхнюю границу нормы, уровень общего билирубина, превышающий более чем в 1,5 раза верхнюю границу нормы), почечная недостаточность (клиренс креатинина < 30 мл/мин), стенокардия напряжения IV функционального класса, нарушение мозгового кровообращения, язвенная болезнь желудка и двенадцатиперстной кишки в стадии обострения, онкологические заболевания, злоупотребление алкоголем.
Средняя длительность заболевания СД к моменту включения больных в исследование составила 5±2,2 года. Пациенты принимали пероральные сахароснижающие препараты из группы сульфаниламидов или комбинации сульфаниламидов и бигуанидов либо находились на инсулинотерапии. На фоне сахароснижающей терапии углеводный обмен находился в состоянии компенсации или субкомпенсации. Уровень гликированного гемоглобина у включенных в исследование не превышал 8,4±1,6% и был сопоставим в исследуемых группах (табл. 1).
Таблица 1. Исходная характеристика обследованных групп
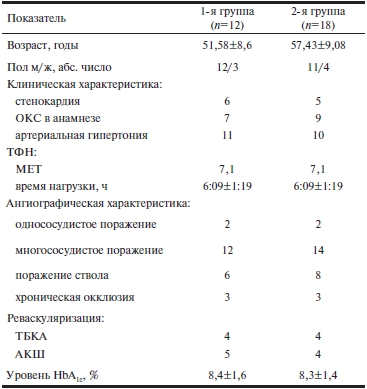
Примечание. ОКС — острый коронарный синдром; ТФН — толерантность к физической нагрузке; ТБКА — транслюминальная баллонная коронарная ангиопластика; АКШ — аортокоронарное шунтирование; HbA1c — гликированный гемоглобин. МЕТ – метаболические единицы.
Из 30 пациентов, включенных в исследование, 9 проведено АКШ, 21 — стентирование коронарных артерий, из них 8 — стентирование коронарных артерий с предварительной баллонной дилатацией (см. табл. 1). Однососудистая реваскуляризация выполнена у 6 пациентов исследуемой группы, двухсосудистая — у 9, трехсосудистая — у 6; 3 пациентам было выполнено шунтирование главного ствола левой коронарной артерии и 6 — АКШ в связи с многососудистым поражением коронарного русла (см. табл. 1). В 100% случаев при проведении коронарного стентирования использовали стенты с лекарственным покрытием (Cypher).
В соответствии с критериями включения больных рандомизированно распределяли в соотношении 1:1 в группы с разными сроками назначения фенофибрата (трайкора) с момента начала исследования и через 6 мес. В 1-ю группу были включены 12 пациентов (средний возраст 51,6±8,6 года), которые в соответствии с протоколом (начиная с первых 7 дней после эндоваскулярного вмешательства, в течение 12 мес наблюдения) принимали фенофибрат в дозе 145 мг/сут в комбинации со статином (симвастатин 40 мг), двухкомпонентной антиагрегантной терапией (ацетилсалициловая кислота — АСК + клопидогрел), β-адреноблокатором, ингибитором ангиотензинпревращающего фермента и при условии соблюдения рекомендаций по здоровому образу жизни. Медикаментозную терапию назначали согласно Национальным рекомендациям по стабильной стенокардии в дозах, постепенно оттитрованных до оптимальных с учетом выраженности клинической симптоматики. Во 2-ю группу вошли 18 пациентов (средний возраст 57,4±9,1 года), которые принимали фенофибрат в дозе 145 мг/сут и стандартную медикаментозную терапию (статины — симвастатин 40 мг, β-адреноблокаторы, ингибиторы ангиотензинпревращающего фермента, двухкомпонентную антиагрегантную терапию) спустя 6 мес и более после реваскуляризации миокарда. До момента включения в исследование все больные принимали статины: симвастатин 40 мг или аторвастатин 40 мг. Исходные уровни липидов в крови у пациентов обеих групп были сопоставимыми, но не соответствовали целевым (табл. 2).
Таблица 2. Показатели липидного обмена у больных ИБС с СД2 после реваскуляризации миокарда и АКШ (до момента начала приема комбинированной гиполипидемической терапии)
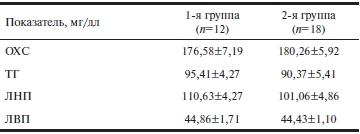
Примечание. Здесь и в табл. 3: ИБС — ишемическая болезнь сердца; СД2 — сахарный диабет 2-го типа; ОХС — общий холестерин; ТГ — триглицериды; ЛНП — липопротеиды низкой плотности; ЛВП — липопротеиды высокой плотности.
Длительность наблюдения составила 12 мес. Плановые визиты состоялись в сроки 3, 6, 9, 12 мес после включения в исследование. Внеплановые визиты осуществлялись по показаниям. С целью оценки эффективности медикаментозной терапии с назначением трайкора пациентам проводили клинико-инструментальное обследование через 3 мес после начала приема препарата. При каждом визите оценивали общеклинический статус с подробным анализом анамнеза для определения возможных проявлений ишемии, анализ липидного состава крови (общий холестерин — ОХС, липопротеиды низкой плотности — ЛНП, ЛВП, ТГ), выполняли инструментальные исследования: электрокардиография, суточное мониторирование электрокардиограммы — ЭКГ, эхокардиография, нагрузочный тест на тредмиле по протоколу R. Bruce, измерение лодыжечно-плечевого индекса (ЛПИ). Уровень артериального давления (АД) оценивали во время визитов к врачу, амбулаторно методом самоконтроля и по результатам суточного мониторирования АД.
Клиническими факторами, по которым оценивали непосредственную эффективность лечения и отдаленные его результаты, являлись наличие или отсутствие симптомов стенокардии, инфаркт миокарда, смерть, повторная реваскуляризация миокарда, изменение ЛПИ.
Статистическую обработку полученных данных проводили с помощью пакета статистических программ Statistica, версия 6.1 (StatSoft). Для оценки различия между несколькими группами использовали критерий Крускала—Уоллиса. Для сопоставления двух групп применяли критерий Манна—Уитни. Различия между анализируемыми группами считали достоверными при р<0,05. Данные представляли в виде среднего ± стандартное отклонение.
Результаты и обсуждение
Согласно поставленной цели исследования во время каждого визита у пациентов оценивали клинический статус, гликемический профиль, динамику липидного состава крови, изменение толерантности к физической нагрузке (ТФН), наличие безболевой ишемии, нарушения ритма, проведение повторных коронарографий (КГ) и реваскуляризаций.
В начале исследования при анализе клинического статуса пациентов обращало внимание, что они представляют контингент с достаточно тяжелыми осложнениями: макрососудистые осложнения в анамнезе (перенесенный ИМ, острый коронарный синдром), многососудистое поражение коронарных артерий (см. табл. 1). В среднем у одного больного определялось 2,5±0,3 пораженных артерии, у 50% больных отмечался мультифокальный атеросклероз. У большинства пациентов имелось поражение коронарных артерий со стенозами типа С, В1 с преобладанием поражения проксимальной и дистальной трети коронарных артерий с гемодинамически значимым их изменением. Наибольшая степень сужения наблюдалась в ветвях второго порядка. У 70% пациентов было выполнено эндоваскулярное вмешательство, у 30% — АКШ.
Всем пациентам были установлены стенты с лекарственным покрытием (Cypher), оказывающие выраженное антипролиферативное действие, на которые возлагаются большие надежды в нивелировании отрицательного влияния СД на прогноз у больных, подвергшихся коронарной ангиопластике [3, 6].
У больных в период наблюдения проводили гликемический контроль и контроль приема адекватной сахароснижающей терапии. Случаев декомпенсации углеводного обмена за время наблюдения в обеих группах не отмечено. Уровень компенсации углеводного обмена в обеих группах к концу исследования (по уровню гликированного гемоглобина) не превышал 7,6±1,7%, т.е. был ниже, чем в начале исследования. Известно, что после реваскуляризации при СД важен контроль за коррекцией углеводного обмена, так как низкий уровень гликированного гемоглобина сочетается с более редкими рестенозами после ЧТКА, а адекватный гликемический контроль позитивно влияет на длительный прогноз у таких больных [8—10].
Известно, что у пациентов с СД2, как правило, имеется атерогенная дислипидемия, которая характеризуется повышением уровня ТГ, низким уровнем ХС ЛВП и умеренным повышением уровня ХС ЛНП [11]. Увеличение уровней ТГ на 1 ммоль/л увеличивает риск развития ИБС у женщин на 76%, а у мужчин — на 32% [12—14]. Гипертриглицеридемия является предиктором степени протяженности поражения коронарных артерий, даже при стенозах менее 50% от диаметра просвета коронарных сосудов. Высокие концентрации липопротеидов, богатых ТГ (липопротеиды очень низкой плотности — ЛОНП, ЛНП), могут определять темп прогрессирования ИБС. В настоящее время постулировано, что увеличение уровней ТГ, модифицированных (мелкие, с высокой плотностью) ЛНП и снижение уровней ЛВП являются независимыми факторами риска развития ИБС [14].
Учитывая значимое влияние атерогенной дислипидемии на прогрессирование ИБС, в процессе исследования осуществляли тщательный контроль за липидными показателями у больных каждые 3 мес. При анализе липидного состава крови у больных, включенных в исследование, при сравнимых исходных уровнях липидов уже через 3 мес наблюдения в 1-й группе отмечалось достоверное уменьшение уровня ТГ на 9,1%, ОХС — на 10,3% и ЛПНП — на 13,9%. Через 6 мес наблюдения в 1-й группе на фоне комбинированной липидснижающей терапии отмечено дальнейшее достоверное уменьшение уровня ОХС на 12,1% и ЛНП на 14,3%; уровень ТГ также достоверно уменьшился и составил 85,36 мг/дл. При этом во 2-й группе на фоне приема статинов к 6-му месяцу наблюдения достоверно уменьшился уровень ОХС на 11%, отмечалась тенденция к уменьшению уровня ТГ на 4,8% и ЛНП на 5,6%. К 12-му месяцу наблюдения средний уровень ОХС в 1-й группе составил 152,4 мг/дл, во 2-й группе — 154,1 мг/дл, уровень ТГ снизился на 15,8 и 8,7% соответственно в 1-й и 2-й группе, уровень ЛНП — на 18,5 и 9,4% соответственно. Кроме того, определялась позитивная динамика уровня ЛВП — оптимальный уровень ЛВП определялся у 77,6% пациентов 1-й группы и у 77,2% 2-й группы (табл. 3). Таким образом, уже через 6 мес приема фенофибрата в дозе 145 мг у больных в обеих группах отмечались значимые позитивные изменения всех липидных показателей.
Таблица 3. Динамика липидного состава крови на фоне приема фенофибрата (145 мг) в течение 12 мес у больных ИБС с СД2, перенесших реваскуляризацию миокарда и АКШ
Примечание. * — статистически достоверные различия по сравнению с исходными данными (р<0,05).
Оценку клинического статуса больных на каждом визите, т.е. каждые 3 мес, проводили не только на основании анализа жалоб, анамнеза, данных физикального осмотра, но и по результатам инструментальных исследований. В начале исследования у больных обеих групп уровень ТФН составил в среднем 7,1±0,5 МЕ, а средняя продолжительность нагрузки — 6:09±1:19 (см. табл. 1). За 12 мес наблюдения и приема трайкора у больных 1-й группы ТФН увеличилась на 2,1 МЕ, а продолжительность нагрузки — на 2 мин 21 с. Мы считаем, что это обусловлено не только успешной реваскуляризацией миокарда, но и отсутствием признаков прогрессирования коронарного атеросклероза на фоне адекватной медикаментозной терапии. Во 2-й группе прирост ТФН был менее значимым и составил 1,6 МЕ, а продолжительность нагрузки увеличилась лишь на 1 мин 12 с. У 17 пациентов результат пробы был отрицательный, в 11 случаях проба не доведена до диагностических критериев по причине появления одышки или усталости пациента, и у 2 пациентов проба была положительной в связи с развитием депрессии сегмента ST в отсутствие симптомов стенокардии (см. рисунок).

По результатам анализа холтеровского мониторирования (ХМ) ЭКГ у 11% пациентов 2-й группы через 9—12 мес наблюдения выявлена «немая» ишемия, которая была подтверждена положительным тредмил-тестом, у остальных пациентов признаков скомпрометированного коронарного кровотока выявлено не было. Учитывая тенденцию к уменьшению клинической симптоматики, повышению ТФН, а также высокую распространенность безболевой ишемии у больных СД (в 2—7 раз чаще, чем у пациентов без СД) [2], считаем необходимыми более тщательный мониторинг клинического статуса и оценку выраженности факторов риска развития сердечно-сосудистых заболеваний и осложнений у больных этой категории со своевременной и эффективной коррекцией признаков ишемии. Безболевая ишемия миокарда является неблагоприятным фактором, повышающим риск внезапной коронарной смерти в 5—6 раз, развития ИМ и хронической сердечной недостаточности — в 1,5 раза [14].
Таким образом, проведение клинического обследования больных ИБС с СД2 с интервалом 3 мес после реваскуляризации миокарда на этапе диспансерного наблюдения позволяет своевременно диагностировать прогрессирование коронарного атеросклероза и обеспечить своевременное проведение соответствующих лечебных мероприятий.
Известно, что СД2 не только ускоряет в 2—4 раза развитие и прогрессирование атеросклероза коронарных артерий, но и ведет к поражению периферических артерий. Поражение магистральных артерий нижних конечностей при СД встречается в 3—5 раз чаще, чем в общей популяции. С целью диагностики поражения нижних конечностей и оценки состояния артериального кровотока мы измеряли ЛПИ и выполняли ультразвуковое сканирование артерий нижних конечностей. В начале исследования у 26,6% пациентов ЛПИ составлял 0,8—0,9, и при дуплексном исследовании артерий нижних конечностей определялись признаки нестенозирующих изменений артерий нижних конечностей, что клинически проявлялось чувством усталости в ногах при длительной ходьбе. У остальных 73,3% пациентов ЛПИ был больше 1,0, что коррелировало с отсутствием изменений в артериях нижних конечностей по результатам дуплексного исследования. Через 12 мес наблюдения при повторном измерении ЛПИ и проведении дуплексного исследования артерий данных, подтверждающих прогрессирование периферического атеросклероза, у пациентов 1-й и 2-й групп получено не было.
В начале исследования после реваскуляризации в обеих группах было 6 пациентов со стенокардией I функционального класса (ФК), 3 — со II ФК, 2 — с III ФК, без стенокардии было 19 больных. В течение 12 мес наблюдения достоверно значимой динамики в клиническом статусе пациентов не отмечалось, увеличения числа пациентов с более высоким классом стенокардии не наблюдалось, число пациентов без стенокардии увеличилось до 25. Внеплановых госпитализаций по поводу обострения и осложнений ИБС у пациентов 1-й группы не было. Однако у 11% пациентов 2-й группы на 9-м и 12-м месяце наблюдения была выявлена «немая» ишемия во время проведения ХМ ЭКГ и нагрузочного теста. Эти больные были госпитализированы и в последующем им выполнена повторная КГ. Данные пациенты субъективно не отмечали ухудшения в самочувствии; данные, подтверждающие скомпрометированный коронарный кровоток, были получены при инструментальном обследовании пациентов (ХМ и нагрузочного теста). По результатам КГ у этих пациентов были выявлены гемодинамически значимые рестенозы в дистальной части стента, имплантированного в переднюю нисходящую артерию, и прогрессирование коронарного атеросклероза с развитием гемодинамически значимого стеноза в артериях второго порядка. Пациентам было проведено повторное чрескожное коронарное вмешательство, в результате которого достигнут хороший непосредственный ангиографический результат.
Пациентам 1-й группы повторных КГ не проводили, так как в этом не было необходимости и оснований для этого в течение 12 мес наблюдения.
Таким образом, несмотря на позитивные сдвиги в липидограмме, адекватный контроль гликемического профиля в обеих группах, сравнимых по объему и характеру медикаментозной терапии в течение периода наблюдения, клиническому статусу и поражению коронарного русла, у 11% пациентов 2-й группы, у которых комбинированная липидснижающая терапия назначалась спустя 6 мес после эндоваскулярного вмешательства, на 9—12-м месяце наблюдения были выявлены признаки прогрессирования коронарного атеросклероза — по данным КГ, на уровне артерий второго порядка, что потребовало проведения повторного чрескожного коронарного вмешательства.
Выводы
1. Для больных ишемической болезнью сердца с сахарным диабетом 2-го типа характерно агрессивное течение атеросклероза коронарных артерий, что обусловливает необходимость активного диспансерного наблюдения с тщательным клиническим мониторингом не реже чем через 3 мес и применение комбинированной гиполипидемической терапии (статин + фибраты).
2. Включение фенофибрата (трайкора) к стандартной медикаментозной терапии у больных ишемической болезнью сердца с сахарным диабетом 2-го типа в ранние сроки после реваскуляризации миокарда обеспечивает надежный контроль за показателями липидного обмена и приводит к снижению уровня триглицеридов, липопротеидов низкой плотности и общего холестерина, а также к повышению уровня липопротеидов высокой плотности уже в раннем послеоперационном периоде.
3. Раннее назначение фенофибрата (в первые 7 дней) у больных ишемической болезнью сердца с сахарным диабетом 2-го типа после чрескожного коронарного вмешательства/аортокоронарного шунтирования снижает количество диагностических коронарограмм и повторных чрескожных вмешательств на 11% уже на 1-м году наблюдения.



