Распространенность фибрилляции предсердий (ФП) у больных хронической болезнью почек (ХБП). В новых Рекомендациях Европейского общества кардиологов (ЕОК) по диагностике и лечению ФП по данным эпидемиологических исследователей представлено, что ХБП уже на I и II стадии ассоциируется с увеличением риска развития ФП более чем в 2,5 раза (относительный риск — ОР 2,67 при 95% доверительном интервале — ДИ от 2,04 до 3,48), у лиц с III стадией ХБП риск формирования ФП увеличивается на 68% (ОР 1,68 при 95% ДИ от 1,26 до 2,24), а при IV и V стадии — более, чем в 3,5 раза (ОР 3,52 при 95% ДИ от 1,73 до 7,15) [1].
В многоцентровом ретроспективном когортном исследовании, в котором оценивался уровень креатинина у больных ФП по данным медицинских карт с 1997 по 2005 г. в Лейденской клинике и рассчитывалась скорость клубочковой фильтрации (СКФ) по формуле MDRD (Modification of Diet in Renal Disease), было найдено, что частота развития ХБП у пациентов с ФП составила 34,2%, из них с III стадией 30,9% [2].
По данным Шведского реестра, в котором у 2603 больных с ФП, получающих варфарин, СКФ рассчитывалась по двум формулам (Лунд—Мальме и MDRD), число пациентов с ФП с СКФ <30, <45 и <60 мл/мин/1,73 м2 составило 4,3%, 16,3% и 40,4% соответственно [3].
Имеются данные о том, что среди лиц старше 65 лет ФП регистрируется у 6% больных без ХБП [4, 5], у 18—21% больных ХБП без заместительной терапии и у 27% пациентов с ХБП, находящихся на диализе [4, 6].
В последних Рекомендациях Американской ассоциации сердца и Американской коллегии кардиологов по ФП не отмечено различий по частоте развития ХБП у больных с ФП в зависимости от возраста [7]. Так, по данным эпидемиологических исследований, в группе больных с ФП (n=2 426 865) в возрасте 65 лет и старше частота развития ХБП составила 32,3%, в возрасте моложе 65 лет (n=105 878) — 40,3%.
Результаты эпидемиологического проспективного исследования CRIC (Chronic Renal Insufficiency Cohort), в которое были включены 3267 больных ХБП в додиализной стадии (средняя СКФ 43,6±13 мл/мин/1,73 м2), частота развития ФП, подтвержденной на электрокардиограмме, составила 18%, у лиц старше 70 лет — 25% [8]. Снижение СКФ <45 мл/мин/1,73 м2 ассоциировалось с увеличением риска развития ФП на 35% (ОР 1,35 при 95% ДИ от 1,13 до 1,62; р=0,001).
В этом же эпидемиологическом исследовании показано, что возникновение ФП является предиктором не только развития, но и прогрессирования ХБП с достижением ее терминальной стадии [9]. В исследование был включен 3091 больной ХБП. В течение 5,9 года наблюдения у 5,6% была зарегистрирована ФП. Современный статистический анализ данных показал, что возникновение ФП было связано со значительно более высокими темпами развития терминальной стадии хронической почечной недостаточности (ОР 3,2 при 95% ДИ от 1,9 до 5,2) независимо от возраста, пола, расы, наличия сахарного диабета и исходной стадии ХБП.
В то же время, по данным мета-анализа W. Shang и соавт., в который было включено 7 проспективных когортных исследований (400 189 больных), выявлено, что наличие ХБП ассоциировалось с увеличением риска развития новых случаев ФП (ОР 1,47 при 95% ДИ от 1,21 до 1,78) [10].
ХБП у больных с ФП. Парадоксально, но ХБП ассоциируется с увеличением риска развития как тромбоэмболических осложнений (ТЭО), так и кровотечений [6, 11]. Хорошо известно, что в общей популяции риск развития ишемического инсульта (ИИ) или геморрагического инсульта у больных ХБП при СКФ <60 мл/мин/1,73 м2 увеличивается почти на 50% в сравнении с больными без повреждения почек [12, 13], и от 3 до 4 раз у лиц, находящихся на диализной терапии [13, 14]. Есть данные о том, что независимо от пола и возраста риск развития ИИ увеличивается в 3,7 раза у больных с ФП, находящихся в додиализной стадии, и в 5,8 раза у пациентов, получающих диализную терапию [15]. Данные ряда регистров демонстрируют, что частота развития всех инсультов у больных с ХБП и ФП составляет 5,6% в год [5, 16]. Доказано, что увеличение риска развития ИИ при ФП находится в обратной зависимости от темпов снижения СКФ [14].
По данным мета-анализа R. Providencia и соавт., в который было отобрано 19 исследований, выявлено, что у больных с ФП и ХБП риск развития ТЭО увеличивался на 46% (ОР 1,46 при 95% ДИ от 1,20 до 1,76; p=0,0001), особенно в случаях, когда регистрировалась терминальная стадия ХБП (ОР 1,83 при 95% ДИ от 1,56 до 2,14; p<0,00001) [17].
Сочетание ФП и ХБП приводит также к увеличению риска развития таких тяжелых сердечно-сосудистых осложнений, как инфаркт миокарда. Так, по данным Датского регистра, у больных с ФП при наличии ХБП в додиализной стадии (n=3687) риск развития инфаркта миокарда увеличивался в 2 раза (ОР 2,00 при 95% ДИ от 1,86 до 2,16), а на фоне ХБП, при которой требуется заместительная терапия, в 3 раза (ОР 3,00 при 95% ДИ от 2,58 до 3,50) [5].
В эпидемиологическом исследовании N. Bansal и соавт. среди 81 088 больных ХБП за 4,8±2,7 года наблюдения частота развития ФП составила 7,7%, что ассоциировалось с увеличением общей смертности у этих больных на 66% (ОР 1,66 при 95% ДИ от 1,57 до 1,77) [18].
Анализ в подгруппах исследования ROCKET AF показал, что при снижении клиренса креатинина (формула Кокрофта—Голта) на 10 мл/мин у больных ХБП риск развития ТЭО увеличивался на 12% (ОР 1,12 при 95% ДИ от 1,07 до 1,16), а при снижении СКФ (MDRD) на 5 мл/мин/1,73 м2 у больных с исходной СКФ<58 мл/мин/1,73 м2 риск развития инсульта, системных эмболий и смертельных исходов возрастал на 9% (ОР 1,09 при 95% ДИ от 1,03 до 1,16) [19].
ХБП, являясь предиктором сосудистых осложнений у больных с ФП, также приводит после ТЭО к дальнейшему прогрессированию повреждения почечных клубочков и снижению преимуществ антикоагулянтов в плане профилактики инсульта и смертельных исходов [12]. Наряду с традиционными сердечно-сосудистыми факторами риска (ФР) развития ТЭО у больных с ФП и ХБП значительную роль играют хроническое воспаление, окислительный стресс, активация симпатической части вегетативной нервной системы, тромбогенные факторы, гипергомоцистеинемия и связанные с уремией токсины, метаболические нарушения, анемия, свойственные для ХБП, в том числе терминальной ее стадии, которые являются триггерами повреждения сосудов и дисфункции эндотелия [13].
ХБП является одним из важнейших ФР кровотечений у больных ФП и внесена в шкалу оценки риска HAS-BLED [20]. Однако в клинической практике нередко завышается значение заболевания почек для оценки риска кровотечений у больных с ФП, и врачи добавляют баллы по шкале HAS-BLED, даже если у больного нет снижения фильтрационной функции почек, но, например, в анамнезе имеется хронический пиелонефрит. Согласно рекомендациям Российского кардиологического общества, Всероссийского научного общества аритмологов, Ассоциации сердечно-сосудистых хирургов, больному добавляется один балл по шкале HAS-BLED, если пациент находится на гемодиализе или после трансплантации почки, либо уровень креатинина в сыворотке крови равен или превышает 200 мкмоль/л [21].

Значение ХБП для риска кровотечений у больных с ФП представлено в Датском регистре [5]. Так, при наличии ХБП в додиализной стадии у больных с ФП риск кровотечений увеличивался более чем в 2 раза (ОР 2,24 при 95% ДИ от 2,10 до 2,38), а у больных, находящихся на диализной терапии, почти в 3 раза (ОР 2,70 при 95% ДИ от 2,38 до 3,07). Есть сведения, что риск интракраниальных кровотечений и желудочно-кишечных кровотечений выше на 20% у больных ХБП III стадии и более [22—24]. Предполагаемыми механизмами, влияющими на увеличение риска кровотечений при ХБП у больных с ФП, являются не только дисфункция эндотелия в сочетании с анемией, использованием гепарина или антитромбоцитарных средств, но и связанная с уремией дисфункция тромбоцитов, ишемическая болезнь кишечника, которая приводит к изменению кишечной микрофлоры и дефициту витамина K, что может способствовать повышенной кровоточивости.
Одной из серьезных проблем в выборе терапии у больных с ФП и ХБП, в том числе антикоагулянтной терапии (АКТ), является изменение элиминации лекарственных препаратов, находящейся в зависимости от СКФ и путей выведения препарата.
Для клиницистов выбор АКТ у больных с ФП и ХБП является сложной задачей не только потому, что наличие почечной дисфункции увеличивает риск развития ТЭО и кровотечений, а также изменяется элиминация препаратов, но и вследствие того, что рандомизированные клинические исследования (РКИ), которые были бы спланированы для оценки эффективности и безопасности антикоагулянтов и антитромбоцитарных препаратов для больных данной категории, не проводились. Более того, почти из всех исследований были исключены больные с терминальной стадией ХБП и находящиеся на диализной терапии [25]. Соответственно, показания или противопоказания к назначению АКТ при ХБП и ФП складываются из выводов подгрупповых анализов РКИ, нерандомизированных исследований, регистров, данных клинической практики.
Значение АКТ у больных ФП и ХБП. В нескольких исследованиях оценена связь между степенью нарушений фильтрационной функции почек и риском кровотечений у больных с ФП и ХБП, получающих АКТ. Так в Датском регистре было выявлено, что применение антикоагулянтной терапии у больных ФП и ХБП было связано, с одной стороны, с уменьшением риска инсульта, с другой стороны, с увеличением риска кровотечений по сравнению с больными без почечной дисфункции (ОР 1,33; 95% ДИ 1,16—1,53) [5]. В другом наблюдательном исследовании была проведена оценка риска развития инсульта и кровотечений у пожилых больных старше 65 лет, госпитализированных с ФП [26]. При этом использование варфарина ассоциировалось с увеличением риска кровотечений на 44% (ОР 1,44 при 95% ДИ от 1,13 до 1,85) без снижения риска развития инсульта у больных, находящихся на диализе. У больных, находящихся в додиализной стадии ХБП, риск кровотечений при приеме варфарина был выше, чем у лиц, не принимающих варфарин (ОР 1,19 при 95% ДИ от 1,16 до 1,22) [26].
На основании оценки государственных баз данных Канады получены данные, что терапия варфарином у пожилых людей с ФП и ХБП в додиализной стадии приводила к увеличению риска больших кровотечений на 11,6% в течение 2,1 года наблюдения [4]. Большинство исследователей сходятся во мнении, что повышенный риск крупных кровотечений (внутричерепных кровоизлияний или желудочно-кишечных кровотечений), связанный с АКТ, значительно повышен при ФП, как у лиц, находящихся на диализе, так и при отсутствие потребности в заместительной терапии [16, 27]. Ряд авторов указывают, что наибольшая частота кровотечений, особенно желудочно-кишечных, на фоне АКТ регистрируется в течение первых 30 дней лечения [4]. Авторы выявили наличие обратной зависимости между уровнем функции почек и риском кровотечений.
Преимущества АКТ представлены в Датском регистре [5]. У больных с ФП и ХБП в додиализной стадии отмечена тенденция к снижению риска развития инсульта и системных эмболий на 16% (ОР 0,84 при 95% ДИ от 0,69 до 1,01) на фоне АКТ; у пациентов, находящихся на диализе, было продемонстрировано достоверное снижение частоты развития этих осложнений на 56% (ОР 0,44 при 95% ДИ от 0,26 до 0,74). По данным мета-анализа R. Providencia и соавт., в который было отобрано 19 исследований, выявлено, что варфарин у больных с ФП и ХБП в додиализной стадии снижает частоту развития ТЭО на 61% (ОР 0,39 при 95% ДИ от 0,18 до 0,86; p<0,00001), а витамин К-независимые пероральные антикоагулянты в этом отношении были более эффективны чем варфарин на 20% (ОР 0,80 при 95% ДИ от 0,66 до 0,96; p=0,02) и более эффективны чем ацетилсалициловая кислота, на 68% (ОР 0,32 при 95% ДИ от 0,19 до 0,55; p<0,0001) [17].
В другом исследовании продемонстрировано, что применение АКТ у больных с неклапанной ФП и ХБП в стационаре и затем амбулаторно приводило к снижению не только риска развития ТЭО, но и общей и сердечно-сосудистой смертности [16]. Под наблюдением находились 11 128 больных с ХБП в додиализной стадии и 1728 больных ХБП, получающих заместительную терапию. Применение АКТ показало снижение риска смерти от всех причин на 15% (ОР 0,85 при 95% ДИ от 0,72 до 0,99) у больных ХБП, находящихся на диализе, при наличии риска развития ТЭО по шкале CHA2DS2-VASc ≥2. У больных ХБП в додиализной стадии использование антикоагулянтов привело к снижению риска не только смерти от всех причин (ОР 0,64 при 95% ДИ от 0,60 до 0,69), но и фатального инсульта или смертельных кровотечений (ОР 0,71 при 95% ДИ от 0,57 до 0,88), сердечно-сосудистой смертности (ОР 0,80 при 95% ДИ от 0,74 до 0,88) при условии, что оценка по шкале CHA2DS2-VASc ≥2 баллов.
По мнению ряда авторов, преимущества АКТ у больных с ФП и ХБП проявляются только в додиализной стадии [26, 27]. По данным M. Shah и соавт., низкий риск развития ишемических осложнений на фоне АКТ отмечен только у больных ХБП в додиализной стадии (ОР 0,87 при 95% ДИ от 0,85 до 0,9); у пациентов, находящихся на диализе, была даже выявлена тенденция его увеличения (ОР 1,14 при 95% ДИ от 0,78 до 1,67) [26]. Эти результаты не согласуются с данными работы W.C. Winkelmayer и соавт., в которую были включены 12 284 больных, находящихся на диализе, с вновь выявленной ФП [27]. Применение АКТ у данной группы больных ассоциировалось со снижением риска развития ИИ на 32% (ОР 0,68 при 95% ДИ от 0,47 до 0,99), общей смертности на 16% (ОР 0,84 при 95% ДИ от 0,73 до 0,97).
В недавно выполненном исследовании D. Brancaccio и соавт. также показаны значительные преимущества АКТ у больных с ФП, находящихся на диализе, в плане снижения общей смертности и увеличения выживаемости пациентов [28].
В обзоре S. Gill и соавт. суммированы данные о частоте развития ТЭО и кровотечений у больных с ФП в зависимости от тяжести ХБП, а также эффективности и безопасности АКТ у пациентов данной категории (см. таблицу) [29].
Оценка эффективности и безопасности варфарина у больных с ФП и ХБП. Данные о применении антагонистов витамина К (АВК) у больных с ФП и ХБП крайне ограничены. Имеются несколько систематических обзоров только обсервационных исследований.
 К. Dahal и соавт. выполнили систематический обзор 11 обсервационных когортных исследований, в который были включены 11 600 больных, принимающих варфарин [30]. Показано, что использование варфарина привело к снижению риска развития ИИ (ОР 0,70 при 95% ДИ от 0,54 до 0,89) и общей смертности (ОР 0,65 при 95% ДИ от 0,59 до 0,72) только у больных с ФП и ХБП в додиализной стадии. У пациентов, находящихся на диализе, риск развития ИИ даже незначительно возрастал (ОР 1,12 при 95% ДИ от 0,69 до 1,82), риск общей смертности не снижался (ОР 0,96 при 95% ДИ от 0,81 до 1,13), при этом риск больших кровотечений достоверно увеличивался на 30% (ОР 1,30 при 95% ДИ от 1,08 до 1,56). У обследуемых с ХБП, не требующей заместительной терапии, риск кровотечений возрастал недостоверно (ОР 1,15 при 95% ДИ от 0,88 до 1,49).
К. Dahal и соавт. выполнили систематический обзор 11 обсервационных когортных исследований, в который были включены 11 600 больных, принимающих варфарин [30]. Показано, что использование варфарина привело к снижению риска развития ИИ (ОР 0,70 при 95% ДИ от 0,54 до 0,89) и общей смертности (ОР 0,65 при 95% ДИ от 0,59 до 0,72) только у больных с ФП и ХБП в додиализной стадии. У пациентов, находящихся на диализе, риск развития ИИ даже незначительно возрастал (ОР 1,12 при 95% ДИ от 0,69 до 1,82), риск общей смертности не снижался (ОР 0,96 при 95% ДИ от 0,81 до 1,13), при этом риск больших кровотечений достоверно увеличивался на 30% (ОР 1,30 при 95% ДИ от 1,08 до 1,56). У обследуемых с ХБП, не требующей заместительной терапии, риск кровотечений возрастал недостоверно (ОР 1,15 при 95% ДИ от 0,88 до 1,49).
В другом обзоре наблюдательных исследований также показано, что частота больших кровотечений при использовании варфарина у больных с ФП и ХБП в додиализной стадии достоверно не увеличивалась (ОР 1,05 при 95% ДИ от 0,74 до 1,36) [31]. Полный обзор особенностей фармакокинетики варфарина и клинических данных его использования у больных с ФП и ХБП представлен в обзоре K.E. Chan и соавт. [24].
В последние годы выдвинута новая гипотеза о негативном влиянии варфарина на течение ХБП и прогноз в целом у больных с ФП за счет кальцификации артерий, в том числе почечных [32—35].
По данным экспериментальных и клинических исследований, дефицит витамина К является предиктором развития и прогрессирования кальцификации сосудов, а сам витамин К, синтезируемый в костной ткани и гладких мышечных клетках сосудов при посредничестве карбоксилирования матриксного Gla-белка, функционирует как ингибитор кальцификации [36—38]. С одной стороны, как на ранних стадиях ХБП, так и у больных, находящихся на гемо- и перитонеальном диализе, наблюдается субклинический дефицит витамина К [39, 40]; с другой стороны, применение варфарина как АВК, который ограничивает карбоксилирование витамин К-зависимых белков, может способствовать развитию или дальнейшему углублению дефицита витамина К, и, соответственно, приводить к кальцификации сосудов, в том числе в бассейне почечных артерий [41]. Есть мнение, что применение варфарина является механизмом возникновения или усугубления уремической артериопатии [42]. Кальцификация артерий, в свою очередь, является доказанным ФР развития сердечно-сосудистых осложнений, особенно у больных, находящихся на диализной терапии [43, 44].
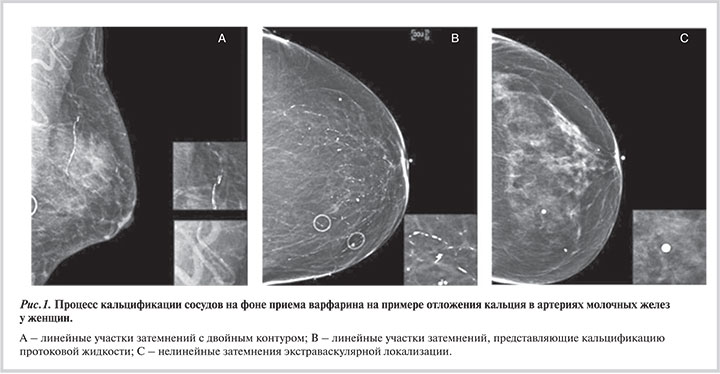
В исследовании E. Tantisattamo и соавт. наглядно продемонстрирован процесс кальцификации сосудов на фоне приема варфарина на примере отложения кальция в артериях молочных желез у женщин (рис. 1, A) [33].
Тест на артериальную кальцификацию молочной железы был положительным, если определялись тонкие линейные затемнения вдоль края сосудов по данным маммографии, определяемые с обеих сторон в одном и более сосудов (см. рис. 1, A). Эту кальцификацию артерий легко отличить от других форм кальцификации (рис. 1, В и 1, С).
В работе было найдено, что после начала терапии варфарином распространенность артериальной кальцификации была на 50% больше, чем в контрольной группе больных женщин, не принимающих антикоагулянты (39% по сравнению с 25,9%; р<0,0001). Более того, авторы показали зависимость выраженности артериальной кальцификации от длительности терапии варфарином (рис. 2).
Есть данные, что в отличие от варфарина новые пероральные антикоагулянты (НОАК) способны тормозить прогрессирование роста атеросклеротических бляшек и даже стабилизировать их [45, 46]. В частности, в экспериментальном исследовании T. Hara и соавт. не только продемонстрировано, что ривароксабан тормозит прогрессирование роста атеросклеротических бляшек и их дестабилизацию у ApoE(–/–) мышей, но и представлены механизмы антиатеросклеротического эффекта: подавление провоспалительных цитокинов и активации макрофагов помимо антикоагулянтного эффекта [46].
Многие авторы придерживаются мнения, что противоречивые данные об эффективности и безопасности варфарина у больных с ФП и ХБП связаны с проблемами удержания международного нормализованного отношения (МНО) в целевом диапазоне от 2 до 3 [47—49].
Так, в ретроспективном когортном исследовании у 123 188 больных с вновь выявленной ФП наличие ХБП было фактором снижения частоты применения варфарина для профилактики инсульта: чем выше стадия ХБП, тем ниже была частота приема варфарина (57,2—46,4%) [47]. Причем по мере нарастания тяжести ХБП значительно уменьшалось время удержания МНО в целевом диапазоне, несмотря на высокую приверженность больных к мониторингу МНО. В группе больных, находящихся на диализе, лишь у 21% удавалось сохранять время удержания МНО в целевом ≥60%. Полученные данные согласуются с результатами регистра ORBIT AF, в котором определено, что у больных с ФП и ХБП V стадии время нахождения МНО в целевом диапазоне составило лишь 47% [50].
В исследовании S.A. Sakaan и соавт. была проведена оценка потребности изменения дозы варфарина у 210 госпитализированных больных ХБП от III до V стадии в сравнении с группой из 90 пациентов с нормальной функцией почек [49]. Показано, что по мере снижения СКФ доза варфарина снижалась (p=0,001). Кроме того, время удержания МНО в целевом диапазоне у больных с терминальной стадией ХБП было значительно меньше, чем у пациентов без дисфункции почек (p=0,02). Авторы делают вывод, что при ХБП, особенно при терминальной стадии, доза варфарина должна быть на 20% ниже, чем у больных с нормальной СКФ, чтобы добиться достижения и удержания стабильного МНО в целевом диапазоне.
На основании имеющихся данных о трудностях удержания МНО в целевом диапазоне при приеме варфарина у больных с ФП с почечной дисфункцией, ХБП как сопутствующее заболевание была внесена в шкалу SAMe-TT2R2 (Sex, Age, Medical history, Treatment, Tobacco use), позволяющую до начала терапии АВК предположить низкую вероятность достижения стабильного МНО [51].
Оценка эффективности и безопасности НОАК у больных с ФП и ХБП. Оценка эффективности и безопасности НОАК у больных с неклапанной ФП проведена в 4 больших многоцентровых РКИ: прямого ингибитора тромбина — дабигатрана в исследовании RE-LY, селективных ингибиторов Xa фактора свертывания: ривароксабана в исследовании ROCKET AF, апиксабана в исследовании ARISTOTLE, эдоксабана в исследовании ENGAGE TIMI 48 [52—55]. Последний пока не зарегистрирован в Российской Федерации.

Согласно новым Европейским рекомендациям по ФП, НОАК являются более предпочтительными, чем АВК, у больных с не-клапанной ФП и высоким риском развития инсульта (класс I, уровень А) [1].
Однако данные о влиянии НОАК на риск развития ТЭО и частоту кровотечений у больных с неклапанной ФП и ХБП ограничены лишь результатами анализов в подгруппах РКИ, мета-анализов и наблюдательных исследований. Более того, в РКИ не включались пациенты с ФП с клиренсом креатинина менее 25 мл/мин.
Однако только в исследование ROCKET AF, в котором проводилась сравнительная оценка эффективности и безопасности ривароксабана и варфарина, было включено наибольшее число больных с ХБП и клиренсом креатинина <50 мл/мин — 20,9% с наибольшим риском развития инсульта по шкале CHADS2 (3,68 балла) [56]; у 91% больных с нарушением фильтрационной функции почек риск развития инсульта по шкале CHADS2 был более 2 баллов. На основании данных о фармакокинетике и фармакодинамике ривароксабана именно у больных с клиренсом креатинина <50 мл/мин была изучена доза 15 мг/сут при однократном приеме. Анализ в подгруппах исследования ROCKET AF показал, что ривароксабан в дозе 15 мг/сут у больных с ФП с клиренсом креатинина 30—49 мл/мин не менее эффективен чем варфарин в профилактике инсульта и системных эмболий. При использовании ривароксабана у больных с ХБП частота больших и клинически значимых небольших кровотечений, а также внутричерепных кровоизлияний была сопоставима с частотой аналогичных кровотечений при приеме варфарина. При этом частота смертельных кровотечений при применении ривароксабана была ниже на 61% (ОР 0,39 при 95% ДИ от 0,15 до 0,99), кровотечений в жизненно важные органы — на 45% (ОР 0,55 при 95% ДИ от 0,30 до 1,00) в сравнении с приемом варфарина.
В исследовании ARISTOTLE в группе апиксабана лишь у 15% регистрировался клиренс креатинина <50 мл/мин, еще у 1,5% клиренс креатинина был 25—30 мл/мин, при этом риск развития инсульта по шкале CHADS2 у больных с ХБП был выше 2 баллов у 45% пациентов [57]. По результатам исследования ARISTOTLE, у больных с дисфункцией почек невозможно оценить, какая доза – 5 мг или 2,5 мг 2 раза в день является эффективной и безопасной для больных с ФП и ХБП [54, 57]. Это связано с тем, что, согласно дизайну исследования, доза 2,5 мг 2 раза в сутки назначалась не просто больным с уровнем креатинина в сыворотке более 133 мкмоль/л, а пациентам с двумя и более следующими критериями включения: возраст 80 лет и старше, масса тела не более 60 кг, уровень креатинина в сыворотке более 133 мкмоль/л. Всего в исследовании лишь 4,7% больных в группе апиксабана принимали дозу 2,5 мг 2 раза в сутки.
В исследование RE-LY, в котором оценивали эффективность и безопасность дабигатрана в сравнении с варфарином у больных с ФП, были включены 19,8% больных с ФП с клиренсом креатинина <50 мл/мин, у 45% больных с клиренсом креатинина <50 мл/мин в группе дабигатрана риск развития инсульта по шкале CHADS2 был больше 2 баллов [52, 58]. Кроме того, согласно протоколу исследования, доза дабигатрана 110 мг или 150 мг 2 раза в сутки не зависела от клиренса креатинина, хотя было известно, что элиминация препарата почками составляет 80% [52]. Возможно, поэтому при использовании дабигатрана 150 мг 2 раза в сутки у больных с ФП и клиренсом креатинина <50 мл/мин риск больших кровотечений недостоверно увеличивался на 22% (ОР 1,22 при 95% ДИ от 0,95 до 1,58), риск кровотечений в жизненно важные органы — на 27% (ОР 1,27% при 95% ДИ от 0,89 до 1,83), и не было выявлено у больных этой категории клинического преимущества дабигатрана в дозе 150 мг 2 раза в сутки перед варфарином (ОР 1,04 при 95% ДИ от 0,88 до 1,24) [58].
В одном из систематических обзоров Z. Harel и соавт., в который было включено 4 РКИ (n=9693), оценивались эффективность и безопасность ривароксабана, дабигатрана, апиксабана в сравнении с варфарином у больных с неклапанной ФП и клиренсом креатинина 30—50 мл/мин [59]. Анализ не показал различий по частоте развития инсультов, системных эмболий или смертельных исходов при приеме НОАК (ОР 0,64 при 95% ДИ от 0,39 до 1,04) по сравнению с применением варфарина. Риск больших кровотечений или комбинированной конечной точки (большие и клинически значимые небольшие кровотечения) также достоверно не различался у лиц, принимающих НОАК или варфарин, при клиренсе креатинина 30—50 мл/мин.
В другом мета-анализе, в который было включено 9 РКИ (n=40 693), применение НОАК, включая эдоксабан и ксимелагатран, (последний не используется в настоящее время из-за риска гепатотоксичности), показано снижение частоты развития инсультов и системных эмболий на 22% (ОР 0,78 при 95% ДИ от 0,67 до 0,92) при отсутствии значительной гетерогенности данных [60]. НОАК продемонстрировали также достоверное снижение риска больших кровотечений на 25% (ОР 0,75 при 95% ДИ от 0,58 до 0,95).
В третьем мета-анализе, в который было включено 10 РКИ, оценены эффективность и безопасность НОАК (ривароксабан, апиксабан, дабигатран) в сравнении с варфарином, низкомолекулярными гепаринами и ацетилсалициловой кислотой у больных с ФП и дисфункцией почек [61]. Лечение НОАК у лиц с клиренсом креатинина в диапазоне 50—79 мл/мин ассоциировалось со снижением частоты развития инсульта или системных эмболий на 19% (OР 0,81 при 95% ДИ от 0,72 до 0,9), небольших кровотечений на 30% (ОР 0,7 при 95% от ДИ 0,54 до 0,92). У больных с ФП с клиренсом креатинина в диапазоне 30—49 мл/мин лечение НОАК обеспечило снижение риска развития инсульта и системных эмболий на 28% (ОР 0,72 при 95% ДИ от 0,57 до 0,92) без увеличения риска больших кровотечений (ОР 0,82 при 95% ДИ от 0,59 до 1,14).
Таким образом, выполненные мета-анализы свидетельствуют, что НОАК могут быть альтернативной АВК у больных с неклапанной ФП и ХБП в додиализной стадии при клиренсе креатинина 30—50 мл/мин.
Данные о влиянии НОАК на прогрессирование ХБП крайне ограничены. Представляет большой клинический интерес последний анализ в подгруппах РКИ ROCKET AF, в котором изучалось влияние ривароксабана и варфарина на клиренс креатинина у больных с ФП и ухудшением фильтрационной функции почек [62]. В анализ были включены 12 612 больных с ФП. Ухудшением фильтрационной функции почек считали снижение клиренса креатинина более 20% при его измерении в любое время исследования по сравнению с исходным уровнем. Всего было выявлено 3320 больных с ФП и ухудшением фильтрационной функции почек, которые отличались от группы больных со стабильным уровнем клиренса креатинина более высокой частотой сосудистых смертельных исходов (2,21 против 1,41 исхода на 100 человеко-лет; р=0,026). На фоне приема ривароксабана у больных с ФП и ухудшением фильтрационной функцией почек зарегистрировано более медленное снижение клиренса креатинина, чем при использовании варфарина: 3,5 мл/мин против 4,3 мл/мин с момента скрининга (p<0,001). Снижение риска развития инсульта и системных эмболий было достоверно больше на 50% (ОР 0,50 при 95% ДИ от 0,27 до 0,93) на фоне применения ривароксабана, чем варфарина, в отсутствие увеличения риска больших и небольших клинически значимых кровотечений (ОР 1,06 при 95% ДИ от 0,8 до 1,39). У больных, у которых в процессе исследования клиренс креатинина снизился до 30—49 мл/мин, но они продолжали принимать ривароксабан в дозе 20 мг/сут, риск развития инсульта и системных эмболий по сравнению с приемом варфарина снизился на 73% (ОР 0,27 при 95% ДИ от 0,09 до 0,83) без увеличения риска больших и небольших клинически значимых кровотечений (ОР 1,01 при 95% ДИ от 0,74 до 1,38) (рис. 3). Следовательно, для больных с ФП и ухудшением фильтрационной функции почек терапия ривароксабаном является более предпочтительной стратегией, чем варфарин, в снижении риска развития ТЭО без увеличения риска геморрагических осложнений.
Одним из самых дискуссионных вопросов в выборе АКТ у больных с ФП является использование ее у лиц, находящихся на диализной терапии.
Известно, что ФП регистрируется у 1 из 8 больных с терминальной стадией ХБП, находящихся на диализе, и частота ее составляет 2,7 на 100 человеко-лет [22]. ФП ассоциируется с увеличением риска смерти у больных, получающих заместительную терапию [22].
Не представлено РКИ по оценке пероральных антикоагулянтов у больных, находящихся на диализной терапии [63], и у пациентов c тяжелой ХБП при клиренсе креатинина 25—30 мл/мин [56—58].
Ряд анализов наблюдательных исследований применения варфарина у больных с ФП, находящихся на диализной терапии, показал нейтральный эффект препарата в отношении риска развития инсульта и системных эмболий или увеличение этого риска при значительном увеличении риска кровотечений [26, 64—66].
В последнем мета-анализе, в который было включено 20 наблюдательных исследований (n=56 146), применение варфарина у больных с терминальной стадией ХБП не привело к снижению риска смерти, связанной с развитием инсульта (ОР 0,92 при 95% ДИ от 0,74 до 1,16), риска всех инсультов (ОР 1,01 при 95% ДИ от 0,81 до 1,26). При этом использование варфарина ассоциировалось с увеличением риска всех кровотечений (ОР 1,21 при 95% ДИ от 1,01 до 1,44) [67].
В другом мета-анализе, в который было включено 20 обсервационных исследований, найдено, что любая АКТ (АВК, НОАК, гепарин, низкомолекулярные гепарины) у 31 321 больного с ФП, получающих заместительную терапию, приводила к увеличению риска развития инсульта на 45% (при 95% ДИ от 13 до 88%), ИИ на 13% (при 95% ДИ от 4 до 34%), геморрагического 38% (при 95% ДИ от 3 до 85%), всех кровотечений на 31% (при 95% ДИ от 12 до 53%) при снижении риска развития всех ТЭО на 44% (при 95% ДИ от 38 до 56%) [68]. АКТ не влияла на риск смерти от сердечно-сосудистых заболеваний и от всех причин. Авторы делают вывод, что мета-анализ наблюдательных исследований представляет недостаточно подтверждающих доказательств преимуществ АКТ, а в большей степени демонстрирует аргументы о ее негативном влиянии на прогноз у больных с ФП, находящихся на диализе. Поэтому нельзя интерполировать результаты РКИ, в которых изучались эффективность и безопасность антикоагулянтов у больных с ФП без терминальной ХБП (критерий исключения), на популяцию пациентов с тяжелой почечной дисфункцией, получающих заместительную терапию. Следовательно, для окончательного решения вопроса о показаниях или противопоказания использования АКТ у больных с ФП, получающих диализную терапию, необходимо проведение РКИ.
Данные эффективности и безопасности НОАК у больных с терминальной стадией ХБП, а также находящихся на гемодиализе, представлены в небольших нерандомизированных клинических исследованиях [69—71], которые позволили Управлению по конт-ролю за качеством пищевых продуктов и лекарственных препаратов в США зарегистрировать ривароксабан, дабигатран и апиксабан для профилактики ТЭО у больных данной категории [72]. Более того, согласно инструкции к препаратам ривароксабана и дабигатрана, допускается использование этих средств при клиренсе креатинина до 15 мл/мин, дабигатрана — только при клиренсе креатинина до 30 мл/мин.
Однако в международных и российских рекомендациях выбор АКТ при ФП у больных, находящихся на гемодиализе, не определен и представлены противоположные мнения. В российских рекомендациях все НОАК противопоказаны при клиренсе креатинина <30 мл/мин [21]. Согласно американским рекомендациям, для больных ФП при риске инсульта по шкале CHA2DS2-VASc ≥2, находящихся на гемодиализе, рекомендуется рассмотреть применение варфарина (класс II, уровень B), что, безусловно, спорно и не всеми исследователями признано [7]. В дополнении к практическим рекомендациям Европейской ассоциации по нарушениям ритма сердца указано, что в отсутствие клинических данных или опыта следует избегать терапии НОАК у пациентов с ФП на гемодиализе или с СКФ ≤15 мл/мин, АВК могут быть более подходящей альтернативой [73].
Согласно рекомендациям Канадского общества по сердечно-сосудистым заболеваниям, больным с ФП и ХБП при клиренсе креатинина <30 мл/мин или находящимся на диализной терапии не рекомендуется в качестве повседневной практики назначать АКТ [74]. В новых Европейских рекомендациях по ФП нет конкретных указаний, как действовать клиницисту при выборе АКТ у больных с ФП, находящихся на гемодиализе [1]. Рассмотрены противоречивые данные наблюдательных исследований, рекомендовано проведение РКИ с включением больных с ФП и терминальной стадией ХБП.
Международное научное сообщество разделилось на противников и сторонников назначения пероральных антикоагулянтов больным с ФП и терминальной стадией ХБП [75, 76]. Единое мнение обеих сторон заключается в том, что необходимы РКИ.
Самое главное, что, согласно новым рекомендациям ЕОК, до инициации АКТ у всех больных с ФП необходимо оценивать функцию почек на основании показателей креатинина сыворотки крови или клиренса креатинина для выявления ХБП и выбора дозы антикоагулянта (класс I, уровень В) [1]. У всех пациентов с ФП, получающих пероральные антикоагулянты, должна быть также оценена функция почек для выявления ХБП, и при необходимости проведена коррекция дозы принимаемого антикоагулянта (класс IIa, уровень В).
В дополнении к Практическим рекомендациям Европейской ассоциации по нарушениям ритма сердца также отмечена необходимость регулярного мониторинга функции почек в зависимости от ее исходного уровня с целью коррекции дозы антикоагулянта при необходимости [73, 77].
Так, при клиренсе креатинина >60 мл/мин рекомендуется контролировать данный показатель ежегодно, при клиренсе креатинина 30—59 мл/мин, а также у больных старше 75 лет, у больных, принимающих дабигатран, — каждые 6 мес, при клиренсе креатинина <30 мл/мин — каждые 3 мес. Кроме того, проверять функцию почек необходимо каждый раз у больных с ФП при подозрении на ее ухудшение: инфекция, использование нефротоксичных сопутствующих препаратов, при наличии признаков гиповолемии и дегидратации.
Почему во всех рекомендациях для оценки функции почек даны указания рассчитывать клиренс креатинина, т.е. применять формулу Кокрофта—Голта, которая неточна в отсутствие стандартизации на площадь поверхности тела пациента, а не более современную формулу CKD-EPI, в том числе с оценкой цистатина С как более раннего и точного маркера снижения фильтрационной функции почек [78]?
Вероятно, это связано с тем, что во всех завершившихся РКИ с варфарином и НОАК для оценки функции почек использовался клиренс креатинина, и подбор дозы ривароксабана, апиксабана и эдоксабана проводился на основании данного критерия. Соответственно, в инструкции к препаратам также расчет дозы или ее коррекция основаны на уровне клиренса креатинина. При этом для более точной оценки состояния фильтрационной функции почек у больного с ФП можно рассчитать как клиренс креатинина, так СКФ по формуле CKD-EPI.
Следует также помнить, что в некоторых случаях использование всех расчетных методов оценки функции почек некорректно, а именно: 1. Нестандартные размеры тела (пациенты с ампутацией конечностей, бодибилдеры); 2. Выраженные истощение и ожирение (17 кг/м2>ИМТ >40 кг/м2); 3. Беременность; 4. Заболевания скелетной мускулатуры (миодистрофии); 5. Параплегия и квадриплегия; 6. Вегетарианская диета; 7. Быстрое снижение функции почек (острый и быстро прогрессирующий гломерулонефрит, острое повреждение почек); 8. Необходимость назначения токсичных препаратов, выводимых почками (например, химиотерапия); 9. При решении вопроса о начале заместительной почечной терапии; 10. Больные с почечным трансплантатом.
В этих случаях для более точной оценки наличия дисфункции почек рекомендуется выполнение пробы Реберга—Тареева или определение цистатина С в сыворотке крови.
Как же в действительности осуществляется АКТ у больных с неклапанной ФП и ХБП? По данным Европейского регистра, в который был включен 41 центр, продемонстрировано, что в 39 (95,1%) центрах оценивают функцию почек исходно до назначения АКТ, в 37 (90,2%) также и на фоне лечения [79]. Но в 13 (31,7%) центрах повторная оценка функции почек при приеме антикоагулянтов проводилась более чем через год лечения. В 31% центров у больных с ФП с легкой и умеренной стадией ХБП АКТ не назначалась или использовалась ацетилсалициловая кислота, иногда устанавливался окклюдер в области ушка левого предсердия, если при этом риск кровотечений по шкале HAS-BLED был 3 балла и более. Среди антикоагулянтов больным с тяжелой ХБП или получающим заместительную терапию наиболее часто назначался варфарин, при ХБП в додиализной стадии — НОАК. Радиочастотная абляция у больных с ФП и ХБП не выполнялась в 20 (48,7%) центрах. Полученные данные свидетельствуют, что в современных рекомендациях по ФП раздел выбора АКТ при ХБП в зависимости от ее стадии, а также у больных на диализной терапии и после трансплантации почек представлен неполно, предложения нередко противоречивы.
Таким образом, у пациентов с неклапанной ФП и ХБП значительно повышены не только риск кровотечений, но и ТЭО, а также общей смертности. В целях обеспечения безопасности, НОАК являются более предпочтительной стратегией, чем применение АВК у больных ХБП в додиализной стадии. Варфарин может способствовать вазоренальной кальцификации. При ухудшении фильтрационной функции почек на фоне лечения антикоагулянтами у больных с ФП ривароксабан более предпочтителен, чем варфарин, в плане снижения риска развития инсульта и системных эмболий без увеличения риска всех кровотечений. Все НОАК одобрены FDA для применения их у больных, находящихся на гемодиализе. Согласно инструкции, препараты ривароксабан и апиксабан допускаются к использованию у больных с терминальной стадией ХБП при клиренсе креатинина не менее 15 мл/мин. В настоящее время для разрешения дискуссионных вопросов применения пероральных антикоагулянтов у больных с неклапанной фибрилляцией и ХБП требуется проведение РКИ.



