В последние годы субклинический гипотиреоз (СГТ) рассматривается как фактор сердечно-сосудистого риска (ССР) [1]. Известно, что тиреоидные гормоны регулируют гемодинамические параметры, синтез структурных белков миокарда, опосредуют выведение атерогенных фракций липидов, катаболизм гомоцистеина плазмы [2, 3]. В условиях гипотиреоза, как правило, выявляют атерогенную дислипидемию, гипергомоцистеинемию, туловищное ожирение, инсулинорезистентность, повышение жесткости сосудистой стенки и периферического сосудистого сопротивления, снижение сократительной способности и диастолическую дисфункцию миокарда, что, безусловно, способствует формированию атеросклеротических изменений [4–6]. Патофизиологические сдвиги при СГТ менее изучены, и его значение в формировании коронарного атеросклероза остается предметом дискуссий [7, 8]. В то же время частота СГТ в общей популяции достаточно велика [9, 10]. Работ по изучению распространенности СГТ среди больных ишемической болезнью сердца (ИБС) в Санкт-Петербурге до настоящего времени представлено не было.
Верхняя граница нормы тиреотропного гормона (ТТГ) достаточно условна, и 95% общей популяции имеет диапазон его значений от 0,4 до 2,5 мМЕ/л [11]. Значения от 2,5 до 4,0 мМЕ/л рассматриваются как пограничные, а значения более 4,0 мМЕ/л принято расценивать как гипотиреоз. В последние годы нормативы ТТГ активно обсуждаются, в частности рассматривается целесообразность некоторого увеличения верхней границы нормы ТТГ для пожилых пациентов. Однако по результатам недавних исследований увеличение уровня ТТГ ассоциировано с риском ИБС и сердечно-сосудистых событий. Исследования отечественных авторов показали, что пороговые значения ТТГ, ассоциированные с ССР, находятся в диапазоне 4,40–5,85 мЕд/л (в среднем 5,25 мЕд/л) [12].
Цель исследования: оценить уровень ТТГ у больных ИБС с коронарографически подтвержденным атеросклерозом для изучения вклада СГТ в атерогенез.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводилось в период с 2006 г. по 2008 г. в клинике кафедры терапии факультетской с курсом эндокринологии, кардиологии и функциональной диагностики ПСПбГМУ им. акад. И.П. Павлова. В исследование включались больные с диагнозом направления «ишемическая болезнь сердца» для проведения коронарографического исследования и решения вопроса о дальнейшей хирургической реваскуляризации миокарда.
На первом этапе для выявления распространенности СГТ среди больных ИБС с коронарографически подтвержденным атеросклерозом было выполнено скрининговое исследование уровня ТТГ.

На втором этапе с целью определения вклада СГТ в коронарный атеросклероз было выполнено одномоментное поперечное исследование, которое включало однократное обследование группы больных ИБС. Наличие СГТ подтверждали повышением уровня ТТГ >4,0 мМЕ/л при условии нормального уровня свободного Т4. Тяжесть коронарного атеросклероза оценивали по данным коронарографического исследования. Тяжелым поражением коронарного русла считали гемодинамически значимый стеноз 3-х основных коронарных артерий. Результаты коронарографического исследования оценивали сертифицированные специалисты.
Всего были обследованы 870 больных ИБС, среди них 193 женщины и 677 мужчин.
Критерии включения в исследование:
- больные обоего пола от 18 до 80 лет, поступившие в кардиохирургическое отделение с диагнозом направления ИБС для проведения коронарографического исследования;
- подписанное информированное согласие на участие в исследовании.
Критерии исключения:
- состояние после резекции щитовидной железы (ЩЖ);
- нарушение функции ЩЖ в анамнезе;
- тиреостатическая терапия или заместительная терапия тиреоидными гормонами;
- лечение амиодароном, препаратами лития или глюкокортикоидами;
- облучение шеи или радиойодтерапия в анамнезе.
У всех больных оценивался возраст на момент обследования, семейный анамнез сахарного диабета (СД) и сердечно-сосудистых заболеваний. По данным анамнеза и результатам ранее проведенных исследований оценивалось наличие артериальной гипертензии (АГ) и ИБС. Учитывался факт курения, а также характер проводимой терапии. Определяли вес и рост пациентов с последующим вычислением индекса массы тела (ИМТ) по формуле: вес (кг)/рост (м2).
Забор крови всем включенным в исследование пациентам проводился утром между 8 и 9 часами до проведения коронарографического исследования. Кровь брали из локтевой вены после 12-часового голодания. Исследование концентрации гормонов ЩЖ (свободный Т3, свободный Т4) и ТТГ в сыворотке крови проводилось методом иммуноферментного анализа с использованием реагентов III поколения. Определение уровня гомоцистеина плазмы также проводилось иммуноферментным методом. Концентрации общего холестерина (ОХС), липопротеинов высокой плотности (ХС ЛПВП), липопротеинов низкой плотности (ХС ЛПНП), триглицеридов (ТГ) определяли в сыворотке крови ферментным методом.
Полученные в процессе исследования медико-биологические данные обрабатывали с использованием программной системы Statistica for Windows (версия 9). Характеристики выборок были представлены в виде среднего значения ± ошибка среднего. Для описания относительного риска развития заболевания рассчитывали отношение шансов (OR). Модели оценки риска развития сосудистых нарушений у больных ИБС с различным функциональным состоянием ЩЖ разработаны с использованием метода логистической регрессии. Критерием статистически значимых различий получаемых результатов считали общепринятую в медицине величину р<0,05. Прогностическая модель предикторов неблагоприятного течения заболевания была разработана по методу построения классификационных деревьев.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В исследовании участвовали 870 больных ИБС: 677 мужчин (77,8%) и 193 женщины (22,2%). Средний возраст мужчин и женщин достоверно не различался и в среднем составил 56,65±0,29 года (мужчины – 56,65±0,34 года, женщины – 57,02±0,58 года; p>0,05). ИМТ в среднем составил 27,11±0,09 кг/м2 (мужчины – 27,01±0,17, женщины – 28,5±0,31; р=0,01).
СД 2 типа был выявлен у 15,4% пациентов (n=134), все больные получали адекватную сахароснижающую терапию. На момент включения в исследование у большинства больных контроль гликемии был удовлетворительным.
Среди обследованных больных ИБС 28,4% не страдали АГ, 47,5% имели АГ 1 степени, 24,1% – АГ 2 и 3 степени. Большинство больных (59,7%) в прошлом перенесли 1 инфаркт миокарда и более.
Анализ данных семейного анамнеза показал, что наследственность по сердечно-сосудистым заболеваниям была отягощена у 66,2% больных. Выявлена достоверная взаимосвязь между наследственным фактором и АГ у 74,8% больных (р<0,01).
Все больные ИБС были распределены по группам в зависимости от уровня ТТГ:
- 1-я группа (низкий уровень ТТГ) – ТТГ <0,5 мМЕ/л: 44 пациента (5,1%), средний уровень ТТГ 0,29±0,03 мМЕ/л;
- 2-я группа (нормальный уровень ТТГ) – ТТГ от 0,5 до 2,4 мМЕ/л: 525 человек (60,3%), средний уровень ТТГ 1,52±0,03 мМЕ/л;
- 3-я группа (пограничный уровень ТТГ) – уровень ТТГ от 2,5 до 4,0 мМЕ/л: 196 больных (22,5%), средний уровень ТТГ 3,19±0,03 мМЕ/л;
- 4-я группа (повышенный уровень ТТГ) – уровень ТТГ >4,0 мМЕ/л: 105 больных (12,1%), средний уровень ТТГ 6,60±0,38 мМЕ/л. Уровень свободного Т4 в группе был от 9,5 до 19,1 пмоль/л и в среднем составил 14,18±4,86 пмоль/л.
Уровень ТТГ был значимо выше у женщин, чем у мужчин (3,30±0,23 против 2,20±0,07 мМЕ/л; р=0,01). Распространенность СГТ среди обследованных больных также была выше у женщин (23,5 против 8,8%; р=0,001). Женский пол был ассоциирован с увеличением риска пограничного ТТГ (OR=1,89; доверительный индекс [CI]=1,28–2,79) и СГТ (OR=3,91; CI=2,5–6,10). Положительная корреляционная связь между уровнем ТТГ и возрастом была выявлена у обследованных женщин, больных ИБС (r=0,19, р=0,01). У обследованных мужчин таких закономерностей не было обнаружено.
СГТ у больных ИБС был ассоциирован с увеличением риска избыточного веса (OR=1,28; CI=0,67–2,43) и ожирения (OR=3,43; CI=1,80–6,53). В группе больных ИБС с СГТ ожирение и избыточный вес выявлялись значимо чаще (рис. 1).
У больных ИБС с СД 2 типа средний уровень ТТГ был значимо выше (2,97±0,23 мМЕ/л), чем у больных ИБС без диабета (2,45±0,09 мМЕ/л; р<0,01). Среди больных СД 2 типа СГТ был выявлен в 19,4% случаев, а среди больных без диабета – в 12,1% (р=0,042). СГТ также был ассоциирован с увеличением риска АГ (OR=1,96; CI=1,07–3,59; р=0,04). Таким образом, в группе обследованных больных СГТ был ассоциирован с избыточным весом и ожирением, СД 2 типа, наличием АГ, что, вероятно, потенцирует ССР у больных ИБС.
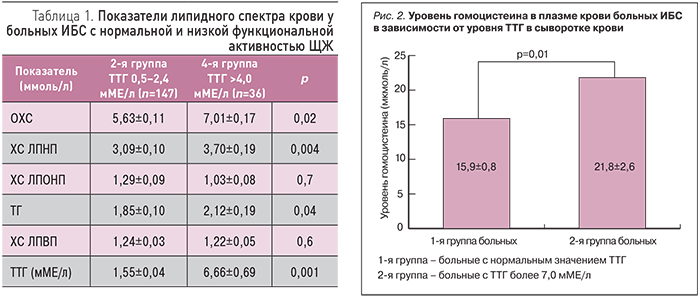
Для изучения влияния СГТ на липидный метаболизм было проведено сопоставление показателей липидного спектра крови у больных ИБС с нормальной функцией ЩЖ (2-я группа) и со сниженной ее функцией (4-я группа) среди пациентов, не получавших постоянной гиполипидемической терапии. Результаты представлены в табл. 1.
Как следует из представленных в табл. 1 данных, у больных гипотиреозом средние уровни ОХС, ХС ЛПНП и ТГ были значимо выше, чем у пациентов с нормальной функциональной активностью ЩЖ. По результатам линейной регрессии при повышении уровня ТТГ на 1 мМЕ/л ОХС повышался на 0,475 ммоль/л, а ХС ЛПНП – на 0,42 ммоль/л.
Проведение корреляционного анализа позволило установить положительную корреляционную связь между уровнями ТТГ и ОХС (r=0,19, р=0,005); между уровнем ТТГ и ХС ЛПНП (r=0,19, р=0,02). Таким образом, по результатам изучения липидного спектра крови и уровня ТТГ у больных ИБС показано, что повышение уровня ТТГ вносит определенный вклад в формирование атерогенной дислипидемии у больных ИБС.
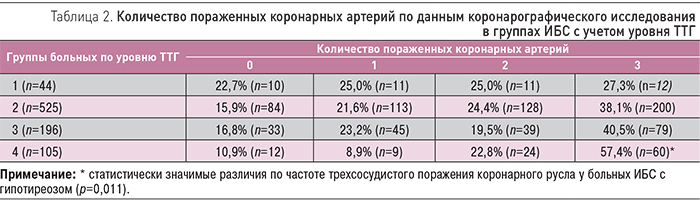
Уровень гомоцистеина плазмы был определен у 73 больных ИБС (31,9% женщин и 68,1% мужчин). Средний уровень гомоцистеина плазмы крови составил 16,12±0,71 мкмоль/л, что несколько превышало верхнюю границу нормы и соответствовало пограничным значениям. Гипергомоцистеинемия (≥15 мкмоль/л) была выявлена у 51,0% больных ИБС, в то время как в общей популяции повышение этого показателя обнаруживают значительно реже. Также была выявлена положительная корреляционная связь между уровнем ТТГ и гомоцистеином плазмы (r=0,54, р=0,01; рис. 2).
Гипергомоцистеинемия является известным фактором ССР. Снижение функциональной активности ЩЖ, т.н. СГТ, потенцирует повышение гомоцистеина плазмы у больных ИБС, что, безусловно, способствует формированию атеросклеротических изменений.
При анализе данных коронарографии учитывали количество пораженных артерий с гемодинамически значимым стенозом более 50%. Согласно результатам проведенного коронарографического исследования, у 16,1% больных не было выявлено гемодинамически значимых стенозов, у 20,5% – выявлено поражение одного сосуда, у 23,1% – двух сосудов, у 40,3% пациентов обнаружено многососудистое поражение коронарного русла. Было проанализировано количество пораженных коронарных артерий по данным коронарографического исследования в группах больных ИБС с учетом уровня ТТГ. Данные представлены в табл. 2. Оказалось, что у больных СГТ (4-я группа) многососудистое поражение коронарных артерий было в 57,4% случаев, в то время в группе с нормальной функцией ЩЖ (2-я группа) оно встречалось у 38,1% пациентов (р=0,011). Таким образом, становится очевидным вклад дисфункции ЩЖ в процессы атерогенеза. У больных СГТ чаще выявляли тяжелые поражения венечных артерий по данным коронарографического исследования. Наличие СГТ ассоциировалось с увеличением риска трехсосудистого поражения в 2,31 раза (OR=2,31; CI=1,20–4,46; р=0,031). В данном исследовании с помощью метода построения классификационных деревьев для ТТГ были получены пороговые значения, совпадающие с традиционной градацией, принятой в современной эндокринологии. При этом пороговое значение ТТГ, ассоциированное с тяжелым коронарным атеросклерозом, составило 2,41 мМЕ/л. Многососудистое поражение коронарных артерий также было ассоциировано со старшим возрастом, гипергомоцистеинемией, фактом табакокурения.
Представленные данные подтверждают предположение о том, что СГТ потенцирует патогенетические механизмы, лежащие в основе атерогенеза, и способствует индукции и прогрессированию коронарного атеросклероза.
ЗАКЛЮЧЕНИЕ
По результатам проведенного исследования становится очевидным, что дисфункция ЩЖ часто выявляется у пациентов с ИБС. Клинические симптомы гипотиреоза неспецифичны, и отсутствие клиники не исключает наличия гипотиреоза по лабораторным данным [13]. Поэтому больным с ССР показано скрининговое определение уровня ТТГ для своевременного выявления дисфункции ЩЖ. СГТ ассоциирован с основными факторами сосудистого риска: атерогенной дислипидемией, гипергомоцистеинемией, туловищным ожирением, АГ. Повышение верхней границы нормы ТТГ для пожилых пациентов представляется нецелесообразным. Своевременное выявление и лечение СГТ у больных из группы ССР, вероятно, позволит модифицировать уже имеющиеся факторы риска и будет предупреждать прогрессию коронарного атеросклероза.


