Патология сердечно-сосудистой и дыхательной систем по-прежнему доминирует в структуре заболеваемости и смертности населения во всем мире. В развитых странах летальность от кардиоваскулярных заболеваний в течение многих десятилетий занимает 1 место, а хроническая обструктивная болезнь легких (ХОБЛ), по прогнозам Всемирной организации здравоохранения, к 2030 г. выйдет на 4 место среди причин смерти [1–3]. Особую актуальность в условиях продолжающегося старения населения приобретает коморбидность указанных состояний, что обусловлено значительным ухудшением прогноза таких пациентов. Так, по данным ряда исследований [4, 5], признаки ХОБЛ находят у каждого второго пациента, страдающего хронической сердечной недостаточностью (ХСН). Появление кардиореспираторной коморбидности, сопровождающейся синдромом взаимного отягощения, формирует определенные особенности клиники в виду общности некоторых звеньев патогенеза, которые включают развитие системного воспалительного ответа, оксидативного стресса и эндотелиальной дисфункции.
Цель исследования: оценка уровня основных показателей липидного профиля у больных ХСН ишемического генеза и сопутствующей ХОБЛ.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено проспективное когортное исследование с участием 102 пациентов (58 мужчин и 44 женщин, средний возраст 68,2±4,5 года): 54 пациента, страдающих ХСН ишемического генеза в сочетании с ХОБЛ (основная группа), и 48 больных ХСН ишемической этиологии без бронхолегочной патологии (группа сравнения).
В исследование были включены пациенты с ХСН IІ–IV функционального класса (ФК) по NYHA со сниженной (<45%) фракцией выброса левого желудочка (ФВ ЛЖ) без ХОБЛ и пациенты с ХСН IІ–IV ФК со сниженной (<45%) ФВ ЛЖ и сопутствующей ХОБЛ (IІ–III спирометрическая стадия по GOLD), с инфарктом миокарда и/или стенокардией в анамнезе, подписавшие информированное согласие. Критериями исключения явились: прием статинов и/или фибратов; период ˂3 мес после острых сердечно-сосудистых событий; сопутствующие заболевания в стадии декомпенсации; активные воспалительные/инфекционные заболевания или новообразования; алкогольная и наркотическая зависимость. У всех больных на визите включения изучали жалобы, анамнез заболевания, особенности его течения и состояние основных функциональных систем.
 Для оценки липидного профиля определяли уровень общего холестерина (ОХ), триглицеридов (ТГ), холестерина липопротеидов высокой плотности (ХС ЛПВП) и холестерина липопротеидов низкой плотности (ХС ЛПНП) колориметрическим фотометрическим методом на автоматическом анализаторе «AU480» (Beckman Coulter, США). Определение уровня С-реактивного белка (СРБ) проводили с помощью иммунотурбометрического метода с латексным усилением на автоматическом биохимическом анализаторе «Cobas 6000» (Roche Diagnostics, Швейцария) с использованием комплекта тест-систем анализатора. Концентрацию интерлейкина-8 (ИЛ-8) и фактора некроза опухоли-α (ФНО-α) определеляли методом твердофазного иммуноферментного анализа на программированном аппарате «Multiscan» (LabSystem, Финляндия) с использованием коммерческих тест-систем «Bender MedSystems» (Bioscience, Австрия).
Для оценки липидного профиля определяли уровень общего холестерина (ОХ), триглицеридов (ТГ), холестерина липопротеидов высокой плотности (ХС ЛПВП) и холестерина липопротеидов низкой плотности (ХС ЛПНП) колориметрическим фотометрическим методом на автоматическом анализаторе «AU480» (Beckman Coulter, США). Определение уровня С-реактивного белка (СРБ) проводили с помощью иммунотурбометрического метода с латексным усилением на автоматическом биохимическом анализаторе «Cobas 6000» (Roche Diagnostics, Швейцария) с использованием комплекта тест-систем анализатора. Концентрацию интерлейкина-8 (ИЛ-8) и фактора некроза опухоли-α (ФНО-α) определеляли методом твердофазного иммуноферментного анализа на программированном аппарате «Multiscan» (LabSystem, Финляндия) с использованием коммерческих тест-систем «Bender MedSystems» (Bioscience, Австрия).
Диагноз ХОБЛ устанавливался в соответствии с критериями ATS/ERS (2005) [3] после проведения спирографического исследования с оценкой форсированной жизненной емкости легких (ФЖЕЛ), объема форсированного выдоха за первую секунду (ОФВ1) и отношения ОФВ1/ ФЖЕЛ. В течение 20 мин до его начала пациент находился в спокойном состоянии, испытуемому запрещалось курить. Исследование проводилось в положении больного сидя, после его предварительного тщательного инструктирования. Для предотвращения утечек воздуха пациенту накладывали носовой зажим. В начале исследования устанавливался загубник, и больной спокойно дышал в течение 30–60 с. Важным условием являлась достаточная продолжительность выдоха (не менее 6 с) и поддержание максимального экспираторного усилия в течение всего выдоха до момента его полного завершения. В расчет принимались наибольшие значения ФЖЕЛ из трех правильно выполненных маневров; при этом следующий маневр не должен был отличаться от выбранного больше, чем на 200 мл. Для бронходилатационного теста использовали сальбутамол в дозе 400 мкг. Проба считалась положительной при повышении ОФВ1 на ≥ 12% от должного или ≥200 мл.
 Исследование было проведено в соответствии с международными стандартами Надлежащей клинической практики. Протокол исследования и форма информированного согласия для пациентов были одобрены Локальной комиссией по вопросам этики Института неотложной и восстановительной хирургии им. В.К. Гусака (протокол заседания № 11 от 23.09.2013).
Исследование было проведено в соответствии с международными стандартами Надлежащей клинической практики. Протокол исследования и форма информированного согласия для пациентов были одобрены Локальной комиссией по вопросам этики Института неотложной и восстановительной хирургии им. В.К. Гусака (протокол заседания № 11 от 23.09.2013).
Обработку результатов выполняли на персональном компьютере с использованием Мiсrоsоft Exсel и пакетов прикладных статистических программ МedStat и Statistica 6.0. При планировании дизайна исследования с помощью номограммы Альтмана был рассчитан необходимый размер выборки: в исследование потребовалось включить по меньшей мере 90 пациентов (по 45 в каждую группу), чтобы при уровне значимости 0,05 обеспечить 80% мощность обнаружения разницы по частоте наступления конечной точки (дислипидемии) между группами. При этом на основании данных выполненного авторами предварительного пилотного исследования предполагалось, что частота развития конечной точки в основной группе составит 72%, а в группе сравнения – 42%. Стандартизованная разница показателя составила 0,61.
Для проверки распределения на нормальность использовались критерии χ2 и W Шапиро–Уилка. При нормальном распределении данные приводились в виде среднее ± стандартное отклонение (m±σ) – для непрерывных величин. Для сравнения двух выборок переменных, подлежащих нормальному закону распределения, использовали t-критерий Стьюдента. Сравнение относительных величин проводилось с помощью критерия χ2. Для оценки взаимосвязи между признаками использовали коэффициент корреляции Пирсона (r) и показатель ранговой корреляции Спирмена, а также расчет относительного риска (ОР). ОР определяли с 95% доверительным интервалом (ДИ). Для его расчета использовалось угловое преобразование Фишера. Во всех случаях проверки гипотез различия считались статистически значимым при величине p<0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
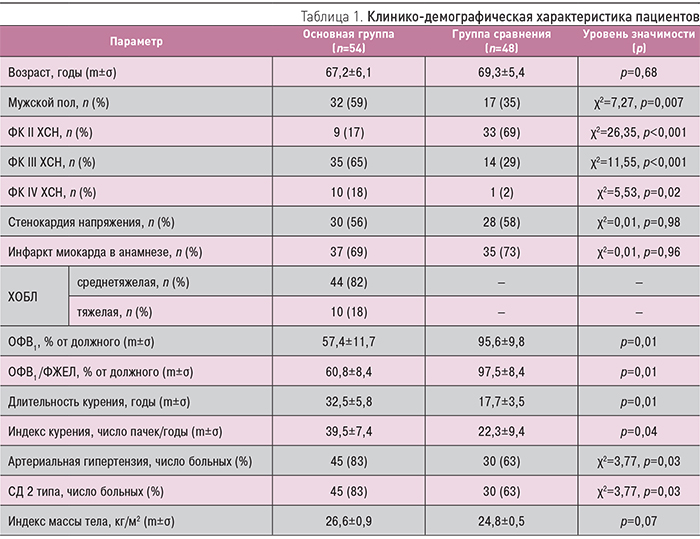
Основная и группа сравнения были сопоставимы по возрасту и индексу массы тела (табл. 1). В группе с коморбидной патологией было значительно больше мужчин. ХОБЛ была представлена преимущественно среднетяжелой формой, что отражалось в существенном снижении ОФВ1 и ОФВ1/ФЖЕЛ. Индекс и длительность курения были существенно (р<0,05) выше у больных ХСН в сочетании с ХОБЛ. Кроме того, пациенты с коморбидной патологией имели более высокий ФК ХСН по NYHA. В основной группе также была выявлена большая частота артериальной гипертензии и сахарного диабета (СД).
 Анализ липидограмм показал, что у пациентов с коморбидной патологией регистрируются достоверно (р<0,05) более высокие уровни ОХ и ХС ЛПНП. Концентрация ХС ЛПВП оказалась более низкой (р<0,05) в основной группе. В уровнях ТГ существенной разницы между группами не было (табл. 2).
Анализ липидограмм показал, что у пациентов с коморбидной патологией регистрируются достоверно (р<0,05) более высокие уровни ОХ и ХС ЛПНП. Концентрация ХС ЛПВП оказалась более низкой (р<0,05) в основной группе. В уровнях ТГ существенной разницы между группами не было (табл. 2).
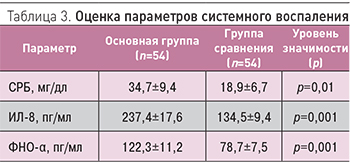
Анализ параметров системного воспаления показал статистически значимое (р<0,05) повышение концентраций СРБ, ИЛ-8 и ФНО-α у пациентов с кардиореспираторной патологией (табл. 3).
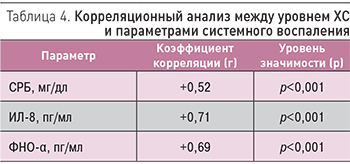
Корреляционный анализ показал выраженную положительную связь уровня ОХ крови с концентрацией СРБ, ИЛ-8 и ФНО-α (табл. 4), а значимыми (р<0,05) факторами риска развития гиперхолестеринемии оказались мужской пол (ОР 2,18, 95% ДИ 1,05–5,12), длительность (ОР 4,32, 95% ДИ 3,22–8,7) и индекс курения (ОР 3,2, 95% ДИ 1,78–5,42), наличие ХОБЛ (ОР 3,4, 95% ДИ 1,7–6,6) и СД (ОР 4,2, 95% ДИ 2,82–8,1).
Таким образом, результаты нашего исследования показали, что сочетание ХСН и ХОБЛ сопряжено с развитием нарушения липидного обмена, которое проявляется гиперхолестеринемией, высокой концентрацией ЛПНП и пониженным содержанием ЛПВП, что, вероятнее всего, обусловлено активацией системного воспалительного ответа и агрессивным воздействием факторов риска, таких как пол, наличие СД, длительность и индекс курения.
Как известно, развитие и прогрессирование ХСН и ХОБЛ объединено рядом факторов, к которым можно отнести мужской пол, курение, избыточную массу тела, низкую физическую активность, обструктивное апноэ во сне, нарушение гемодинамики в малом круге кровообращения, нежелательные эффекты некоторых лекарственных средств [6]. Следует отметить, что взаимное прогрессирование ХСН и ХОБЛ основывается и на общности некоторых звеньев патогенеза: системный воспалительный ответ, оксидативный стресс, эндотелиальная дисфункция, гиперактивация ренин-ангиотензин-альдостероновой системы и др. [6].
Все вышесказанное позволяет создать картину порочного круга взаимной коморбидности ХОБЛ и ХСН. Обострение ХОБЛ, вызывая системный воспалительный ответ и оксидативный стресс, ведет к ухудшению коронарного кровотока вследствие дестабилизации атеросклеротических бляшек, развития синдрома гиперкоагуляции и нарушения эндотелиальной функции сосудов [7]. С другой стороны, снижение сердечного выброса на фоне усугубляющейся ишемии миокарда приводит к застою в малом круге кровообращения, что нарушает нормальные механизмы мукоцилиарного клиренса, усиливает обструкцию, активизирует микрофлору и приводит к обострению ХОБЛ.
Патогенетические механизмы, лежащие в основе гиперхолестеринемии у пациентов с ХОБЛ, продолжают изучаться. Предполагают, что увеличение уровня ЛПНП, ТГ, снижение концентрации ЛПВП у пациентов с ХОБЛ тесно связаны с активностью курения [8, 9]. Подобные взаимосвязи мы наблюдаем и в нашем исследовании, которое показало взаимосвязь длительности и активности курения с выраженностью дислипидемии у пациентов с сочетанной патологией. Кроме того, в ряде исследований отмечено [10, 11], что факторами риска вторичных дислипидемий зачастую выступают мужской пол и нарушения обмена глюкозы, что также подтверждено результатами нашего исследования.
К настоящему времени исследования, посвященные изучению дислипидемии при ХОБЛ, ограничены и остается неясным, является ли она независимым фактором, который увеличивает риск сердечно-сосудистой заболеваемости и смертности при сопутствующей ХОБЛ. Вместе с тем отмечается [12], что дислипидемии и воспаление сопровождают ряд заболеваний, таких как ожирение, СД и ХОБЛ. Последние наблюдения показали [13], что липиды играют центральную роль в активации воспалительных путей и увеличении производства воспалительных цитокинов. В частности, атерогенные классы липопротеинов (ЛПНП) являются потенциально провоспалительными факторами. Напротив, ЛПВП являются противовоспалительными факторами. ЛПНП легко проникают в стенку артерии через эндотелиальную мембрану и там подвергаются различной степени модификации, которая включает оксидацию липидов и апопротеина-B, агрегацию частиц, гидролиз фосфолипидов и др. Модифицированные ЛПНП вовлечены во многие этапы процесса воспаления: они активируют эндотелиальные клетки, продуцирующие MCP-1, который привлекает моноциты из просвета сосуда в субэндотелиальное пространство, способствуют ускорению дифференциации моноцитов в макрофаги и вызывают выделение макрофагами цитокинов (ИЛ-1,ФНО-α) [13].
С другой стороны, хроническое воспаление приводит к структурной модификации липопротеидов, ассоциированной с высокой атерогенностью [14]. Вероятно, более агрессивный системный воспалительный ответ при сочетанной кардиореспираторной патологии также является причиной повышенной концентрации как ОХ, так и его атерогенных фракций.
ЗАКЛЮЧЕНИЕ
Таким образом, в настоящее время проблема коморбидности ХСН и ХОБЛ приобретает исключительную актуальность, что обусловлено феноменом взаимного отягощения и значительным ухудшением прогноза пациентов.



