Смертность от пневмонии остается высокой и, несмотря на повсеместное лечение пневмонии антибиотиками, занимает 8-е место в мире среди причин смертности [1–4]. Высокий уровень летальности характерен не только для острого периода болезни, он сохраняется и в течение последующего года, достигая в отдельных популяциях пациентов уровня смертности до 40% [1–4].
Отличительной особенностью российской популяции пациентов, госпитализированных по поводу декомпенсации хронической сердечной недостаточности (ХСН), по данным регистра ОРАКУЛ-РФ (2496 пациентов), а также по данным Павловского регистра (1001 пациент), в сравнении с крупными мировыми регистрами пациентов, является большое количество пневмоний, выявленных в момент госпитализации [5–8]. Сочетание ХСН и пневмонии не только оказывает выраженное негативное влияние на отдаленный и ранний прогноз [9–18], но и видоизменяет типичную клиническую картину, что в свою очередь затрудняет диагностику и лечение. В доступной нам литературе не удалось обнаружить анализ влияния флоры, вызвавшей пневмонию, и самого факта пневмонии на отдаленный прогноз у пациентов с декомпенсацией кровообращения.
Цель исследования: оценить отдаленный прогноз пациентов с декомпенсацией ХСН и пневмонией в зависимости от клинической характеристики пациентов и возбудителя пневмонии.
МАТЕРИАЛЫ И МЕТОДЫ
Одноцентровое проспективное исследование проведено на базе 60-коечного терапевтического отделения скоропомощного стационара.
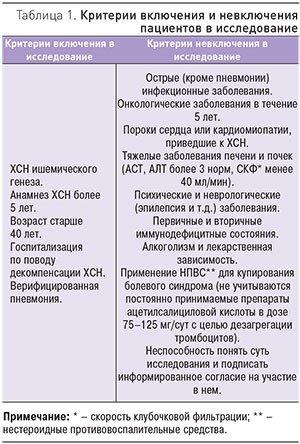 В исследование включены 284 пациента с декомпенсацией ХСН и верифицированной пневмонией. Критерии включения и невключения пациентов в исследование приведены в табл. 1. Диагноз декомпенсации включал одышку или положение ортопноэ; влажные хрипы; периферические отеки; увеличение пульсации яремных вен; дополнительным критерием служила рентгенограмма органов грудной клетки, демонстрирующая признаки застоя по малому кругу кровообращения (МКК). Диагноз пневмонии подтверждался клинически (аускультативная картина: локальное ослабление дыхания, крепитация, влажные несимметричные мелкопузырчатые хрипы) и рентгенологически (негомогенное затемнение легочной ткани); дополнительными критериями подтверждения диагноза пневмонии служили кашель, положительный посев мокроты (забор мокроты проводился под тщательным контролем медицинского персонала), лейкоцитоз, повышение температуры тела и повышение СОЭ. Критерием исключения также считалось наличие анамнестических данных, позволяющих предположить внутригоспитальную или нозокомиальную пневмонию. В период после выписки пациентов из стационара раз в 3 мес в ходе телефонного контакта отслеживали: случаи повторной госпитализации и их причину, летальные исходы, медикаментозную терапию, постоянно принимаемую пациентами, оценивали комплаентность.
В исследование включены 284 пациента с декомпенсацией ХСН и верифицированной пневмонией. Критерии включения и невключения пациентов в исследование приведены в табл. 1. Диагноз декомпенсации включал одышку или положение ортопноэ; влажные хрипы; периферические отеки; увеличение пульсации яремных вен; дополнительным критерием служила рентгенограмма органов грудной клетки, демонстрирующая признаки застоя по малому кругу кровообращения (МКК). Диагноз пневмонии подтверждался клинически (аускультативная картина: локальное ослабление дыхания, крепитация, влажные несимметричные мелкопузырчатые хрипы) и рентгенологически (негомогенное затемнение легочной ткани); дополнительными критериями подтверждения диагноза пневмонии служили кашель, положительный посев мокроты (забор мокроты проводился под тщательным контролем медицинского персонала), лейкоцитоз, повышение температуры тела и повышение СОЭ. Критерием исключения также считалось наличие анамнестических данных, позволяющих предположить внутригоспитальную или нозокомиальную пневмонию. В период после выписки пациентов из стационара раз в 3 мес в ходе телефонного контакта отслеживали: случаи повторной госпитализации и их причину, летальные исходы, медикаментозную терапию, постоянно принимаемую пациентами, оценивали комплаентность.
Средний возраст пациентов составил 72,1±10,1 года (от 42 до 93 лет), мода – 79 лет. 46,5% пациентов, включенных в исследование, – мужчины. Длительность ХСН у пациентов более 5 лет – 84,3%, более 10 лет – 15,7%.
Оценку композиции тела с расчетом тощей массы тела (ТМТ) и ее дефицита проводили методом биоимпендансного исследования состава тела (использовали анализатор оценки баланса водных секторов организма АВС-01 «Медасс»).
Пациенты, имевшие диагноз ХОБЛ, получали ежедневную ингаляционную терапию глюкокортикостероидами (ГКС).
За предшествующий год оценивали общее количество госпитализаций, связанных как с заболеваниями сердечно-сосудистой системы, так и с другими заболеваниями (обострение ХОБЛ, хронического пиелонефрита, декомпенсация сахарного диабета, а также плановая госпитализация для обследования в стационаре или плановая ежегодная госпитализация). В структуре госпитализаций за предшествующий год ведущую роль занимала декомпенсация кровообращения – 79,2% случаев.
Пациентам проведена оценка индекса коморбидности Чарлсона. Оценку степени тяжести пневмонии проводили по шкалам CURB-65 (2010) и PSI (Pneumonia Severity Index) (1997). Статистическую обработку результатов проводили с помощью статистической программы Biostatistics 2.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При проведении посева мокроты на стерильность и чувствительность к антибактериальным препаратам выявлено: в 22,7% – Streptococcus pneumoniae, 19,7% – E. coli, 6,1% – Klebsiella, 1,5% – Proteus, 1,5% – Pseudomonas aueroginosa, 30,3% – микст-инфекция. Микст-инфекция была представлена как сочетанием бактерий между собой (стрептококки + стафилококки, стрептококки + H. influencae, стрептококки + Klebsiella, стрептококки + E. coli, стафилококки + Proteus), так и сочетанием бактерии + грибы (стрептококки + Candida alb., Str. pyogenes + E. coli + Candida alb., стрептококки + дрожжеподобные грибы). При этом в 41,3% случаев при проведении трехкратного ежедневного забора мокроты и посева высеять микрофлору не удалось. Представляло интерес сопоставить клиническую характеристику пациентов с различными результатами посевов мокроты. Из табл. 2 видно, что пациенты, имевшие наиболее тяжелые клинические показатели, относились к группам с выявленными микст-инфекцией, Proteus и Staph. aureus.
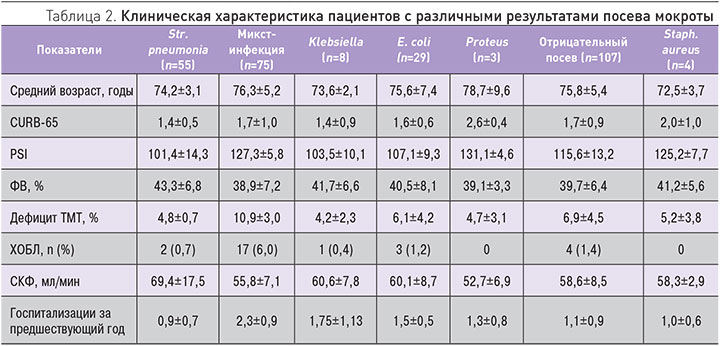
Различия в группах по возрасту, фракции выброса (ФВ), скорости клубочковой фильтрации (СКФ), шкале CURB-65, индексу PSI статистически не значимы. Статистически значимые (р<0,05) различия выявлены по количеству пациентов с ХОБЛ (больше всего в группе с верифицированной микст-инфекцией). Дефицит ТМТ достоверно чаще выявлен в группе пациентов с микст-инфекцией в сравнении с группой с высеянной Str. рneumonia.
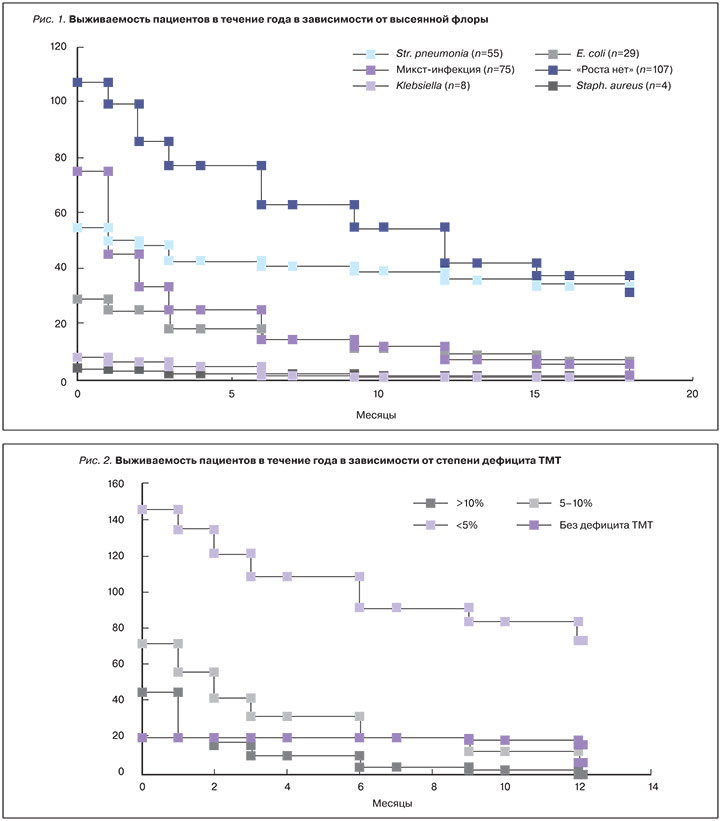
Средний койко-день составил 28,3±5,2. Внутригоспитальная летальность составила 20,4%, в течение полугода после госпитализации достигла 50,4 и 62,3% – в течение 12 мес после госпитализации. Наиболее высокая госпитальная летальность (40%) выявлена в группе пациентов с микст-инфекцией, летальность в течение 12 мес достигла 90,67%. У пациентов с выявленным Str. pneumonia внутригоспитальная летальность составила 9,1%, количество смертельных исходов к 12-му мес после госпитализации 34,6%. Внутригоспитальная летальность в группе «Роста нет» составила 7,1%, годичная летальность – 60,7%. В группе с высеянной E. coli внутригоспитальная летальность составила 20,7%, годичная – 69,0%. В малочисленных группах с высеянными Klebsiella (n=8), Staph. aureus (n=4) и Proteus (n=3) внутригоспитальная летальность составила 25% и 67,7%, к 12-му мес наблюдения – 100%, 75% (3 из 4 пациентов) и 100% соответственно. Таким образом, различия в выживаемости в группах статистически значимы (р<0,05). График выживаемости пациентов разных групп представлен на рис. 1.
Дефицит ТМТ более 10% был выявлен у 16,2%, дефицит ТМТ 5–10% – у 25,4%, дефицит ТМТ менее 5% – у 51,1% пациентов. С учетом статистической значимости был построен график выживаемости пациентов в зависимости от степени дефицита ТМТ (рис. 2). Внутригоспитальная летальность в группе пациентов с дефицитом ТМТ более 10% составила 56,5%, годичная – 100%; у пациентов без дефицита ТМТ не было летальных исходов в текущую госпитализацию, годичная летальность составила 19,0%; среди пациентов с промежуточными значениями дефицита ТМТ от 5 до 10% и менее 5% внутригоспитальная летальность составила 22,2 и 7,5% соответственно, годичная – 93,1 и 49,7% соответственно. Различия между группами статистически достоверны (р<0,05).
В литературе для определения характеристики пациентов с высокой коморбидностью при различном сочетании клинических показателей вводится понятие «клинический фенотип». Была изучена прогностическая роль клинических фенотипов. Т.к. не было выявлено достоверных различий по показателям индекса PSI, CURB- 65, ФВ, наиболее статистически и клинически значимым показателем являлся дефицит ТМТ и сочетание его с ХОБЛ (общее количество пациентов с ХОБЛ в нашем исследовании составило 9,5%), частыми госпитализациями, снижением СКФ. В табл. 3 представлены клинические фенотипы, распределенные среди групп пациентов в зависимости от высеянной флоры (наиболее многочисленные группы). Наиболее тяжелые клинические фенотипы, связанные с высокой вероятностью летального исхода, выявлены в группе с верифицированной микст-инфекцией в посеве мокроты. У 14,4% пациентов выявлено сочетание микст-инфекции и дефицита ТМТ более 10%, у 15,5% пациентов – сочетание микст-инфекции и дефицита ТМТ 5–10%, у 6% пациентов – сочетание ХОБЛ и микст-инфекции. Различные сочетания клинических фенотипов с другими результатами посевов мокроты составляли менее 5%.
Пневмония является второй по частоте причиной летальности при декомпенсации ХСН [5]. Одной из основных проблем является сложность интерпретации влажных хрипов у пациента с тяжелой ХСН, а также часто отсутствие характерной клинической картины (повышение температуры тела, лейкоцитоз, кашель и т.д.) и как следствие – отсроченное установление диагноза пневмонии, назначение антибактериальной терапии с 2–3-го дня пребывания в стационаре. Это подтвердилось в нашем исследовании: начало антибактериальной терапии в 57,8% случаев приходилось на 2–4-е сут после выявления у пациентов лейкоцитоза, лихорадки и установления диагноза пневмонии. На более ранних сроках госпитализации влажные мелкопузырчатые хрипы при осмотре, а также гидроторакс и застойные явления в легких (по данным рентгенографии) расценивали как симптомы декомпенсации ХСН.
Количество летальных исходов достоверно различалось в группах с различными результатами посева, что подтверждает результаты проведенного нами ранее исследования [19]. Наибольшая летальность, как внутригоспитальная, так и годичная, выявлена в группе с микст-инфекцией, наименьшая – в группе с высеянным Str. рneumonia. Также было выявлено, что для пациентов с различными результатами посева мокроты характерны разные клинические фенотипы.
Летальность среди пациентов, включенных в исследование, зависела от степени дефицита ТМТ. В многоцентровых рандомизированных исследованиях было показано, что снижение массы тела при ХСН приводит к достоверному увеличению количества госпитализаций и смертности больных. По данным исследования ELITE II [20], сердечная кахексия широко распространена в популяции больных с ХСН и выявляется у 12,6%, а та или иная степень недостаточности питания – у 85% пациентов, что подтверждается данными российских исследователей [21–27]. Дефицит ТМТ может приводить к микроаспирации, что обусловлено, в основном, снижением мышечной массы и нарушениями в работе мышц глотки и диафрагмы. Микроаспирация приводит, в первую очередь, к инфицированию бактериями из желудочно-кишечного тракта (в нашем исследовании в посевах мокроты пациентов была выявлена E. сoli – как изолированно, так и в составе микст-флоры). Ранее в исследованиях при помощи меченых изотопов выявлена микроаспирация во время ночного сна даже у здоровых людей [28, 29]. Исследований в группе пациентов, длительно страдающих ХСН, не проводилось. Однако достоверно говорить о том, что путь аспирации содержимого ротовой полости – единственный для обсеменения дыхательных путей пациентов с длительно текущей ХСН, нельзя.
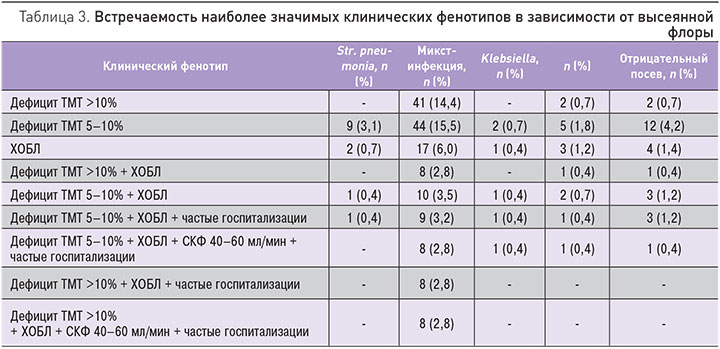
Среди пациентов с выявленной микст-флорой в сравнении с пациентами с выявленным Str. рneumonia достоверно выше число госпитализаций за предшествующий год, связанных с декомпенсацией ХСН или некардиальными причинами. Декомпенсация ХСН занимает одно из лидирующих мест среди причин госпитализации. Сам факт госпитализации пациента в стационар является независимым прогностическим параметром, влияющим на риск смерти пациента [30–37]. Частые госпитализации могут иметь место в патогенезе изменения флоры, и пневмония у таких пациентов будет рассматриваться как нозокомиальная, вызванная бактериями, типичными для внутригоспитальной инфекции, или микст-флорой.
В группе пациентов с высеянной микст-флорой достоверно выше число пациентов с ХОБЛ. Пациенты с ХСН и ХОБЛ характеризуются большим количеством повторных госпитализации, в том числе по поводу пневмонии [38–42]. Патогенетически худший прогноз и течение ХСН у таких пациентов связан с хронической гипоксией, повышенным уровнем провоспалительных цитокинов [43], часто встречающимися у пациентов с ХОБЛ явлениями дисфагии, что может привести к аспирации [44]; применение глюкокортикостероидов местно в виде ингаляционных препаратов также может способствовать замещению флоры дыхательных путей [45, 46].
ЗАКЛЮЧЕНИЕ
Исходя из всех вышеописанных факторов, вырисовывается «профиль коморбидности», который можно положить в основу разработки фенотипов больных. Данные Павловского регистра [6–8] показывают, что течение декомпенсации кровообращения радикально различается у пациентов с различными фенотипами.
По нашему мнению, эмпирическая антибактериальная терапия у пациентов с пневмонией и декомпенсацией ХСН должна основываться на наиболее тревожной группе пациентов, чей клинический фенотип с наибольшей вероятностью предполагает выявление микст-флоры. Именно эти пациенты наиболее часто имеют тяжелую сопутствующую патологию (ХОБЛ, снижение СКФ), бóльшую длительность течения ХСН и частые предшествующие госпитализации. Рациональной у таких пациентов может оказаться комбинированная терапия с первого дня госпитализации или установления факта пневмонии.
К ограничениям нашего исследования следует отнести тот факт, что в него не были включены наиболее тяжелые пациенты с декомпенсацией ХСН, имеющие клинический фенотип «мокрый–холодный» [47], т.к. ФВ у таких пациентов составляет менее 20%, имеет место выраженный застой как по большому, так и по малому кругу кровообращения, что обуславливает крайне неблагоприятный прогноз и тяжелое состояние, требующее госпитализации в отделение реанимации и интенсивной терапии. Наше же исследование включало в себя лишь пациентов терапевтического отделения.


