Болезнь Грейвса (БГ) – системное аутоиммунное заболевание, развивающееся вследствие выработки антител к рецептору тиреотропного гормона, клинически проявляющееся диффузным поражением щитовидной железы и развитием синдрома тиреотоксикоза [1]. БГ является наиболее распространенной причиной тиреотоксикоза; ежегодная заболеваемость ею составляет от 20 до 50 случаев на 100 тыс. человек [2]. В регионах с достаточным содержанием йода в продуктах питания это заболевание является причиной тиреотоксикоза в 70–80% всех случаев [3]. БГ может развиваться в любом возрасте, но пик заболеваемости приходится на промежуток между 30–50 годами. Риск развития заболевания в течение жизни среди женщин составляет 3%, среди мужчин – 0,5% [4]. Как и большинство аутоиммуных заболеваний, БГ чаще встречается у женщин, чем у мужчин, в соотношении примерно 5/1 [3].
На сегодняшний момент невозможно однозначно сказать, какой фактор занимает лидирующее место в патогенезе БГ. Наиболее значимыми могут быть названы генетические и эпигенетические факторы [5]. Крупномасштабные генетические исследования выявили гены, предрасполагающие к этому заболеванию, а именно гены, кодирующие тиреоглобулин, рецептор к ТТГ, носительство гаплотипов HLA-DRβ-Arg74 и многие др. Кроме того, значительную роль в генезе БГ играют такие факторы, как экология, потребление пищевого йода, воздействие табачного дыма, инфекции и эмоциональный стресс. Применение алентузумаба – моноклонального антитела против лимфоцитов CD52 у больных с хроническим лимфолейкозом, согласно некоторым источникам, тоже может спровоцировать БГ [6]. Активирующие антитела подкласса IgG1, направленные против рецептора к ТТГ, занимают как специфическое, так и центральное место в патогенезе БГ [7]. Они имитируют действия тиреотропина на его рецепторы посредством инициирования подобной, но не идентичной сигнализации, что вызывает неконтролируемое гипоталамо-гипофизарной осью производство тиреоидных гормонов [8]. Кроме того, у пациентов с БГ часто также обнаруживаются антитела к ТГ и к ТПО, но они не играют значимой роли в патогенезе данного заболевания.
Гиперпродукция тиреоидных гормонов (Т3 иТ4) приводит к развитию синдрома тиреотоксикоза, являющимся доминирующим в клинической картине БГ [1]. Повышенный уровень тиреоидных гормонов оказывает влияние на сердечно-сосудистую, центральную нервную систему, костную систему, влияет на углеводный обмен; негативно сказывается на репродуктивной функции организма. Патогенез изменений со стороны органов и систем заключается в значительном повышении уровня основного обмена, который со временем приводит к дистрофическим изменениям [9]. В клинической практике неспецифические симптомы тиреотоксикоза, с которыми больной в первую очередь может обратиться к терапевту, встречаются со следующей частотой: нервозность (80–95%); сердцебиение (65–99%); потливость (50–90%); непереносимость жары (40–90%); потеря веса (50–85%); утомляемость(45–85%); одышка (65–80%); олигоменорея (45–80%); диарея (10–30%); повышение аппетита (10–65%) [3]. К специфическим проявлениям БГ можно отнести формирование зоба, эндокринную офтальмопатию, тиреоидную дермопатию (претибиальную микседему), акропатию. Пальпируемый зоб развивается у большинства пациентов с тиреотоксикозом моложе 60 лет, в то время как у пожилых пациентов – менее чем у 50% (рис. 1А). Диффузное увеличение щитовидной железы встречается чаще всего, но у многих пациентов с БГ, живущих в регионах с дефицитом йода, развивается сопутствующий узловой зоб [10].
На рис. 1А изображено диффузное увеличение щитовидной железы, рис. 1В демонстрирует эндокринную офтальмопатию, на рис. 1С изображена претибиальная микседема, на рис. 1D показана акропатия пальцев рук.
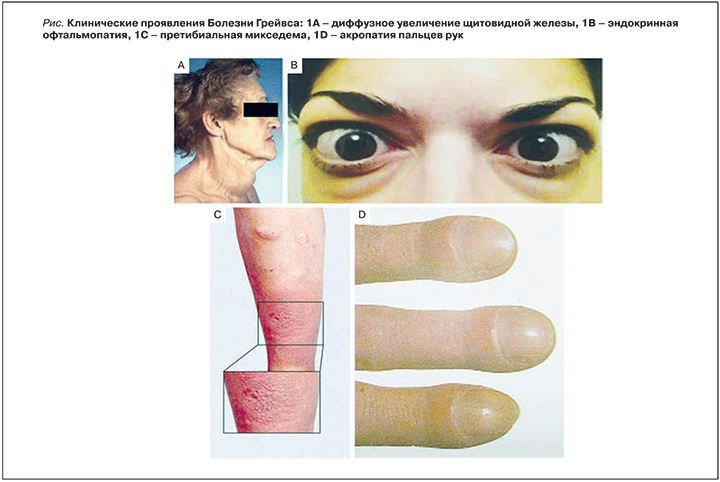
Патогенез формирования зоба связан с гипертрофией и пролиферацией тироцитов под воздействием стимулирующих антетел к рецептору ТТГ. По данным осмотра и пальпации щитовидная железа увеличена в размере, умеренной плотности, безболезненная, подвижная. Еще одним важным специфическим проявлением БГ является развитие эндокринной офтальмопатии (ЭОП) (рис. 1В) Ежегодная заболеваемость офтальмопатией, связанная с БГ, составляет 16 случаев на 100 тыс. женщин и 3 случая на 100 тыс. мужчин. Она чаще встречается у белых, чем у азиатов [11]. Развитие серьезной офтальмопатии более вероятно у пожилых пациентов, чем у более молодых людей [12]. При осмотре глаз легкие отклонения выявляются у 70% пациентов с БГ [13]. В специализированных центрах связанная с БГ офтальмопатия выявляется у более чем 50% больных, и от 3 до 5% больных, как следствие, угрожает разрушение роговицы или оптическая нейропатия [14]. Тиреотоксикоз и офтальмопатия, как правило, манифестируют с разницей не больше года, но иногда между их появлением проходят десятилетия. У 10% людей с офтальмопатией уровень гормонов щитовидной железы остается нормальным, либо развивается аутоиммунный гипотиреоз [12, 14].
Патогенез поражения глаз при БГ также носит аутоиммунный характер: перекрестное реагирование антител к рецепторам ТТГ щитовидной железы с антигенами ретробульбарной ткани глазницы, что приводит к инициации иммунного воспаления с развитием отека ретробульбарных тканей, а затем и фиброза; также в процесс вовлекаются глазодвигательные мышцы. Согласно одной из гипотез, антигенами тканей глазницы являются экспрессируемые преадипоцитами орбитальной ткани рецепторы ТТГ. Клинически ЭОП в первую очередь проявляется развитием экзофтальма, слезотечением, сухостью роговицы, диплопией, нарушением движения глазных яблок, связанным с невозможностью полностью сомкнуть веки, и поражением глазодвигательных мышц. Глазные симптомы при эндокринной офтальмопатии разнообразны (симптом Грефе, Дельримпля, Мебиуса, Кохера, Штельвага и многие другие), но они не всегда являются проявлением истинного отечного экзофтальма. Их причиной может быть ретракция верхнего века на фоне тиреотоксикоза, которая проходит при восстановлении эутиреоидного состояния [1].
Помимо вызываемых ей косметических дефектов, эндокринная офтальмопатия может привести к резкому снижению остроты зрения вплоть до полной слепоты за счет компрессии и атрофии зрительного нерва, вызванной отеком, а затем и фиброзом ретробульбарной клетчатки. Тиреоидная дермопатия (рис. 1С) (также называемая претибиальной микседемой) является необычным экстратиреоидным проявлением болезни Грейвса, встречается с частотой у 1—4% пациентов с болезнью Грейвса и практически всегда наблюдается у пациентов с тяжелой офтальмопатией [15]. Как правило, эта патология преобладает у более взрослых пациентов, женщины страдают чаще мужчин. Чаще всего претибиальная микседема локализуется на передней поверхности голени, но может появляться и в других областях кожи, таких как ноги, пальцы ног, верхние конечности, плечи, верхняя часть спины, даже нос, особенно после повреждений кожи. Кожа в местах поражения уплотнена, отечна, гиперемирована. Выделяют три клинических формы претибиальной микседемы: узловую, диффузную и слоновость (elephantiasic). Патогенез поражения кожи предположительно также носит аутоиммунный характер, подобный патогенезу поражения глаз при БГ. Для лечения симптоматической и обширной дермопатии могут быть использованы местные глюкокортикоиды, но обычно они не эффективны.
Наиболее редким экстратиреоидным клиническим проявлением БГ является акропатия (рис. 1D). Тиреоидная акропатия обычно связана с тяжелой формой ЭОП, претибиальной микседемой и отражает тяжесть аутоиммунного процесса в организме. По-прежнему женщины поражаются чаще мужчин. Акропатия выглядит как утолщение пальцев рук или ног [15]. Эти аномалии обычно безболезненны и могут быть асимметричными. Результаты рентгенологического исследования пораженных участков показывают отек мягких тканей, формирование субпериостального образования кости. В настоящее время для акропатии не существует никакого специфического лечения. При отсутствии своевременного, адекватно подобранного лечения тиреотоксикоз может привести к ряду грозных осложнений.
Одним из острых и угрожающих жизни осложнений тиреотоксикоза является развитие тиреотоксического криза. В настоящее время это осложнение встречается редко благодаря быстрой диагностике заболевания, своевременному лечению и хорошей предоперационной подготовке больного. Однако такие факторы, как присоединение интеркуррентной инфекции, травма железы во время операции, общая астенизация организма больного и стресс, могут привести к резкой декомпенсации тиреотоксикоза, проявляющейся повышением температуры тела, выраженной тахикардией, развитием сердечной недостаточности, тремором, тошнотой, рвотой, диареей, обезвоживанием организма, беспокойством и поражением ЦНС вплоть до комы [16]. Лечение этого осложнения проводится в отделении интенсивной терапии и реанимации. В прошлом смерть была обычным итогом тиреотоксического криза. В настоящее время развитие этого осложнения все еще остается опасным для жизни, хотя летальный исход встречается намного реже при своевременной диагностике и оказании помощи в условиях отделения реанимации. По результатам недавно проведенного общенационального исследования в Японии летальность при тиреотоксическом кризе составила от 9,5 до 11%[17].
Также известно, что гипертироксинемия неблагоприятно воздействует на сердечно-сосудистую систему, приводя к нарушениям гемодинамики посредством как хронотропного, так и инотропного влияния на сердце, приводя к увеличению сердечного выброса, а также повышению систолического и пульсового АД, ударного объема, нарушению сердечного ритма, миокардиодистрофии. Важно отметить, что многие описанные выше нарушения обратимы при своевременном восстановлении эутиреоза [18]. Однако результаты другого крупного исследования патологии сердечно-сосудистой системы показали, что такие клинические симптомы, как сердцебиение, боли в груди, одышка, кашель, шумы сердца, ортопноэ, гораздо чаще встречаются среди пациентов с тиреотоксикозом и могут сохраняться, несмотря на проводимое тиреостатическое лечение даже при достижении эутиреоза [19]. Эти изменения объясняются прогрессированием ранее существующих сердечно-сосудистых заболеваний на фоне длительной гипертироксинемии или присоединением новой кардиальной патологии, как осложнения тиреотоксикоза [20]. Согласно проведенным исследованиям, у лиц с тиреотоксикозом формирование пролапса митрального клапана встречалось чаще (43%) по сравнению с контрольной группой (18%) [19]. Увеличение частоты сердечных пороков может быть связано с повышением адренергического тонуса, сердечного выброса на фоне тиреотоксикоза. Очень часто встречаются экстрасистолия и пароксизмальная тахикардия, сопровождающаяся беспокойством и тревогой пациента.
Фибрилляция предсердий встречается у лиц с тиреотоксикозом как с предшествующей кардиальной патологией, так и без нее, но чаще всего наблюдается у пожилых, что может объясняться высокой частотой перенесенного раннее ишемического поражения сердца и других сердечно-сосудистых заболеваний среди этой группы пациентов [21]. Фибрилляция предсердий на фоне тиреотоксикоза может иметь как пароксизмальную, так и постоянную форму. Восстановить ритм при персистирующей форме фибрилляции предсердий на фоне тиреотоксикоза чаще всего не удается; после достижения эутиреоза ритм восстанавливается спонтанно или с помощью антиаритмических препаратов или электрической кардиоверсии.
У пожилых лиц кардиальные симптомы могут настолько доминировать над другими проявлениями тиреотоксикоза, что диагностика основного заболевания часто упускается. Проявления стенокардии усиливаются за счет повышения основного обмена и развития дисбаланса между потреблением и снабжением кислородом. В некоторых случаях результаты ангиографии показали проходимые коронарные артерии после перенесенного приступа стенокардии или инфаркта миокарда. Вероятнее всего, в этих случаях ишемическое поражение сердца было вызвано спазмом коронарных артерий на фоне тиреотоксикоза, а не их окклюзией [22].
Тиреотоксикоз часто приводит к желудочковой дилатации и постоянной тахикардии, что часто осложняется формированием сердечной недостаточности вплоть до летального исхода. Тиреотоксикоз следует компенсировать как можно быстрее. Развитие застойной сердечной недостаточности является противопоказанием к хирургическому лечению. Большинству пациентов с тиреотоксикозом и клинически значимой сердечной недостаточностью показана радиойодтерапия. Согласно проведенным наблюдениям, смертность при тиреотоксикозе возрастает в основном за счет присоединения сердечно-сосудистых осложнений.
Согласно ряду исследований, БГ может повышать риск развития рака щитовидной железы. Карцинома щитовидной железы является наиболее распространенным раком в эндокринологии; она развивается из железистых клеток щитовидной железы. Существуют следующие гистологические формы рака: в 80% –папиллярный рак, в 14% – фолликулярная карцинома, в 2% – анапластический или недифференцированный рак, в 4% – медуллярная карцинома [23]. Рак щитовидной железы является серьезной проблемой для здравоохранения. Смертность от рака щитовидной железы составляет 0,5 на 100 тыс. [24]. Канцерогенез на фоне БГ может быть связан со стимулирующим действием антител, которые способствуют пролиферации тиреоцитов, ангиогенезу, инвазии, активации ИФР-1 [25]. На сегодняшний день относительная частота гистологически подтвержденной карциномы щитовидной железы у пациентов с болезнью Грейвса в сравнении с контрольной группой в литературе отражена недостаточно. Американская ассоциация тиреоидологов утверждает, что карцинома щитовидной железы при БГ возникает с частотой около 2% [26]. Согласно исследованию, проведенному учеными из Сиднейского университета [27], заболеваемость раком щитовидной железы при БГ вдвое превысила показатель, представленный Американской ассоциацией эндокринологов (2%). Однако это может быть связано с часто выявляемой папиллярной микрокарциномой в гистологических материалах оперированных больных, которые и составляли основную группы в исследовании. Ученые также проанализировали ассоциацию карциномы с узлами щитовидной железы при болезни Грейвса. Согласно их выводам, у пациентов с показаниями к хирургическому лечению БГ и сопутствующими узловыми образованиями риск развития рака щитовидной железы повышается в 5 раз по сравнению с пациентами без узлов. Таким образом, БГ, возможно, является фактором риска в канцерогенезе рака щитовидной железы.
Гипертироксинемия также неблагоприятно влияет на желудочно-кишечный тракт. Хорошо известно, что тиреоидные гормоны влияют преимущественно на моторику ЖКТ, ускоряют эвакуацию пищи, повышают секрецию пищеварительных ферментов желудочно-кишечного тракта, что объясняет такие клинические проявления при тиреотоксикозе, как постоянные боли в животе, диарею, необъяснимую потерю веса, рвоту. Однако многие их этих симптомов не исчезали на фоне тиреостатического лечения и достижения эутиреоза, что заставляло углубить диагностический поиск, направленный на выявления заболеваний ЖКТ. Еще в 70-х гг. была проведена параллель между тиреотоксикозом и формированием неспецифического язвенного колита (НЯК), опубликованы работы, поддерживающие гипотезу об общем патогенезе этих заболеваний. Тиреотоксикоз может быть диагностирован раньше или позже выявления НЯК, или оба эти заболевания диагностируются одновременно. Согласно раннее проведенным крупным популяционным исследованиям, у лиц с НЯК частота развитие патологии щитовидной железы увеличивается в 2–4 раза.
Сосуществование этих заболеваний может объясняться общей аутоиммунной основой патологии щитовидной железы и неспецифического язвенного колита. За аутоиммунный генез НЯК свидетельствует выявление аутоантител к тропомиозину клеток эпителия толстой и тонкой кишки, а также к мышечному слою кишечника, которые, возможно, могут перекрестно реагировать и с другими клетками организма. L. Laterza и др. недавно описали клинический случай заболевания НЯК 38-летней женщины после тиреотоксического криза без предшествующей ранее гастроинтестинальной патологии [28].
Таким образом, согласно клиническому опыту и анализу раннее проведенных исследований, тиреотоксикоз может запускать НЯК у предрасположенных лиц. Кроме того, у больных, уже имеющих НЯК, тиреотоксикоз ухудшает прогноз и результаты лечения. Для предотвращения возможных осложнений необходимо провести своевременную диагностику БГ и выбрать правильную тактику лечения. Согласно Федеральным клиническим рекомендациям по диагностике и лечению тиреотоксикоза с диффузным токсическим зобом (ДТЗ), утвержденным на II Всероссийском конгрессе с участием стран СНГ «Инновационные технологии в эндокринологии» (25–28 мая 2014 г.), диагноз тиреотоксикоза основывается на характерной клинической картине, лабораторных показателях (высокий уровень свТ4 и свТ3 и низкое содержание ТТГ в крови). Специфическим маркером ДТЗ являются антитела к рТТГ. Клиническая диагностика тиреотоксикоза подразумевает выявление симптомов нарушения функции ЩЖ, пальпаторную оценку размеров и структуры ЩЖ, выявление заболеваний, сопутствующих тиреоидной патологии (ЭОП, акропатия, претибиальная микседема), выявление осложнений тиреотоксикоза.
Визуализировать щитовидную железу позволяет применение методов УЗ-диагностики (определяется объем и эхоструктура ЩЖ). Эхогенность железы при аутоиммунном тиреотоксикозе равномерно снижена, эхоструктура обычно однородная, кровоснабжение усилено. Также применяется сцинтиграфия щитовидной железы с использованием изотопа технеция - 99 mTc, 123 I, реже 131 I [29].
При ДТЗ отмечается равномерное распределение изотопа. Чаще всего сканирование щитовидной железы используется для диагностики различных форм токсического зоба. Проведение КТ и МРТ, рентгенологического исследования пищевода с контрастированием барием помогают диагностировать загрудинный зоб, уточнить расположение зоба по отношению к окружающей ткани, определить смещение или сдавление трахеи и пищевода [29]. Пункционная биопсия и цитологическое исследование проводятся при наличии узлов в ЩЖ [29]. В настоящее время, согласно Федеральным клиническим рекомендациям от 2014 г., применяется три основных метода лечения: консервативное (прием антитиреоидных препаратов); оперативное (тиреоидэктомия) и лечение радиоактивным йодом. Целью проводимого лечения является достижение стойкого эутиреоза (лабораторного и клинического), поддержание иммунологической ремиссии. Больным рекомендуется ограничить физическую нагрузку, начать прием йодсодержащих препаратов, отказаться от курения. Для пациентов, которые в настоящее время курят или ранее курили, эффективность медицинской терапии снижается [30], в связи с чем важность прекращения курения нельзя переоценить.
Консервативную терапию применяют с целью компенсации тиреотоксикоза перед хирургическим лечением, радиойодтерапией и как длительный базовый курс. При выборе консервативной тактики как основного метода лечения необходимо учитывать наличие сопутствующих осложнений со стороны сердечно-сосудистой системы и др., размер щитовидной железы, комплаентность больного. Консервативное лечение целесообразно проводить в течение 12–18 мес [29]. В настоящее время применяют препараты из группы тионамидов: тиамазол и пропилтиоурацил. Механизм их действия связан с угнетением процессов синтеза тиреоидных гормонов путем подавления тиреоидной пероксидазы, окисления йода, йодирования тиреоглобулина и др. [1]. Целесообразно начинать терапию с максимальных доз, постепенно доводя их до поддерживающих. Доказала свою эффективность комбинация тиамозола с левотироксином натрия, так называемая схема «Блокируй – замещай». Важно на протяжении всего курса лечения контролировать функциональную активность щитовидной железы, уровень лейкоцитов и тромбоцитов в клиническом анализе крови во избежание редкого, но грозного осложнения – агранулоцитоза, а также печеночные трансаминазы. Высокий уровень антител к рецепторам ТТГ в конце лечения свидетельствует о большом риске рецидива. Если у пациента с ДТЗ после отмены тиамазола вновь развивается тиреотоксикоз, необходимо рассмотреть вопрос о проведении радиойодтерапии (РЙТ) или тиреоидэктомии [29]. РЙТ при ДТЗ проводится в случае рецидива тиреотоксикоза после правильного консервативного лечения, невозможности приема тиреостатических препаратов (противопоказания), отсутствия условий для консервативного лечения и наблюдения за больным. Единственными противопоказаниями к лечению 131I являются беременность и грудное вскармливание. Гипотиреоз обычно развивается в течение 6–12 мес после радиоактивного йода [29]. Оперативное лечение показано при загрудинном расположения зоба, диффузных и узловых формах с компрессионным синдромом, отказе пациента от РЙТ. Тотальная тиреоидэктомия являются методом выбора хирургического лечения ДТЗ [29]. В Европе при легком течении тиреотоксикоза без сопутствующих осложнений методом выбора остается консервативное лечение - использование тиреостатических препаратов [31, 32], в Северной Америке предпочтение все чаще отдается именно им, а не радиойодтерапии [31]. После применения консервативного лечения стойкая ремиссия наблюдается лишь в 30–40% случаев, повторный курс тиреостатической терапии несет еще меньшую вероятность успеха и в настоящее время считается нецелесообразным [1]. Применение хирургического лечения и радиойодтерапии приводит к формированию стойкого гипотиреоза, который требует назначения пожизненной заместительной гормональной терапии препаратами левотироксина натрия.
Таким образом, каждый метод лечения имеет свои преимущества и недостатки. Подход к выбору лечения сугубо индивидуальный для каждого больного.
Клинический случай
На прием к терапевту в сентябре 2016 г. обратилась пациентка с жалобами на сердцебиение, снижение массы тела (за 1 мес похудела на 5 кг), дрожь в руках, плаксивость, раздражительность, бессонницу, ухудшение зрения, ощущение песка в глазах. В связи с отсутствием эндокринолога из-за отпуска терапевтом были назначены клинические анализы крови и мочи. Полученные удовлетворительные результаты основных показателей крови заставили терапевта отложить направление пациентки к другим специалистам, в том числе и к эндокринологу, до следующего посещения.
Повторное обращение пациентки было уже в ноябре 2016 г., больная продолжала прогрессивно худеть, ухудшилась симптоматика со стороны глаз: появились боли в области орбит, отечность век; боли в сердце, женщина самостоятельно подсчитывала пульс, который составлял более 100 ударов в минуты. Терапевт принял решение о проведении гормонального исследования крови. Результаты показали: ТТГ – 0,09 мкМЕ/мл (0,4–4,00), св.Т4 – 34,7 пмоль/л (9,0–22,2). Консультацию эндокринолога отложил до получения результатов ультразвукового исследования щитовидной железы.
В конце марта 2017 г. результаты исследования функциональной активности щитовидной железы показали: ТТГ – 0,02 мкМЕ/мл (0,4–4,00), Т4св – 39,9 пмоль/л (9,0–22,2), симптомы тиреотоксикоза нарастали. Консультация эндокринолога откладывалась по причине отсутствия врача УЗ-диагностики. Консультация эндокринолога проведена в апреле 2017 г. При осмотре: состояние относительно удовлетворительное. Больная суетлива, плаксива, раздражительная. Обращает на себя внимание быстрая речь, перескакивает с одной темы на другую. Кожные покровы теплые, влажные, бархатистые. Рост – 165 кг, вес – 53 кг, ИМТ – 19,4 кг/м2 (с лета снижение массы тела более чем на 10 кг). При пальпации щитовидная железа безболезненная, диффузнонеоднородной консистенции, не увеличена. Со стороны глаз определены глазные симптомы тиреотоксикоза: симптом Краузе (повышенный блеск глаз), симптом Мебиуса (слабость конвергенции), симптом Дельримпля (широкое раскрытие глазных щелей); веки отечны. В легких дыхание везикулярное, хрипов нет. ЧД – 16 в мин. Со стороны сердечно-сосудистой системы: ЧСС – 120 уд./мин; АД – 140/80 мм рт. ст. Живот мягкий, безболезненный. Стул частый, неоформленный (со слов больной). По результатам лабораторно-инструментального обследования получены следующие данные: ТТГ менее 0,01 мкМЕ/мл (0,4–4,00), свТ4 – 41 пмоль/л (9,0–22,2), Т3св – 10 пмоль/л (2,6–5,7), антитела к рецепторам ТТГ: более 40 МЕ/л (менее 1 Ме/л); УЗИ щитовидной железы: эхо-картина диффузной неоднородности ткани железы; множество очагов сниженной эхогенности; кровоток усилен. Общий объем железы – 18 мл. ЭКГ: синусовая тахикардия с ЧСС – 120 уд./мин. Вертикальное положение ЭОС. Гипертрофия миокарда ЛЖ.
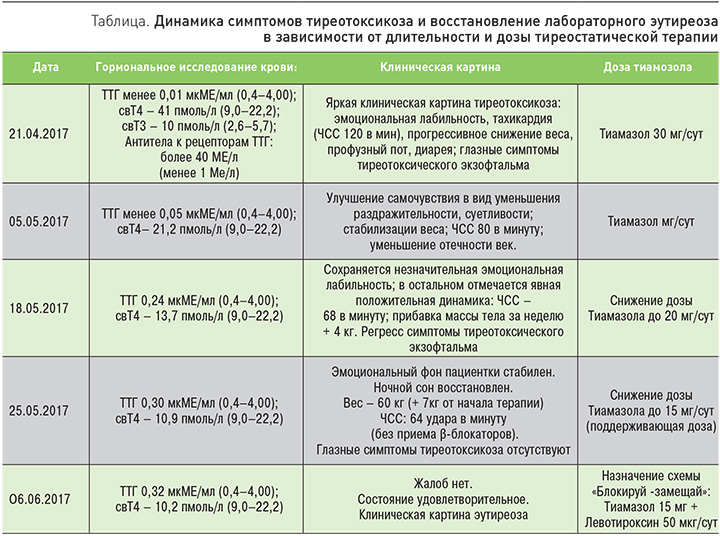
Эндокринологом диагностирован диффузный токсический зоб I ст., средней тяжести. Тиреотоксический экзофтальм. Назначена тиреостатическая терапия: Тиамазол 30 мг/сут (15 мг утром × 2 р/сут); Пропранолол 120 мг/сут. Контроль клинического (уровень лейкоцитов, тромбоцитов) и биохимическом анализов крови (АЛТ; АСТ; креатинин; ГГТП) – 1 р/мес. В табл. 1 приведена динамика регресса симптомов тиреотоксикоза и восстановление лабораторного эутиреоза в зависимости от времени и дозы тиреостатической терапии.
Проведение терапии по схеме «Блокируй – замещай» планируется в течение последующих 18 мес, с контролем ТТГ и свТ4 1 раз в 6 нед. Для того чтобы определить эффективность проведенной тиреостатической терапии и спрогнозировать риск развития рецидива тиреотоксикоза, перед отменой Тиамозола больной будет назначено повторное определение уровня антител к рецепторам ТТГ.
ЗАКЛЮЧЕНИЕ
В статье приведены краткий обзор статей и клинический случай, демонстрирующий, насколько яркой является клиническая картина тиреотоксикоза на фоне БГ, которая имеет как неспецифические проявления, так и «визитные карточки» в виде эндокринной офтальмопатии, акропатии, дермопатии, формирования зоба. Показано, как быстро может прогрессировать заболевание, приводящее к серьезным осложнениям, и насколько эффективной является тиреостатическая терапия, позволяющая достичь клинического и лабораторного эутиреоза за небольшой период времени. Диагностика тиреотоксикоза на фоне БГ не должна вызывать трудностей у терапевтов и врачей семейной медицины, так как с первыми проявлениями этого синдрома больные обращаются именно к ним. От своевременности правильно поставленного диагноза и начала адекватной терапии зависит дальнейшее течение болезни и риск возникновения осложнений, которые могут иметь даже фатальные последствия.


