На сегодняшний день трудно представить лечение многих сердечно-сосудистых заболеваний без применения ингибиторов ренин-ангиотензин-альдостероновой системы (РААС): ингибиторов ангиотензинпревращающего фермента (иАПФ), блокаторов рецепторов ангиотензина ΙΙ (БРА). Появившиеся в конце 80-х гг. прошлого века БРА занимают лидирующие позиции в терапии таких распространенных заболеваний, как артериальная гипертензия (АГ), хроническая сердечная недостаточность (ХСН), хроническая болезнь почек (ХБП). Высокая клиническая эффективность первых лекарственных средств данного класса препаратов способствовала разработке новых представителей с улучшенными фармакологическими показателями. БРА являются самым назначаемым классом препаратов в мире с высокой приверженностью к лечению (рис. 1).
В нашей стране, согласно результатам исследования Пифагор IV, частота назначения БРА уступает частоте применения других антигипертензивных препаратов (иАПФ, диуретиков, бета-блокаторов, антагонистов кальция) и составляет 16 % [1].
Активация РААС лежит в основе большинства сердечно-сосудистых заболеваний, поэтому применение блокаторов РААС является патогенетически обоснованным [2].
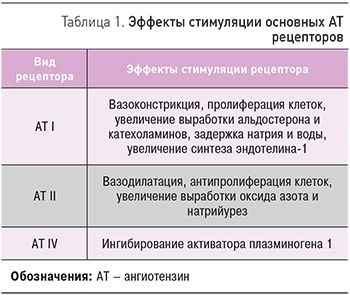
Ангиотензин (АТ) II образуется не только через механизм с участием ангиотензинпревращающего фермента. Применение иАПФ может приводить к активации альтернативных путей образования АТ II. АТ II реализует свое действие через специфические рецепторы. Наиболее изучены функции трех типов рецепторов к АТ II (табл. 1).
 АТ I рецепторы расположены в сосудах, сердце, почках и коре надпочечников. Действие БРА реализуется через снижение активности РААС на уровне рецепторов АТ II. БРА образуют с АТ I рецепторами прочную связь с последующей медленной диссоциацией, что предупреждает развитие или ослабляет эффекты АТ II. Косвенные механизмы действия БРА связаны со стимуляцией АТ II рецепторов. Препараты этой группы не влияют на метаболизм кининов и не приводят к появлению кашля. Частота развития кашля в плацебо-контролируемых клинических исследованиях составляет от 1 до 4,6%. Частота других побочных эффектов, таких как ангионевротический отек, кожные проявления, не превышает 1%. Они значительно реже вызывают гипотензию и коллаптоидные реакции. Эффект «первой дозы» (головокружение, слабость, постуральная гипотензия, обмороки) у антагонистов АТ I рецепторов менее выражен – частота гипотензии составляет менее 1%. В отличие от иАПФ, БРА не приводят к клинически значимой задержке калия. Гиперкалиемия развивается в менее 1,5% случаев. У этих лекарственных средств не регистрировался синдром отмены [2, 3]. Все препараты этой группы имеют общий механизм действия, но фармакологические свойства, различия во взаимодействии с рецепторами определяют особенности отдельных представителей и их разную клиническую эффективность.
АТ I рецепторы расположены в сосудах, сердце, почках и коре надпочечников. Действие БРА реализуется через снижение активности РААС на уровне рецепторов АТ II. БРА образуют с АТ I рецепторами прочную связь с последующей медленной диссоциацией, что предупреждает развитие или ослабляет эффекты АТ II. Косвенные механизмы действия БРА связаны со стимуляцией АТ II рецепторов. Препараты этой группы не влияют на метаболизм кининов и не приводят к появлению кашля. Частота развития кашля в плацебо-контролируемых клинических исследованиях составляет от 1 до 4,6%. Частота других побочных эффектов, таких как ангионевротический отек, кожные проявления, не превышает 1%. Они значительно реже вызывают гипотензию и коллаптоидные реакции. Эффект «первой дозы» (головокружение, слабость, постуральная гипотензия, обмороки) у антагонистов АТ I рецепторов менее выражен – частота гипотензии составляет менее 1%. В отличие от иАПФ, БРА не приводят к клинически значимой задержке калия. Гиперкалиемия развивается в менее 1,5% случаев. У этих лекарственных средств не регистрировался синдром отмены [2, 3]. Все препараты этой группы имеют общий механизм действия, но фармакологические свойства, различия во взаимодействии с рецепторами определяют особенности отдельных представителей и их разную клиническую эффективность.
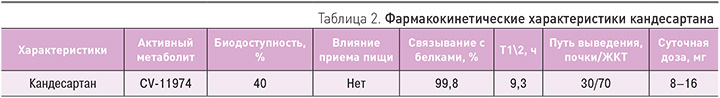
 Одним из наиболее изученных представителей БРА является кандесартана цилексетил. Кандесартан так же, как и олмесартан, лозартан, ирбесартан, относится к бифениловым производным тетразола и представляет собой высокоселективный длительно действующий блокатор АТ II рецепторов первого типа. При всасывании из желудочно-кишечного тракта препарат гидролизуется до активного вещества кандесартана. Химическое название 1-[[(циклоксигексилокси) карбонил] окси] этил 2-этокси-1-[[2’(1Н-тетразол-5-ил)-1,1’-бифенил]-4-ил] метил]-1Н-бензимидазол-7-карбоновой кислоты. Основные фармакологические свойства кандесартана представлены в табл. 2.
Одним из наиболее изученных представителей БРА является кандесартана цилексетил. Кандесартан так же, как и олмесартан, лозартан, ирбесартан, относится к бифениловым производным тетразола и представляет собой высокоселективный длительно действующий блокатор АТ II рецепторов первого типа. При всасывании из желудочно-кишечного тракта препарат гидролизуется до активного вещества кандесартана. Химическое название 1-[[(циклоксигексилокси) карбонил] окси] этил 2-этокси-1-[[2’(1Н-тетразол-5-ил)-1,1’-бифенил]-4-ил] метил]-1Н-бензимидазол-7-карбоновой кислоты. Основные фармакологические свойства кандесартана представлены в табл. 2.
В отличие от других представителей БРА кандесартан характеризуется не только высокой селективностью к АТ I рецепторам, которая составляет более 10 000:1, что больше, чем у лозартана (1000:1), телмисартана (3000:1) и ирбесартана (более 1000:1), но и низкой степенью диссоциации с ними. Сила связывания АТ I блокаторов убывает в следующей последовательности: кандесартан > ЕХР-3174 > ирбесартан > лозартан. Благодаря медленной диссоциации из связи с рецепторами кандесартан накапливается в среде и повторно связывается с АТ I рецепторами [4, 5].
Представленные особенности кандесартана объясняют его более выраженное и длительное антигипертензивное действие, чем у ряда других БРА. Основной путь выведения препарата почечный (60–70%). Доза кандесартана 8 мг/сут характеризуется высоким профилем безопасности у для больных с тяжелым нарушением функции почек. Однако увеличение дозы препарата до 12 мг/сут приводит к существенному накоплению препарата в крови и возможному развитию побочных эффектов. Рекомендуемая доза при скорости клубочковой фильтрации (СКФ) менее 30 мл/(мин×1,73 м2) составляет 4 мг. При нарушении функции печени применение кандесартана в дозе до 12 мг/сут считается относительно безопасным [6–8]. Кандесартан имеет обширную доказательную базу при различных клинических ситуациях.
ПРИМЕНЕНИЕ КАНДЕСАРТАНА У БОЛЬНЫХ С ВЫСОКИМ НОРМАЛЬНЫМ ДАВЛЕНИЕМ – предгипертензией
По классификации уровней артериального давления (АД) систолическое АД (САД) 130–139 мм рт ст. и/или диастолическое АД (ДАД) 85–89 мм рт.ст. относят к высокому нормальному давлению. Эффективность кандесартана в профилактике АГ с участием 772 пациентов с предгипертензией оценивалась в исследовании TROPHY. Продолжительность терапии составила 2 года, затем в течение еще 2 лет продолжалось наблюдение за пациентами без приема препарата. К завершению периода активного лечения риск развития АГ был на 66,3% ниже на фоне приема кандесартана. Достоверные различия в риске развития АГ между группами кандесартана и плацебо сохранялись и к 4 году наблюдения. АГ развилась у 208 больных из группы кандесартана и у 240 больных из группы плацебо. Риск развития АГ был ниже на 15,6% (р=0,007) в группе кандесартана. Таким образом, кандесартан показал эффективность в профилактике развития АГ у больных с предгипертензией [9].
ПРИМЕНЕНИЕ КАНДЕСАРТАНА ПРИ АГ
Согласно рекомендациям Российского медицинского общества по артериальной гипертензии (РМОАГ, 2013) БРА включены в 5 основных классов антигипертензивной терапии. Лечение больных с АГ направлено на снижение риска сердечно-сосудистых осложнений (ССО), достижение целевых уровней АД, предупреждение или уменьшение выраженности поражения органов-мишеней. Антигипертензивная эффективность БРА в среднем составляет 65–70% и не зависит от активности РААС, пола, возраста пациента. Кроме того, у БРА отсутствует феномен «ускользания» антигипертензиного эффекта (АГЭ). Высокий АГЭ и хорошо изученный профиль безопасности БРА объясняют приверженность пациентов к лечению. Все это имеет большое практическое значение при выборе антигипертензивного препарата в реальной клинической практике [10, 11]. АГЭ кандесартана имеет достаточную доказательную базу, основанную на результатах крупных рандомизированных клинических исследований. Применение кандесартана в дозе от 4 до 32 мг/сут в виде монотерапии достоверно снижает САД на 6–17 мм рт.ст., ДАД на 4–10 мм рт.ст. Благодаря высокой селективности и низкой степени диссоциации с АТ I рецепторами кандесартан обеспечивает равномерное снижение АД на протяжении суток. Действие препарата сохраняется даже при пропуске приема очередной дозы. В одном из исследований с участием 312 больных АГ кандесартан назначался в дозе 8 и 16 мг/сут в монотерапии и в сочетании с 12,5 мг гидрохлоротиазида. Было показано, что 48-часовой пропуск приема лекарства по данным суточного мониторирования АД не приводил к значимым повышениям АД [12, 13]. Действие препарата не зависит от пола, возраста, наличия сахарного диабета (СД), ожирения. Препарат хорошо переносится, частота развития побочных эффектов сопоставима с группой плацебо. С увеличением дозы препарата частота побочных эффектов не нарастает, препарат одинаково переносится мужчинами и женщинами, пожилыми и молодыми пациентами.
В крупном открытом исследовании ACTION, в котором участвовали 6455 пациентов с изолированной систолической АГ, кандесартан назначался дополнительно к уже проводимому лечению. В группе монотерапии кандесартан снижал АД на 17,0/4,4 мм рт.ст. Добавление кандесартана к проводимой терапии приводило к дополнительному снижению АД, независимо от того, какой препарат пациент получал исходно. При добавлении к диуретику кандесартан способствовал дальнейшему снижению АД на 17,7/5,1 мм рт.ст., к бета-блокатору – на 14,0/4,8 мм рт.ст., иАПФ – на 13,4/4,3 мм рт.ст., альфа-блокатору – на 11,6/4,5 мм рт.ст. Эффект кандесартана не зависел от возраста, пола и расы [14]. В открытом исследовании у больных с повышенным АД (более 135/85 мм рт.ст.) в утренние часы кандесартан лучше, чем амлодипин и другие БРА, предотвращал раннее утреннее повышение АД. При лечении кандесартаном отмечалась тенденция к уменьшению частоты сердечных сокращений [15].
В исследовании J-TOP 450 больных рандомизировались для лечения кандесартаном с утренним и вечерним режимом приема. К завершению наблюдения при вечернем приеме кандесартана более значимо снижалось АД у больных утренней АГ и уменьшалась выраженность протеинурии на 45,7% [16]. Эффективность кандесартана и амлодипина у больных АГ из группы высокого риска оценивали в исследовании CASE-J. АГЭ, влияние на общую смертность, риск сердечно-сосудистых событий на фоне приема препаратов существенно не отличались. Однако кандесартан способствовал достоверному снижению риска развития СД на 36% [17]. На втором этапе исследования в течение трех лет отмечался сопоставимый контроль АД при достоверном снижении риска СД на фоне терапии кандесартаном на 29% [18]. Кроме того, наблюдалось одинаковое уменьшение массы миокарда левого желудочка, но только терапия кандесартаном приводила к снижению дисперсии интервала QT [19].
В исследовании SCOPE (Study of Cognitionand Prognosisin Elderly) с участием 4964 пожилых больных с АГ в возрасте 70–89 лет кандесартан на 27,8% снизил риск развития нефатальных инсультов (р=0,041), на 20% (р=0,083) снизил риск возникновения новых случаев СД и на 11% риск развития сосудистой деменции. На фоне эффективного снижения АД отмечалось сохранение когнитивных функций. В группе больных, не получавших исходной антигипертензивной терапии, эффективность кандесартана была выше: отмечалось достоверное снижение риска всех ССО, сердечно-сосудистой и общей смертности [20, 21].
 Кардиопротективные свойства кандесартана изучались в многоцентровом исследовании CATCH (Сandesartan assessment in the treatment of cardiac hypertrophy). Сравнивалась эффективность кандесартана в дозе 6–16 мг/сут и эналаприла в дозе 10–20 мг/сут, при необходимости добавлялся гидрохлоротиазид. Через 48 нед отмечалось достоверное уменьшение массы миокарда левого желудочка по данным эхокардиографии в обеих группах наблюдения. Несмотря на сопоставимое действие иАПФ и БРА на гипертрофию левого желудочка, кандесартан лучше переносился, не вызывая развития кашля [22].
Кардиопротективные свойства кандесартана изучались в многоцентровом исследовании CATCH (Сandesartan assessment in the treatment of cardiac hypertrophy). Сравнивалась эффективность кандесартана в дозе 6–16 мг/сут и эналаприла в дозе 10–20 мг/сут, при необходимости добавлялся гидрохлоротиазид. Через 48 нед отмечалось достоверное уменьшение массы миокарда левого желудочка по данным эхокардиографии в обеих группах наблюдения. Несмотря на сопоставимое действие иАПФ и БРА на гипертрофию левого желудочка, кандесартан лучше переносился, не вызывая развития кашля [22].
Как правило, монотерапия применяется у пациентов с низким или средним риском ССО. Комбинированная терапия позволяет повысить не только эффективность лечения, но и приверженность пациента к лечению. Рациональные комбинации антигипертензивных препаратов представлены в табл. 3 [10].
Как видно из табл. 3, БРА входят в состав большинства рациональных комбинаций при различных клинических ситуациях. Комбинация кандесартана с гидрохлоротиазидом позволяет усилить антигипертензивное действие и сохранить хорошую переносимость лечения. В рандомизированном исследовании было показано, что монотерапия кандесартаном с увеличением дозы препарата до 32 мг сут снижает АД на 6,1/5,6 мм рт.ст., терапия кандесартаном 32 мг и гидрохлоротиазидом 12,5 мг сут – на 13,0/8,8 мм рт.ст., лечение кандесартаном 32 мг и гидрохлоротиазидом 25 мг/сут – на 15,5/10,0 мм рт.ст. [23]. В открытом наблюдательном исследовании CHILI Triple T оценили эффективность комбинированной терапии кандесартаном 16 мг сут и гидрохлоротиазидом 12,5 мг/сут и монотерапии кандесартаном 32 мг/сут у больных неконтролируемой АГ с дополнительными факторами риска. Изучаемые схемы терапии эффективно снижали АД на -28,5±13,8/-14,2±9,4 мм рт.ст. и -29,73±15,3/-14,1±9,6 мм рт.ст. соответственно. Частота развития побочных эффектов была сопоставимой и составила 0,8% в группе комбинированной терапии и 1,2% в группе, получавшей высокие дозы кандесартана [24]. В открытом исследовании изучали эффективность применения кандесартана в дозе 32 мг/сут в монотерапии и сочетании с диуретиком у больных АГ II стадии. Согласно результатам исследования, монотерапия позволила нормализовать АД у 53,2% больных, комбинированная терапия – у 70,6% больных. Переносимость максимальной дозы кандесартана была хорошей [25].
 Эффективность антигипертензивной комбинированной терапии с участием кандесартана оценивалась также в исследовании ALPINE (Antihypertensive Treatment and Lipid Profile in a North of Sweden Efficacy Evaluation). Больные с впервые выявленной АГ получали 2 режима терапии: первый – гидрохлоротиазид, при необходимости к терапии добавлялся атенолол; второй – кандесартан, при необходимости в сочетании с фелодипином. Через год наблюдения АГЭ и переносимость различных режимов терапии оказалась одинаковой. Однако на фоне приема кандесартана достоверно снижался риск развития СД (р=0,03). В отличие от гидрохлоротиазида кандесартан не оказывал негативного влияния на показатели липидного спектра плазмы [26].
Эффективность антигипертензивной комбинированной терапии с участием кандесартана оценивалась также в исследовании ALPINE (Antihypertensive Treatment and Lipid Profile in a North of Sweden Efficacy Evaluation). Больные с впервые выявленной АГ получали 2 режима терапии: первый – гидрохлоротиазид, при необходимости к терапии добавлялся атенолол; второй – кандесартан, при необходимости в сочетании с фелодипином. Через год наблюдения АГЭ и переносимость различных режимов терапии оказалась одинаковой. Однако на фоне приема кандесартана достоверно снижался риск развития СД (р=0,03). В отличие от гидрохлоротиазида кандесартан не оказывал негативного влияния на показатели липидного спектра плазмы [26].
В многоцентровом контролируемом исследовании HIJ-CREATE у больных с ишемической болезнью сердца и АГ сочетание амлодипина и кандесартана снижало риск ССО на 38% и было более эффективным, чем комбинация кандесартана с другими антагонистами кальция [27]. Таким образом, кандесартан обладает доказанным антигипертензивным действием в дозах от 4 до 32 мг однократно в сутки. АГЭ кандесартана повышается при его использовании в составе комбинированной терапии. Препарат способствует не только профилактике развития АГ, но и уменьшению выраженности поражения органов-мишеней при АГ (гипертрофии миокарда левого желудочка и нефропатии). Кандесартан является метаболически нейтральным препаратом с отличной переносимостью.
ЭФФЕКТИВНОСТЬ КАНДЕСАРТАНА У БОЛЬНЫХ С ХБП
 Проявление ХБП выявляют примерно у каждого десятого из общей популяции. При этом уже умеренное снижение СКФ или появление небольшой альбуминурии ассоциируется с увеличением риска развития кардиоваскулярных заболеваний и сопровождается повышением уровня общей смертности. У пациентов с АГ и ХБП в качестве препаратов первой линии или основного компонента комбинированного лечения рекомендуется назначение иАПФ или БРА. Данные группы препаратов обладают не только системным антигипертензивным действием, но и рядом локальных нефропротективных эффектов – как за счет торможения продукции медиаторов почечного повреждения на уровне клубочков, канальцев и интерстиция, так и за счет снижения внутриклубочковой гипертензии. Препараты групп иАПФ или БРА рекомендуется назначать пациентам с ХБП c индексами альбуминурии/протеинурии А2-А3 и отсутствием АГ. Это связано со способностью данных лекарственных средств уменьшать альбуминурию/протеинурию. По данным проспективных контролируемых исследований, у больных с диабетической и недиабетическими нефропатиями они достоверно снижают риск развития терминальной почечной недостаточности. Антипротеинурические и нефропротективные свойства иАПФ и БРА проявляются на разных стадиях ХБП. Максимальный нефропротективный эффект терапии иАПФ/БРА у больных с диабетической нефропатией и АГ развивается в случае достижения целевого уровня АД. Дозы иАПФ/БРА для достижения антипротеинурического действия больше тех, которые вызывают снижение АД. Оптимальная доза определяется путем титрации с учетом уровня альбуминурии/протеинурии и может достигать максимальной [28, 29].
Проявление ХБП выявляют примерно у каждого десятого из общей популяции. При этом уже умеренное снижение СКФ или появление небольшой альбуминурии ассоциируется с увеличением риска развития кардиоваскулярных заболеваний и сопровождается повышением уровня общей смертности. У пациентов с АГ и ХБП в качестве препаратов первой линии или основного компонента комбинированного лечения рекомендуется назначение иАПФ или БРА. Данные группы препаратов обладают не только системным антигипертензивным действием, но и рядом локальных нефропротективных эффектов – как за счет торможения продукции медиаторов почечного повреждения на уровне клубочков, канальцев и интерстиция, так и за счет снижения внутриклубочковой гипертензии. Препараты групп иАПФ или БРА рекомендуется назначать пациентам с ХБП c индексами альбуминурии/протеинурии А2-А3 и отсутствием АГ. Это связано со способностью данных лекарственных средств уменьшать альбуминурию/протеинурию. По данным проспективных контролируемых исследований, у больных с диабетической и недиабетическими нефропатиями они достоверно снижают риск развития терминальной почечной недостаточности. Антипротеинурические и нефропротективные свойства иАПФ и БРА проявляются на разных стадиях ХБП. Максимальный нефропротективный эффект терапии иАПФ/БРА у больных с диабетической нефропатией и АГ развивается в случае достижения целевого уровня АД. Дозы иАПФ/БРА для достижения антипротеинурического действия больше тех, которые вызывают снижение АД. Оптимальная доза определяется путем титрации с учетом уровня альбуминурии/протеинурии и может достигать максимальной [28, 29].
Нефропротективное действие кандесартана у больных АГ с СД-2 типа и без него изучалось в ряде исследований. Так, в одном исследовании кандесартан показал сопоставимое с лизиноприлом и периндоприлом антигипертензивное и антипротеинурическое действия. Побочные эффекты реже развивались в группе лизиноприла. Достоверных различий в переносимости кандесартана и периндоприла не было. В другом исследовании сравнивали эффективность кандесартана, трандолаприла и периндоприла. Степень снижения протеинурии достоверно не различалась, также не наблюдалось изменений клиренса креатинина [30]. Согласно результатам исследования SMART, кандесартан показал дозозависимый антипротеинурический эффект. При этом прием дозы препарата, превышающей рекомендуемую максимальную, оказался относительно безопасным [31]. Кандесартан в дозе 16 мг 1 раз в день в исследовании CALM (The Candesartan and Lisinopril Microalbuminuria) у больных АГ и СД типа 2 показал сопоставимую антигипертензивную и антипротеинурическую эффективность с лизиноприлом в дозе 20 мг 1 раз в день. Комбинированное лечение обоими препаратами хорошо переносилось и было достоверно более эффективным и в снижении АД, и в уменьшении соотношения альбумин/креатинин [32]. В группе больных после трансплантации почки кандесартан назначался в минимальной начальной дозе с последующим увеличением путем медленной титрации до 12 мг в сутки. Около 2/3 больных к завершению этапа титрации получали максимальную дозу. Препарат не приводил к существенному снижению СКФ и гиперкалиемии. На фоне проводимой терапии уменьшилась выраженность протеинурии и сократилось число больных с альбуминурией [33]. В исследовании SECRET у больных с пересаженной почкой кандесартан более значимо снижал АД и уменьшал выраженность протеинурии по сравнению с плацебо при сопоставимом влиянии на частоту серьезных сердечно-сосудистых событий [34]. Таким образом, кандесартан обладает антипротеинурическим действием и может применяться как нефропротективный препарат у больных с ХБП различного генеза.
ЭФФЕКТИВНОСТЬ КАНДЕСАРТАНА ПРИ ХСН
БРА относятся к основной группе препаратов для лечения больных ХСН при непереносимости иАПФ. Рекомендовано использование трех препаратов из этой группы – это кандесартан, валсартан, лозартан. Преимуществами БРА является хорошая переносимость и возможность применения при исходно сниженной СКФ без коррекции дозы. Эффективность применения кандесартана при ХСН оценивалась в программе CHARM, включившей три независимых рандомизированных плацебо-контролируемых исследования [35]. Исследование CHARM–Alternative включало пациентов с систолической дисфункцией левого желудочка (фракция выброса ≤40%), которые не переносили иАПФ [36]. В CHARM-Added оценивали пациентов с систолической дисфункцией левого желудочка (фракция выброса левого желудочка ≤40%), уже получающих адекватные дозы иАПФ [37]. В CHARM-Preserved наблюдались пациенты с сохранной систолической функцией левого желудочка (фракция выброса ≥40%), не получающие иАПФ, но имеющие симптомы ХСН [38]. Во всех исследованиях в дополнение к обычной терапии больным назначался кандесартан в дозе 4–32 мг в сутки или плацебо. Критерием оценки результатов исследования были показатели общей смертности, комбинированный показатель смертности от ССЗ и частота госпитализаций по поводу декомпенсации симптомов ХСН. Итоги исследования CHARM продемонстрировали, что кандесартан снижает смертность от ССЗ у больных с ХСН, а также уменьшает частоту госпитализаций. Кандесартан может применяться у пациентов с ХСН не только при непереносимости иАПФ, но и дополнительно к терапии иАПФ. Препарат эффективен у пациентов с ХСН и сохранной фракцией выброса левого желудочка.
СРАВНЕНИЕ ЭФФЕКТИВНОСТИ РАЗНЫХ БРА
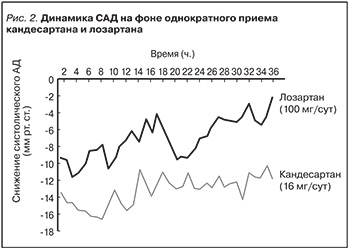
За время существования препарата проведено достаточное количество сравнительных исследований по изучению эффективности кандесартана не только с различными группами препаратов, но и с другими представителями БРА. В одном из плацебо-контролируемых исследований кандесартан в дозе 16 мг более значимо снижал уровень САД через 36 ч после однократного приема по сравнению с лозартаном в дозе 100 мг, при этом различия в динамике показателя были статистически достоверными (рис. 2) [39].
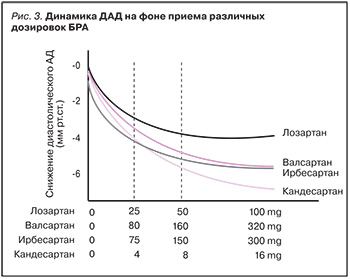
В исследовании, проведенном в 2002 г., кандесартан показал более выраженную антигипертензивную активность по сравнению с лозартаном, валсартаном, ирбесартаном (рис. 3) [40].
Согласно метаанализу 12 рандомизированных исследований с участием 3644 больных антигипертензивная эффективность кандесартана была выше, чем у лозартана, что отразилось в дополнительном снижении САД и ДАД на 2,97 и 1,79 мм рт.ст. соответственно. Доля больных, достигших целевого контроля АД, была больше в группе кандесартана. Препараты одинаково хорошо переносились, однако при лечении кандесартаном регистрировалось меньше серьезных побочных эффектов [41]. В 2011 г. были опубликованы результаты 9-летнего наблюдения за больными АГ без ССО, получавшими кандесартан или лозартан. К завершению исследования в группе кандесартана отмечено снижение не только риска развития сердечно-сосудистых событий на 14%, но риска развития сердечной недостаточности, нарушений ритма, периферического атеросклероза [42]. По результатам многоцентрового исследования кандесартан в дозе 8 мг в сутки, назначаемый после отмены лозартана, валсартана, телмисартана или олмесартана в среднетерапевтических дозах, способствовал дополнительному снижению утреннего АД на 10,1/4,4 мм рт.ст., офисного АД на 13,1/6,2 мм рт.ст. При этом на фоне приема кандесартана у 42% больных была достигнута нормализация утреннего АД, у 64,3% – офисного АД [43].
Таким образом, кандесартан является препаратом с уникальными фармакологическими свойствами, высоким профилем безопасности и отличной переносимостью, доказавшим свою антигипертензивную и органопротективную эффективность, приводящую к снижению риска ССО у пациентов с предгипертензией, АГ, СД, ХБП; оказывающим влияние на прогноз и частоту госпитализаций у больных с ХСН. Высокая степень селективности в отношении АТ II рецепторов первого типа, хорошая биодоступность, длительность антигипертензивного эффекта определяют большую клиническую эффективность кандесартана среди других представителей БРА.
В нашей стране зарегистрирован кандесартан под названием Гипосарт («Польфарма» АО, Польша). Биоэквивалентность препарата Гипосарт оригинальному кандесартану была доказана в исследовании с участием здоровых добровольцев (рис. 4).


