Аммиак является одним из важнейших нейротоксических метаболитов в организме человека. Хорошо известно, что повышение концентрации аммиака сопровождается развитием дисбаланса аминокислот в головном мозге с преобладанием ароматических с разветвленной цепью. Последствием гипераммониемии является отек астроглии, изменения постсинаптических рецепторов и процессов нейротрансмиссии, нарушения проницаемости гематоэнцефалического барьера и снижение энергетического обеспечения нейронов. Степень выраженности клинических проявлений этих нарушений напрямую коррелирует с уровнем аммиака в сыворотке крови, а уровень аммиака, в свою очередь, определяется состоянием детоксицирующей функции печени [1, 2].
Печень ‒ орган, который одновременно является источником аммиака и местом его обезвреживания. Аммиак в организме человека образуется преимущественно из азота пищевого белка в ходе реакций дезаминирования аминокислот в печени. Детоксикация осуществляется преимущественно в митохондриях перипортальных гепатоцитов за счет связывания с аминокислотами в орнитиновом цикле и образованием нетоксичной мочевины, а также в реакции образования глутамина с участием глутаминсинтетазы. Очевидно, что гипераммониемия развивается в организме человека прежде всего при хронических заболеваниях печени (ХЗП) вследствие нарушения ее детоксицирующей функции из-за снижения активности ферментов орнитинового цикла и глутаминсинтетазной реакции [1, 2].
В клинической практике наиболее частым проявлением гипераммониемии является печеночная энцефалопатия (ПЭ) при различной патологии печени. Под ПЭ понимают спектр нервно-психических расстройств, развивающихся в результате острой или хронической печеночно-клеточной недостаточности и/или портосистемном шунтировании крови [2]. В зависимости от выраженности нарушений деятельности головного мозга выделяют четыре степени тяжести печеночной энцефалопатии (табл.).
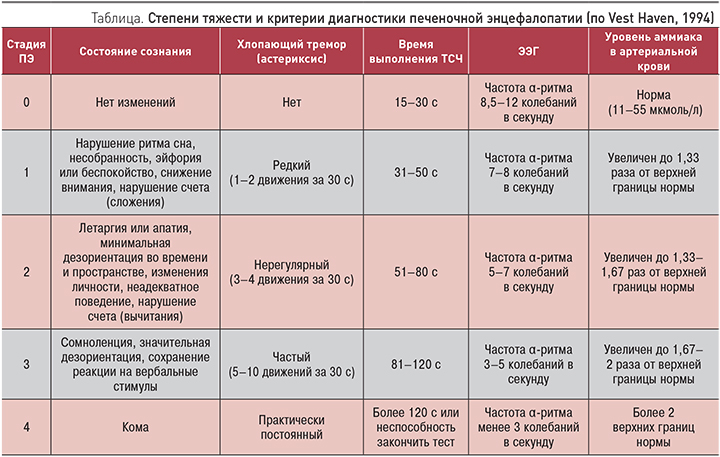
Очевидно, что выраженные нарушения когнитивных функций выявить легко, однако на самых ранних стадиях гипераммониемии явных клинических признаков патологии нет. Минимальную (латентную) ПЭ можно диагностировать, только используя специальные опросники или методы, например, метод выполнения теста связи чисел (ТСЧ) или метод вызванных потенциалов головного мозга, для проведения которого необходимо иметь специальный аппарат. При этом выявляются разнообразные когнитивные и психомоторные расстройства: трудности с принятием решений, снижение скорости психомоторных реакций и др. Неспецифическими клиническими симптомами латентной ПЭ могут быть повышенная утомляемость, слабость, раздражительность, инверсия сна (сонливость днем и бессонница ночью), нарушения речи, изменения почерка, рассеянность за рулем и при выполнении работы, требующей повышенной концентрации внимания, тремор, снижение мышечных рефлексов. Результатом таких нарушений могут стать серьезные дорожно-транспортные происшествия с тяжелыми последствиями [3, 4]. В связи с этим выявление минимальной ПЭ имеет большое значение у работников многих профессий: водителей автотранспорта, операторов на автоматизированном оборудовании и др.
В 2016 г. были опубликованы результаты исследования, которые показали, что гипераммониемия токсична не только для астроцитов. Получены данные о том, что повышение уровня аммиака дозозависимо активирует звездчатые клетки печени (ЗКП) и стимулирует коллагенообразование [5]. Звездчатые клетки печени активируются под влиянием различных факторов (алкоголя, вирусов, лекарств, холестаза и др.), при этом они приобретают сократительные, провоспалительные и профиброгенные свойства, т.е. трансформируются в миофибробластоподобные клетки. При этом из пролиферирующих ЗКП исчезают хранящиеся в них в покое запасы ретинола и появляется специфический белок гладких мышц (α-актин), одновременно увеличивается количество рецепторов к цитокинам, стимулирующим пролиферацию и фиброгенез. Активированные звездчатые клетки мигрируют и сосредотачиваются в месте поражения ткани печени, секретируя при этом большое количество внеклеточного матрикса (ВКМ) и одновременно регулируя деградацию этих молекул на уровнях транскрипции и посттранскрипции. Печеночный фиброз ассоциируется с изменением количества и качественного состава экстрацеллюлярного коллагенового матрикса (ЭКМ). При выраженных стадиях фиброза печень содержит приблизительно в 6 раз больше ЭКМ, чем в норме, а в его составе определяются коллагены (1, 3 и 4 типа), фибронектин, ундулин, эластин, ламинин, гиалуронан и протеогликаны. В случае преобладания процессов образования внеклеточного матрикса над его резорбцией формируется фиброзный рубец. На ранних стадиях развития фиброз ‒ процесс обратимый, а стадия цирроза с характерными сшивками между коллагеновыми волокнами и узлами регенерации – явление необратимое [1, 6].
Ученые из Великобритании в исследованиях in vitro и in vivo выявили многообразие действия повышенного уровня аммиака на печень. Было установлено, что гипераммониемия является активатором звездчатых клеток печени, снижает их клеточный метаболизм, активирует профиброгенный и провоспалительный профиль. Кроме этого, гипераммониемия дозозависимо стимулирует эндоретикулярный и окислительный стресс, а также нарушает внутрипеченочную гемодинамику за счет развития нитрозативного стресса, что сопровождается нарастанием портального давления [5].
Профиброгенное действие гипераммониемии было доказано значительным увеличением экспрессии белка α-SMA (активатора звездчатых клеток), синтеза виментина (важного промежуточного филамента), увеличением уровней миозина IIa (играющего ключевую роль в сокращении ЗКП), миозина IIb (важный фактор активации ЗКП), ростом уровней PDGF-Rβ и коллагена I типа. Было выявлено, что при обработке первичных ЗКП здоровых добровольцев аммиаком на протяжении 72 ч дозозависимо возрастает экспрессия провоспалительных интерлейкинов 1β и 6.
Электронная микроскопия показала выраженные изменения структуры цитоскелета клеток с образованием цитоплазматических вакуолей при гипераммониемии, однако эти изменения быстро регрессировали после помещения клеток в безаммиачную среду [3], т.е. были обратимы. При гистологическом изучении клеток наблюдали превращение миофибробластоподобных клеток в веретеноподобные фибробласты под действием повышенных концентраций аммиака.
Исследование с участием самцов крыс показало достоверную прямую корреляцию уровня аммиака с состоянием печени: при экспериментальном токсическом гепатите на фоне перевязки общего желчного протока уровень аммиака был достоверно выше, чем у животных с интактной печенью (182±12,8 против 62,51±6,2 мкМ, p<0,0001). Оказалось, что уровень аммиака в плазме достоверно напрямую коррелировал с уровнем портального давления, которое было значительно выше у крыс с гепатитом в сравнении с крысами контроля (14±0,6 против 5,5±0,3 мм рт.ст., p<0,0001).
Развитие нитрозативного стресса, являющегося причиной нарушений печеночной гемодинамики, было подтверждено статистически значимым (p<0,01) увеличением белковой экспрессии индуцированной NO-синтазы (iNOS), эндотелиальной NO-синтазы (eNOS), кавеолина-1 (внутриклеточного ингибитора eNOS) и 3-N-тирозина у крыс с гипераммониемией. Таким образом, в крупном исследовании показано, что гипераммониемия является одним из факторов, активирующих звездчатые клетки печени, и соответственно имеет важное значение в развитии и прогрессировании ХЗП.
 В клинической практике у больных с неалкогольной жировой болезнью (НАЖБП) уже на стадии стеатоза при отсутствии каких либо клинических и лабораторных признаков воспаления и печеночно-клеточной недостаточности определяется выраженное снижение детоксикации аммиака по обоим путям (уменьшается синтез и мочевины и глутамина) за счет выраженного (p<0,05) снижения активности соответствующих ферментов в печени.
В клинической практике у больных с неалкогольной жировой болезнью (НАЖБП) уже на стадии стеатоза при отсутствии каких либо клинических и лабораторных признаков воспаления и печеночно-клеточной недостаточности определяется выраженное снижение детоксикации аммиака по обоим путям (уменьшается синтез и мочевины и глутамина) за счет выраженного (p<0,05) снижения активности соответствующих ферментов в печени.
Очевидно, что в повседневной клинической практике должна активно проводиться диагностика концентрации аммиака у больных с ХЗП с целью выявления даже самых небольших отклонений от нормальных значений. Наиболее достоверным является прямой метод определения уровня аммиака в сыворотке крови. Однако прямой лабораторный метод диагностики редко доступен в широкой клинической практике, поскольку востребованность его в настоящее время ограниченна [7]. Кроме этого, вследствие быстрого разложения аммиака во внешней среде имеются существенные ограничения, касающиеся быстрой транспортировки пробы и проведения анализа. Корреляция между уровнем гипераммониемии и печеночной энцефалопатией дает возможность косвенным образом выявлять наличие гипераммониемии по скорости выполнения теста связи чисел (рис. 1) и последующим определением степени выраженности нарушений по прилагаемой таблице.
Тест связи чисел может провести как лечащий врач на приеме, так и непосредственно пациент самостоятельно онлайн по адресу: www.тестпечени.рф.
В исследовании показано, что электронный ТСЧ является простым в использовании инструментом для скрининга минимальной ПЭ, обладающим хорошей диагностической мощностью для обнаружения когнитивных нарушений у пациентов с циррозом печени [8].
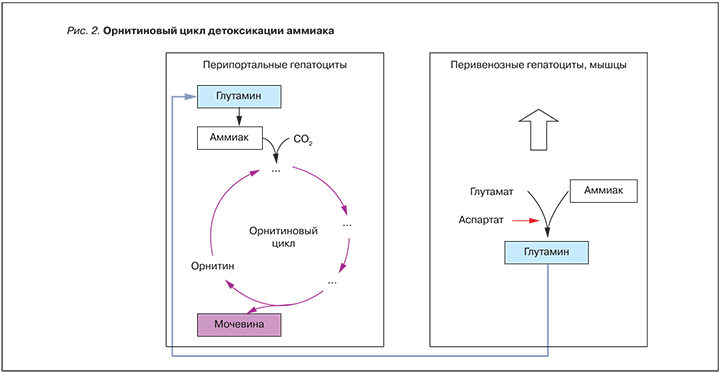
Логичным представляется применение у больных с хроническими заболеваниями печени препаратов, снижающих уровень аммиака, и прежде всего L-орнитин-L-аспартата (LOLA, Гепа-Мерц). Важной особенностью L-орнитин-L-аспартата является непосредственное участие препарата в орнитиновом цикле обезвреживания аммиака (рис. 2).
В исследованиях доказано, что прием L-орнитин-L-аспартата больными циррозом печени сопровождается достоверным снижением уровня аммиака в сыворотке крови, коррелирующим со снижением выраженности ПЭ (в том числе латентной), снижением частоты нарушений правил дорожного движения и дорожно-транспортных происшествий [3].
Гепатопротективные свойства LOLA выявлены в крупном многоцентровом нерандомизированном проспективном когортном исследовании, в котором приняли участие 1167 пациентов с ХЗП, в том числе 648 больных с неалкогольным стеатогепатитом (НАСГ) [9]. Прием препарата в гранулах сопровождался регрессией клинической симптоматики и снижением биохимической активности заболевания. По данным отечественных исследователей, нарастание уровня аммиака выявляется уже на доцирротической стадии ХЗП [7]. С использованием реогепатографии у больных с доцирротическими стадиями ХЗП было убедительно показано нарушение портального кровотока, коррелирующее с повышенным уровнем аммиака [10], а у больных НАЖБП с 0‒1 стадией фиброза (доцирротическая стадия) определялась гипераммониемия, которая на фоне применения L-орнитин-L-аспартата (Гепа-Мерц) существенно снизилась и сопровождалась улучшением общего состояния и лабораторных показателей. Лечение 289 пациентов НАСГ с использованием LOLA на протяжении 3 мес на фоне хорошей переносимости и высокого комплаенса больных способствовало снижению уровней аммиака, коррелирующему с улучшением портального кровотока, статистически значимому улучшению клинико-биохимических показателей и качества жизни [11].
Показаниями для применения L-орнитин-L-аспартат (Гепа-Мерц) являются ХЗП с энцефалопатией, а также стеатозы и стеатогепатиты различного генеза. L-орнитин-L-аспартат включен в рекомендации по диагностике и лечению НАЖБП для терапевтов, разработанных совместно экспертами Научного общества гастроэнтерологов России (НОГР) и Российского научного медицинского общества терапевтов (РНМОТ) [12].
С учетом результатов клинических исследований и опыта применения препарата для коррекции уровня гипераммониемии, уменьшения энцефалопатии и снижения темпов прогрессирования патологии можно рекомендовать следующие курсы приема L-орнитин-L-аспартата при ХЗП.
Короткий курс: 10‒14 дней по 1‒2 пакетика гранул (5‒10 г) больным ХЗП без изменений биохимических проб печени и временем ТСЧ от 41 до 50 с [7, 9] под контролем эффективности терапии с повторным использованием ТСЧ.
Средний курс: 30-дневный прием по 1‒2 пакетика гранул (5‒10 г) больным ХЗП с наличием синдрома цитолиза и/или гипербилирубинемии, без признаков печеночно-клеточной недостаточности (нормальные показатели белково-синтетической функции печени) и временем ТСЧ 51‒60 с [7, 9, 13] под динамическим контролем, при необходимости в составе комплексной терапии.
Длительный курс лечения: от 3 мес по 1‒2 пакетика гранул (5‒10 г) больным ХЗП с признаками печеночно-клеточной недостаточности (снижение уровня белка и альбумина, протромбинового индекса и т.п., повышение билирубина более 3‒4 верхних границ нормы), явными признаками печеночной энцефалопатии и/или временем выполнения ТСЧ более 60 с [13, 14] в составе комплексной терапии под активным динамическим контролем состояния пациента лечащим врачом и повторным использованием ТСЧ.
Таким образом, нормализация уровня аммиака является новым патогенетическим подходом при лечении ХЗП, позволяющим, кроме снижения выраженности энцефалопатии, улучшить печеночный кровоток и препятствовать развитию и прогрессированию фиброза печени.


