Стресс-эхокардиография (стресс-ЭхоКГ) представляет собой слияние двухмерной эхокардиографии с различными видами нагрузочных проб (физической, фармакологической или электрической стимуляцией) [1]. Это неинвазивный метод диагностики, позволяющий выявлять ишемию миокарда, определять бассейн пораженной коронарной артерии, оценивать жизнеспособность миокарда в зоне очагового повреждения и т.д. R. Tennant и C.J. Wiggers еще в 1935 г. показали, что окклюзия коронарной артерии немедленно приводит к возникновению нарушений локальной сократимости миокарда. Длительное снижение или полное прекращение коронарного кровотока приводит к развитию острого инфаркта миокарда [2]. Приблизительно в это же время A.M. Master разработал стандартный протокол оценки функциональной способности сердца в ответ на физическую нагрузку с одновременным мониторированием ЭКГ и гемодинамических параметров [3]. Таким образом, современная стресс-ЭхоКГ является соединением двух методик, каждой из которых более 60 лет.
Первые зарубежные и отечественные работы, изучающие изменение сократительной функции левого желудочка (ЛЖ) во время физической или фармакологической нагрузки, появились в конце 70-х гг. XX в. Исследования продемонстрировали высокую информативность метода в выявлении скрытой коронарной недостаточности. Однако на практике развитие этой методики затормозили многочисленные технические сложности, связанные с невозможностью у большого количества больных достичь необходимого качества визуализации структур сердца на фоне нагрузки [4, 5]. С появлением более совершенных ультразвуковых приборов, оснащенных цифровой системой анализа изображений с возможностью одновременного выведения на экран нескольких проекций сердца в режиме кинопетли, а также новых стресс-агентов и протоколов, открылись новые возможности для проведения нагрузочных проб. В настоящее время собран огромный объем данных по применению стресс-ЭхоКГ в крупномасштабных многоцентровых исследованиях, а также установлена безопасность и прогностическая ценность метода у тысяч больных, обследованных в реальных клинических условиях [6, 7].
К основным преимуществам стресс-ЭхоКГ относятся:
- возможность получения изображений сердца в различных проекциях, визуализация каждого сегмента;
- оценка результатов исследования в режиме реального времени с высоким пространственным разрешением;
- мобильность современных ультразвуковых приборов;
- безопасность исследования ввиду его неинвазивности и отсутствия ионизирующей радиации;
- хорошая переносимость пробы больными, возможность ее многократного проведения;
- сравнительно небольшая стоимость.
При этом, как и любой другой метод, нагрузочная ЭхоКГ имеет и свои недостатки:
- сложность выполнения исследования у пациентов с плохим качеством визуализации структур сердца;
- субъективность интерпретации полученных изображений;
- высокая стоимость подготовки квалифицированного специалиста [10]. Так, специалист, выполняющий нагрузочную ЭхоКГ, должен иметь большой опыт выполнения трансторакальной ЭхоКГ (не менее 300 самостоятельных исследований), провести под контролем супервайзера 50–100 стресс-ЭхоКГ, а также в дальнейшем выполнять не менее 100 исследований в год. Кроме того, такой врач должен владеть навыками неотложной помощи [11].
Наиболее частым показаниями для проведения стресс-ЭхоКГ являются:
- диагностика ишемической болезни сердца (ИБС);
- выявление бассейна пораженной артерии;
- оценка прогноза и стратификация риска у больных ИБС;
- оценка жизнеспособности миокарда в зоне очагового повреждения [11].
С развитием новых технологий и накоплением клинических данных появились и другие показания для проведения стресс-ЭхоКГ:
- выявление нарушений диастолической функции как причины симптомов при недостаточности кровообращения с сохраненной фракцией выброса ЛЖ;
- оценка давления в легочной артерии при широком спектре заболеваний;
- выявление внутрижелудочковой обструкции при гипертрофической кардиомиопатии, реже оценка прогноза при дилатационной кардиомиопатии;
- оценка клапанной патологии, прежде всего тяжести аортального стеноза у больных с низким сердечным выбросом;
- в некоторых случаях врожденные пороки, а также обследование спортсменов.
Таким образом, в зависимости от поставленной диагностической задачи, помимо сократимости ЛЖ, необходимо регистрировать различные показатели, характеризующие функцию клапанов сердца, диастолическую функцию, обструкцию выносящего тракта левого желудочка (ВТЛЖ), давление в легочной артерии. Критерием положительной пробы в таких случаях может также быть появление специфических целевых признаков (обструкции ВТЛЖ, нарастание градиента на аортальном клапане и др.) [12].
При стресс-ЭхоКГ наиболее широко используются следующие виды нагрузок:
- физические (вертикальная и горизонтальная велоэргометрия, бег на тредмиле);
- фармакологические (пробы с добутамином, дипиридамолом, аденозином);
- чреспищеводная электрическая стимуляция предсердий (ЧПЭСП);
- проба с электрокардиостимуляцией (ЭКС) [11].
Каждая из видов нагрузок имеет свои особенности. Физическая нагрузка провоцирует ишемию на фоне увеличения потребности миокарда в кислороде и используется наиболее часто [13].
Добутамин, являясь синтетическим катехоламином, селективно стимулирует β1-рецепторы, усиливает инотропную и хронотропную активность сердца, повышая тем самым потребность миокарда в кислороде [14]. Гемодинамические эффекты его действия линейно коррелируют с концентрацией препарата в плазме крови. Период его полувыведения равен всего 2 мин, а малые дозы (до 10–15 мкг/кг/мин), увеличивая сократимость миокарда, значимо не влияют на частоту сердечных сокращений (ЧСС), что позволяет выявлять жизнеспособность и инотропный резерв миокарда.
Дипиридамол относится к артериальным вазодилататорам. Механизм его действия основан на феномене меж- и интракоронарного «обкрадывания», который возникает при повышении концентрации эндогенного аденозина. Введение дипиридамола индуцирует ишемию миокарда в бассейне стенозированной артерии за счет преимущественного расширения интактных артерий и увеличения кровотока в здоровых участках миокарда [15, 16].
Методы ЧПЭСП и пробы с ЭКС основаны на ступенчатом увеличении ЧСС до достижения целевых значений или других критериев к остановке пробы [11].
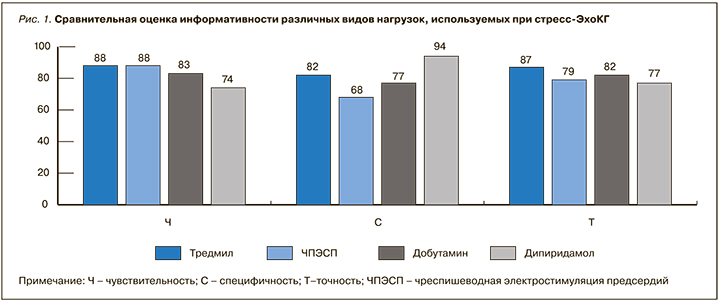
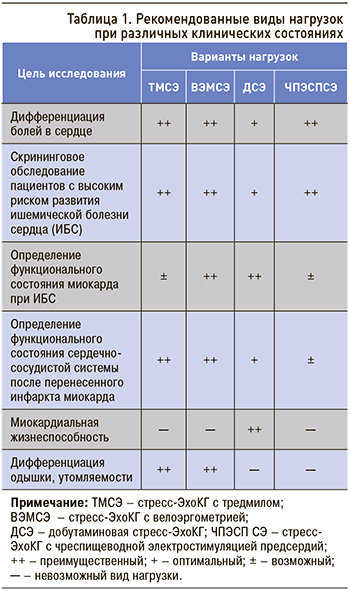 Каждая из нагрузок имеет свои преимущества и недостатки. В таблице 1 представлены рекомендованные виды нагрузок при различных клинических состояниях, а на рисунке 1 – сравнительная оценка информативности различных видов нагрузок, используемых при стресс-ЭхоКГ.
Каждая из нагрузок имеет свои преимущества и недостатки. В таблице 1 представлены рекомендованные виды нагрузок при различных клинических состояниях, а на рисунке 1 – сравнительная оценка информативности различных видов нагрузок, используемых при стресс-ЭхоКГ.
К преимуществам физической нагрузки относятся ее простота, физиологичность, хорошая переносимость больными, а также возможность оценки реакции сердечно-сосудистой системы на нагрузку. Недостатками являются сложность получения качественных изображений на высоте нагрузки и довольно часто невозможность проведения пробы у определенного контингента больных (пациенты с выраженной одышкой, атеросклерозом артерий нижних конечностей, неконтролируемой АГ и т.д.).
Главные достоинства фармакологических проб – получение наиболее качественных изображений сердца, возможность выявления станнированного или гибернированного миокарда, недостатки – более частое возникновение во время пробы различных нарушений ритма сердца и колебаний АД [17].
Преимущества ЧПЭСП включают непродолжительность пробы и возможность ее быстрой остановки, недостатки – относительно невысокая чувствительность и дискомфорт для больного, связанный непосредственно со стимуляцией.
Независимо от вида нагрузки существуют общие положения протокола проведения стресс-ЭхоКГ. Электроды ЭКГ размещают стандартным образом на конечностях и грудной клетке, немного смещая вверх или вниз. 12-канальная ЭКГ регистрируется в покое и на протяжении всего исследования. АД измеряют в состоянии покоя и в конце каждой ступени нагрузки. Эхокардиографические изображения регистрируются в покое, на максимуме нагрузки и при необходимости на промежуточных ступенях из парастернального доступа по длинной и короткой осям ЛЖ и из апикального доступа в четырех-, двух- и трехкамерной позициях. Для сравнительного анализа используется режим с одновременным выведением четырех изображений на экран [11].
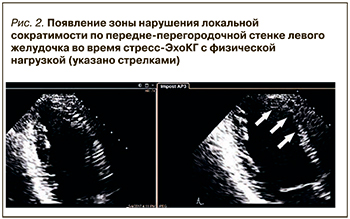 Анализ полученных данных проводят с использованием 16- или 17-сегментной модели ЛЖ и 4-балльной шкалы оценки локальной сократимости [11, 18]. На рисунке 2 показан пример появления нарушения локальной сократимости по переднеперегородочной стенке ЛЖ на максимуме нагрузки.
Анализ полученных данных проводят с использованием 16- или 17-сегментной модели ЛЖ и 4-балльной шкалы оценки локальной сократимости [11, 18]. На рисунке 2 показан пример появления нарушения локальной сократимости по переднеперегородочной стенке ЛЖ на максимуме нагрузки.
Диагностически значимые критерии прекращения пробы:
- достижение максимальной нагрузки или максимальной дозы препарата;
- достижение целевой ЧСС;
- возникновение очевидных ЭхоКГ-признаков положительной пробы: появление нарушения локальной сократимости миокарда в двух или более сегментах ЛЖ или других специфических целевых признаков (обструкция ВТЛЖ, нарастание градиента на аортальном клапане и др.);
- выраженная боль в грудной клетке, развитие жизнеугрожающих нарушений ритма и проводимости сердца [11, 12].
К диагностически незначимым критериям прекращения стресс-ЭхоКГ относятся:
- АГ (повышение систолического АД >220 мм рт.ст. или диастолического АД >120 мм рт.ст.);
- симптомная артериальная гипотензия со снижением АД >40 мм рт.ст.;
- наджелудочковые аритмии (суправентрикулярная тахикардия или фибрилляция предсердий);
- сложные желудочковые нарушения ритма (желудочковая тахикардия или частые полиморфные желудочковые экстрасистолы).
 Максимальная чувствительность пробы достигается отменой антиангинальных препаратов за 48–72 ч до исследования [11].
Максимальная чувствительность пробы достигается отменой антиангинальных препаратов за 48–72 ч до исследования [11].
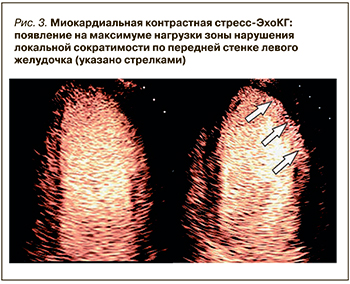
Несмотря на высокую чувствительность стресс-ЭхокГ, у 20–30% пациентов плохое качество визуализации может существенно снижать информативность исследования [19]. Решением этой проблемы стало внедрение в практику ультразвуковых контрастных препаратов, представляющих собой микропузырьки с газообразным содержимым, которые при внутривенном введении с током крови заполняют камеры сердца, позволяя более четко визуализировать границу эндокарда ЛЖ и оценивать региональную систолическую функцию [20] (рис. 3).
Дополнительно среди преимуществ этого метода можно выделить возможность оценки миокардиальной перфузии на основании повторного накопления контрастного препарата после разрушения микропузырьков высокоэнергетическим ультразвуковым импульсом. Наиболее актуально это в случаях, когда сократимость миокарда не снижена, несмотря на наличие субэндокардиальной ишемии, проявляющейся снижением перфузии в этой области [21, 22].
Согласно Европейской ассоциации кардиоваскулярной визуализации, применение контрастного препарата при стресс-ЭхоКГ показано всем больным с неудовлетворительной визуализацией двух или более смежных сегментов ЛЖ. Оценка перфузии должна рассматриваться у всех пациентов, которым проводится фармакологическая проба и пациентам высокого риска ИБС, которым выполняется проба с физической нагрузкой (уровень доказательности IA) [23].
В результате многочисленных исследований доказано, что стресс-ЭхоКГ в отношении диагностики ИБС имеет существенные преимущества перед нагрузочной пробой с ЭКГ [24]. Основным предназначением этой пробы является идентификация пациентов высокого риска ИБС, которым показана коронароангиография (КАГ) [25]. Достижение больным нагрузки высокой интенсивности при отсутствии ишемической динамики на ЭКГ с высокой вероятностью говорит об отсутствии тяжелого поражения коронарных артерий. Появление значимых изменений на ЭКГ во время нагрузки (особенно в совокупности с болями ангинозного характера) служит предиктором значимого поражения коронарного русла и требует проведения КАГ. В остальных случаях показано проведение стресс-ЭхоКГ для определения показаний к реваскуляризации миокарда [24] (рис. 4).
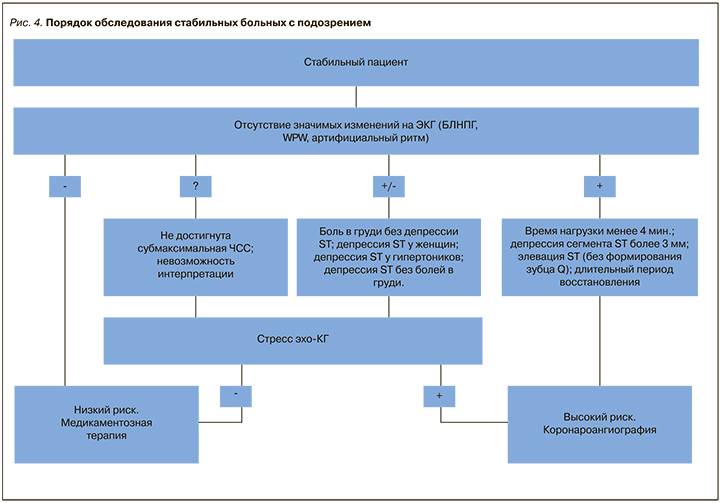
По сравнению с перфузионной сцинтиграфией миокарда стресс-ЭхоКГ обладает более высокой специфичностью (особенно у больных с блокадой левой ножки пучка Гиса), безопасностью ввиду отсутствия лучевой нагрузки, меньшей стоимостью, простотой и удобством в применении, а также возможностью оценивать преходящую ишемию миокарда в режиме реального времени [26, 27]. К преимуществам перфузионной сцинтиграфии миокарда с нагрузкой относится более высокая чувствительность (особенно при однососудистом поражении огибающей артерии) и более высокая точность при наличии множественных нарушений локальной сократимости ЛЖ в покое [28, 29].
ЗАКЛЮЧЕНИЕ
Стресс-ЭхоКГ, будучи перспективным методом исследования, продолжает развиваться. Пути этого развития связаны с повышением качества визуализации, созданием новых технологий, внедрением новых стрессорных агентов, объективизацией обработки получаемой информации. Возможности использования нагрузочной ЭхоКГ не ограничиваются только вопросами диагностики ИБС. Очень важным является определение прогноза реваскуляризационных мероприятий, который во многом зависит от состояния жизнеспособности диссинергичного миокарда, резерва сократимости левого желудочка, особенно у больных со сниженной фракцией выброса и проявлениями сердечной недостаточности. Также стресс-ЭхоКГ позволяет выявлять нарушения диастолической функции, обструкцию ВТЛЖ, оценивать давление в легочной артерии, клапанную патологию и т.д.


