Саркоидоз относится к распространенным полисистемным воспалительным заболеваниям неизвестной природы, в иммунопатогенезе которого ведущими механизмами являются активация Т-клеток, избыточное высвобождение хемокинов и других провоспалительных цитокинов, что приводит к развитию неказеифицирующих гранулем в различных органах [1].
В последние годы интерес исследователей обращен к изучению частого и раннего симптома саркоидоза – усталости [2]. Данный симптом может проявляться самостоятельно вне зависимости от других симптомов. Распространенность усталости при саркоидозе варьируется от 30 до 80% [1–3]. Причины развития усталости изучены недостаточно, однако известно, что появление данного симптома является многофакторным процессом, который включает растормаживание активного системного воспаления с избыточным высвобождением цитокинов, прогрессирование депрессии, нарушение сна и/или невропатии мелких нервных волокон [4].
Имеются сведения о том, что усталость при саркоидозе появляется чаще и выражена сильнее, чем у здоровых людей, может приобретать хронический характер, значительно изменять качество жизни (КЖ) пациентов даже при отсутствии или снижении активности других признаков заболевания [5, 6].
Используемые в настоящее время в клинической практике инструменты для выявления и мониторинга усталости ограниченны. С целью диагностики усталости Всемирная организация саркоидоза и других гранулематозных заболеваний рекомендует «Шкалу оценки усталости» FAS (Fatigue Assessment Scale) в качестве валидизированного инструмента, доступного более чем на 15 языках [7].
Сведения об усталости при саркоидозе в большей степени представлены в исследованиях зарубежных авторов, в то время как отечественных публикаций, посвященных данной проблеме, нет.
Цель исследования – изучить усталость у пациентов с саркоидозом органов дыхания (СОД) с помощью опросника FAS; выделить факторы, ассоциированные с усталостью; оценить влияние усталости на КЖ и уровень физической работоспособности.
МАТЕРИАЛ И МЕТОДЫ
В одномоментное сравнительное исследование включили 80 больных СОД (43 мужчины, 37 женщин), находившихся на диспансерном наблюдении в «Городском консультативном пульмонологическом центре» ГБУЗ Нижегородской области «Городская больница № 28», Нижний Новгород с 2016 по 2019 г. и направленных на обследование в ГБУЗ НО «Городская клиническая больница № 38» Нижний Новгород. Медиана возраста больных составила 35 (29–45) лет, стажа заболевания – 3 (2–4) года. Гистологическое подтверждение саркоидоза имели 75% пациентов.
Критериями включения служили диагноз «саркоидоз», установленный в соответствии с федеральными клиническими рекомендациями по диагностике и лечению саркоидоза (2019) [1]; вовлечение в патологический процесс органов дыхания, подтвержденное данными компьютерной томографии органов грудной клетки; возраст 18–65 лет.
Критериями исключениями из исследования были острые респираторные и тяжелые хронические неинфекционные заболевания (хроническая дыхательная недостаточность II–III степеней, хроническая сердечная недостаточность III–IV функционального класса, декомпенсированные формы сахарного диабета, онкологические заболевания).
Исследование выполнено в соответствии со стандартами надлежащей клинической практики и принципами Хельсинской декларации. Протокол исследования одобрен локальным этическим комитетом Института биологии и биомедицины ФГАОУ ВО «Национальный исследовательский нижегородский государственный университет им. Н.И. Лобачевского» (протокол № 33 от 28.02.2019). Все пациенты, соответствующие критериям включения, подписали информированное добровольное согласие на участие в исследовании.
У всех больных оценивали клинические симптомы, факторы риска, особенности дебюта (острое или хроническое течение), внелегочные проявления саркоидоза и прием системных глюкокортикостероидов (сГКС) в анамнезе.
Для выявления и количественной оценки усталости использовали шкалу оценки усталости (FAS), состоящую из 10 вопросов (по 5 вопросов для определения физического и умственного характера усталости). На каждый вопрос предлагалось 5 вариантов ответов в диапазоне «Всегда» – «Никогда». Учитывая рекомендации по использованию FAS, рассчитывали физический, умственный компоненты и общий балл.
КЖ оценивали с помощью опросника SF-36 (Short Form Medical Outcomes Study 36), основу которого составляют 36 вопросов и 8 шкал, сформированных из 2–10 вопросов. Шкалы опросника объединены в 2 суммарных измерения:
- • физический компонент здоровья (физическое и ролевое функционирование, обусловленное физическим состоянием, интенсивность боли, общее состояние здоровья);
- • психологический компонент здоровья (психологическое здоровье, ролевое эмоциональное и социальное функционирование, жизненная активность).
Чем выше показатель по каждой шкале, тем лучше КЖ по изучаемым компонентам.
Исследование функции внешнего дыхания (ФВД) в покое и кардиопульмональное нагрузочное тестирование (КПНТ) с газовым анализом проводили с помощью системы Quark «COSMED» (Италия). При проведении КПНТ использовали ступенчато возрастающий протокол с индивидуальным расчетом прироста мощности нагрузки таким образом, чтобы тестирование длилось от 8 до 12 мин [8].
Статистическая обработка результатов исследования проводилась с помощью программы R 3.5.2. Для оценки нормальности распределения использовали критерий Шапиро–Уилка. Нормально распределенные показатели представлены в виде среднего и стандартного отклонения (M±SD), отличные от нормального – в виде медианы и межквартильного интервала Me (Q1 – 25-й; Q3 – 75-й квартиль). Для сравнения количественных переменных в зависимости от распределения использовался дисперсионный анализ или U-критерий Манна–Уитни; для биноминальных переменных – точный критерий Фишера и хи-квадрат с поправкой на правдоподобие (χ2) для переменных, имеющих более 2 категорий. Оптимальные пороговые значения определяли с помощью ROC-анализа. Многофакторный анализ проводили с помощью бинарной логистической регрессии. Линейная взаимосвязь оценивалась с помощь коэффициента ранговой корреляции Спирмена (r). Нулевая гипотеза об отсутствии статистически значимых различий отвергалась при p <0,05.
РЕЗУЛЬТАТЫ
По результатам исследования усталости у всех пациентов с саркоидозом общий бал FAS находился в диапазоне от 2 до 34 баллов с медианой 17 (14–25,5) баллов. Физический компонент усталости преобладал над умственным: 10 (7–14) и 8 (6–10) (р <0,001). В соответствии с рекомендациями по использованию опросника [1] пациентов разделили на 2 группы: группа 1 (n=51) – FAS <22 баллов (отсутствие усталости); группа 2 (n=29) – FAS ≥22 баллов (наличие усталости).
В таблице 1 представлена сравнительная характеристика пациентов с СОД с учетом наличия или отсутствия у них усталости. Между собой группы различались по возрасту (р=0,005). Усталость чаще развивалась у женщин (р <0,001) и пациентов с внелегочными проявлениями (р=0,031), которые в 100% случаев были представлены негранулематозным поражением кожи по типу нодозной эритемы. С другой стороны, в группе 1 преобладали пациенты с бессимптомным течением заболевания по сравнению с пациентами, имевшими FAS ≥22 баллов (р=0,008). Не оказывали влияния на возникновение усталости форма дебюта и длительность заболевания, рентгенологические стадии, сопутствующие заболевания и терапия сГКС (р >0,05).
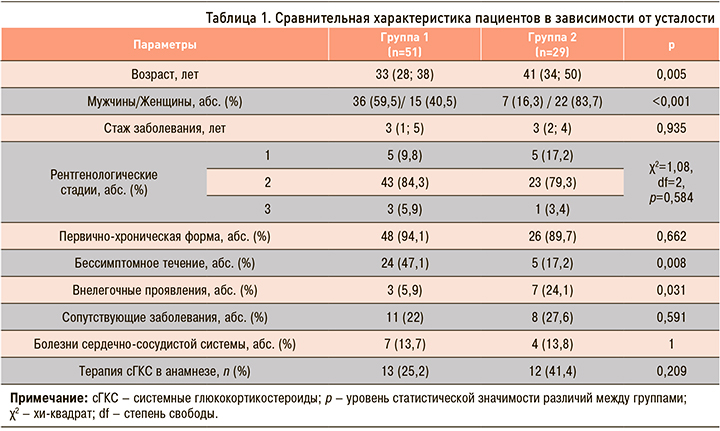
Анализ лабораторных показателей крови (число лейкоцитов и клеток лейкоцитарной формулы, количество тромбоцитов, уровень аминотрансфераз (АЛТ, АСТ), билирубина, мочевины) статистически значимых различий между группами не выявил.
Параметры предтестовой спирометрии, позволяющие выявить обструктивные и/или рестриктивные нарушения вентиляционной функции легких, у большинства больных превышали 80% от должных величин (д.в.). Только у 7 пациентов группы 1 выявили обструктивные нарушения легкой степени тяжести. Учитывая, что в анализируемых по уровню усталости группах статистически значимые различия параметров ФВД отсутствовали (табл. 2), показатели спирометрии в многофакторном анализе не учитывались.
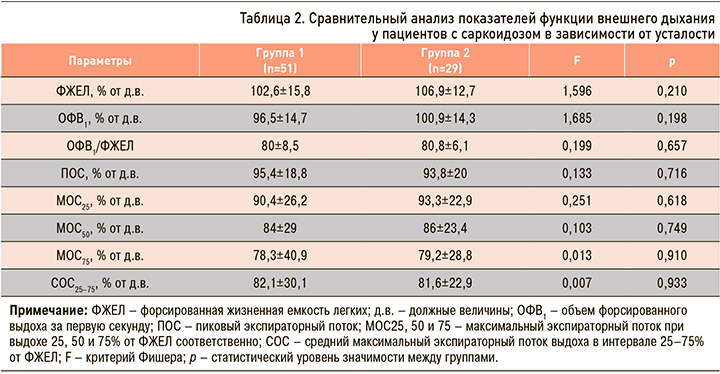
Анализ результатов КПНТ (табл. 3) выявил, что пациенты с усталостью имели более низкое значение достигнутой максимальной нагрузки и снижение уровня потребления кислорода на пике нагрузки, выраженного в мл/мин/кг (р <0,05). Кроме того, у больных группы 2 в ходе нагрузочного тестирования отмечалось снижение кислородного пульса (VO2/ЧСС; р=0,033), дыхательного объема (р=0,008) и минутного объема вентиляции (р=0,002) по сравнению с пациентами без усталости. По другим параметрам, в том числе по уровню кислорода (процент от д.в.) – ключевого показателя физической работоспособности, группы были сопоставимы между собой (p >0,05).
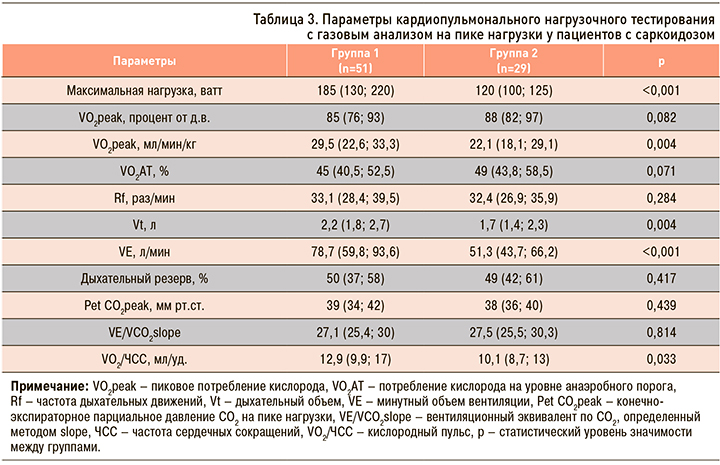
С целью выявления факторов, влияющих на появление усталости, переменная возраста была переведена в биноминальное распределение. По данным ROC-анализа, оптимальный порог, при котором возникала усталость, соответствовал возрасту старше 39 лет (площадь под кривой AUC=0,689; р=0,003). Для оценки влияния факторов, которые имели статистически значимые различия между группами, на развитие усталости был проведен анализ бинарной логистической регрессии.
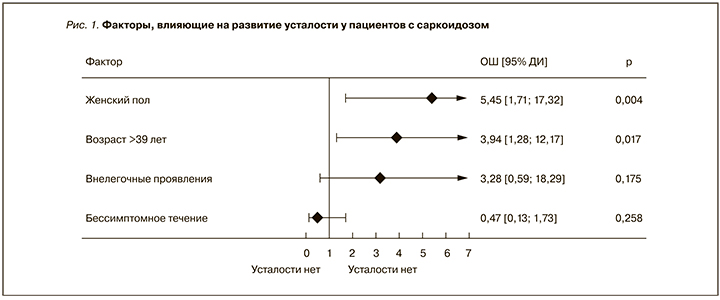
Многофакторный анализ (рис. 1) показал, что только возраст и гендерная принадлежность выступали независимыми предикторами развития усталости. Внелегочные проявления и бессимптомное течение в представленной модели статистически значимого влияния в формировании усталости не оказывали (р=0,175 и р=0,258 соответственно).
При анализе КЖ пациентов с саркоидозом в группе 2 наблюдалось снижение всех изучаемых показателей по сравнению с группой 1. В частности, при наличии усталости медиана психологического компонента здоровья была на 32,6 баллов ниже: группа 1 – 85,7 (74,9–91); группа 2 – 53,2 (44,4–68) (р <0,001), а физического компонента – на 28 баллов: группа 1 – 88,4 (78,8–91,4); группа 2 – 60,4 (49,1–71,3) (р <0,001). Существенные различия между группами были зарегистрированы по всем шкалам опросника КЖ (SF-36) (рис. 2). Наиболее значимое ухудшение КЖ у пациентов с усталостью наблюдалось по шкале ролевое эмоциональное функционирование (RE): 33,3 (33,3–66,7) баллов (группа 2) относительно 100 (100–100) баллов (группа 1) (p <0,001). По шкале ролевое функционирование, обусловленное физическим состоянием (RP), показатель КЖ в группе 2 составил 50 (25–100) баллов против 100 (100–100) баллов (p <0,001) в группе 1.

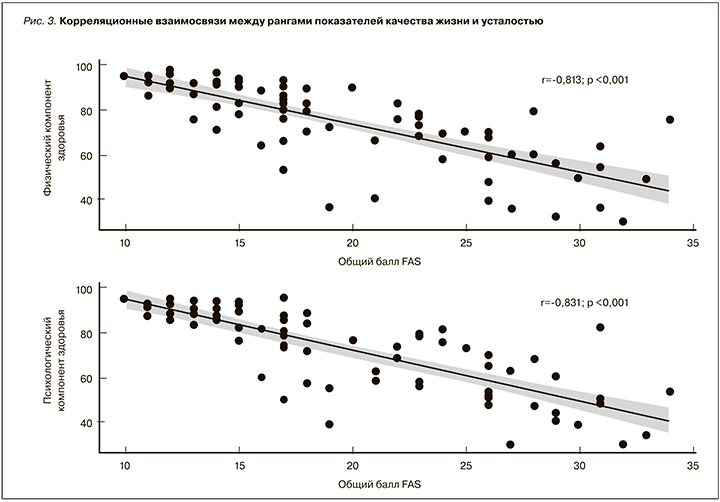
Корреляционный анализ (рис. 3) установил линейное снижение показателя психологического компонента здоровья при увеличении общего балла FAS (r=-0,831; p <0,001). Аналогичная закономерность связи определялась между физическим компонентом здоровья и усталостью (r=-0,813; p <0,001).
ОБСУЖДЕНИЕ
Распространенность усталости в популяции здоровых взрослых варьирует от 15 до 32%. При этом женщины отмечают усталость в 3–6 раз чаще, чем мужчины [9]. В работе японских исследователей было продемонстрировано, что в японской популяции взрослых в возрасте 20 лет усталость встречалась у 17,2% и также чаще у женщин, чем у мужчин (р=0,001) [10]. Настоящее исследование продемонстрировало, что более чем в 35% случаев саркоидоз сопровождался развитием усталости с преобладанием ее физического компонента.
Причины появления усталости при саркоидозе до конца не изучены, но на основании однофакторного анализа нами установлена связь усталости с возрастом и гендерной принадлежностью пациентов с СОД, наличием клинической симп-томатики и внелегочными проявлениями, что согласуется с исследованиями зарубежных авторов [6, 7, 11, 12]. С другой стороны, как и в проведенных ранее исследованиях, мы не установили влияния ограничений вентиляционной функции легких и выраженности рентгенологических изменений легочной ткани и/или внутригрудных лимфоузлов на появление усталости при саркоидозе. Многофакторный анализ фактически выделил только два прогностически значимых фактора усталости у пациентов с СОД: возраст старше 39 лет и женский пол.
В отличие от предыдущих исследований мы впервые изучили комплекс параметров КПНТ у пациентов с СОД. По нашим данным, абсолютные значения VO2peak и максимальная нагрузка у пациентов группы 2 были значимо ниже. Вероятно, это связано с тем, что в группе обследованных с усталостью преобладали женщины. С учетом того что толерантность к физической нагрузке у женщин меньше, чем у мужчин, можно объяснить установленную разницу вышеперечисленных показателях КПНТ в анализируемых группах. Это также подтверждается отсутствием статистически значимых межгрупповых различий уровня VO2peak (процент от д.в.), в расчете которого учитываются пол, возраст и масса тела тестируемых. Аналогично объясняется разница и по другим показателям нагрузочного тестирования, которые тесно связаны с антропометрическими характеристиками исследуемых (дыхательный объем, минутный объем вентиляции, кислородный пульс).
Схожие результаты были получены в ранее опубликованных работах [6, 13], где усталость не зависела от общего уровня физической работоспособности и показателей динамометрии верхних и нижних конечностей. С другой стороны, в исследовании B. Strookappe et al. толерантность к физической нагрузке у пациентов с саркоидозом, оцениваемая с помощью теста с 6-минутной ходьбой, была значимым независимым предиктором общей усталости (p=0,006). При этом прогностическая способность представленной модели была очень низкой (11%) [3]. Такие противоречивые результаты могут быть связаны с тем, что усталость пациентов не достигала тяжелой степени выраженности и не приводила к значимым физическим ограничениям [14].
КЖ является важной интегральной характеристикой физического, психологического, социального и эмоционального состояния пациента и служит основной или дополнительной целью лечения. Показано, что у больных саркоидозом наличие усталости приводит к снижению большинства доменов КЖ [15]. В настоящей работе нами установлено негативное влияние усталости на все сферы КЖ пациентов при максимальной дельте в шкалах, формирующих психологический компонент здоровья. Такая разница может быть связана с тем, что усталость нередко сопровождается депрессией. Таким образом, усталость, диагностированная с помощью инструмента FAS, может косвенно выступать индикатором уровня КЖ.
К ограничениям данной работы следует отнести небольшую выборку пациентов, особенно с наличием усталости, отсутствие больных, имевших усталость тяжелой степени, недостаточное число обследованных с внелегочными проявлениями саркоидоза. При этом полученный материал позволил выявить определенные связи и тенденции, демонстрирующие влияние усталости на течение саркоидоза, что требует дальнейших углубленных исследований в этой области.
ЗАКЛЮЧЕНИЕ
Среди пациентов с саркоидозом усталость является распространенным симптомом, вероятность возникновения которого выше у женщин и у пациентов старше 39 лет. Также не исключается связь усталости с клинически значимой симптоматикой и внелегочными проявлениями. Появление усталости у больных саркоидозом оказывает негативное влияние на КЖ, особенно на ее психологический компонент.


