Ассоциация поражения почек с моноклональной гаммапатией (МГ) известна терапевтам и врачам общей практики на примере цилиндровой нефропатии – «почечного осложнения» множественной миеломы. В этом случае, как правило, имеет место «большой» по объему вовлечения костного мозга клон плазматической клетки, который продуцирует соответствующее количество моноклонального иммуноглобулина (ИГ), что обусловливает массивную обтурацию почечных канальцев кристаллами легких цепей и развитие острого повреждения почек. Неслучайно «миеломную» почку относят к критериям симптоматической миеломы [1, 2]. Однако при МГ, когда существует клон В-клеточной линии дифференцировки (плазматической клетки или В-лимфоцита), продуцирующий моноклональный ИГ, степень пролиферации клона может быть различной.
Хорошо известны такие варианты МГ, ассоциированные с небольшим объемом клональных клеток, как моноклональная гаммапатия неопределенного значения (МГНЗ) и моноклональный В-клеточный лимфоцитоз. При этих, с точки зрения гематолога, «предраковых», «субклинических» состояниях, аберрантный клон также вырабатывает моноклональный белок, или парапротеин, который способен оказывать патологическое воздействие на органы и ткани, в том числе на почку, приводя к развитию необратимых изменений почечной паренхимы и соответственно прогрессирующей дисфункции органа [3]. В такой ситуации МГ перестает иметь неопределенное значение, которое теперь определяется патогенетической связью клона и ренального поражения продуцируемым им моноклональным белком и почечным прогнозом. Понимание ассоциации парапротеина с ренальным повреждением, отличным от миеломной почки, сложилось по мере изучения этой проблемы [4, 5] и накопления знаний и в итоге вылилось в концепцию моноклональной гаммапатии ренального значения (МГРЗ). Впервые термин МРГЗ был предложен в 2012 г. Международной группой по изучению поражения почек и моноклональной гаммапатии (International Kidney and Monoclonal Gammopathy Research group) [6]. Под МГРЗ понимают патологическое состояние, обусловленное пролиферацией клона В-клеток или плазматических клеток, не достигающего гематологических критериев для начала лечения, но продуцирующего нефротоксичный моноклональный ИГ, приводящий к специфическому повреждению почек [7]. Термин МГРЗ является относительно новым как для нефрологов, так и для гематологов, и такие варианты этой патологии, как болезнь отложения легких/тяжелых цепей, будут включены в новую версию Международной классификации болезней (МКБ-11) в рубрике «Плазмоклеточные новообразования» [8].
Таким образом, МГРЗ представляет собой междисциплинарную проблему, находящуюся на стыке онкогематологии и нефрологии. Если распространенность и прогноз поражения почек при цилиндровой нефропатии в случае критериальной множественной миеломы достаточно хорошо изучены [9, 10], то распространенность, структура и почечный прогноз при МГРЗ остаются не до конца определенными, в том числе в российской популяции.
Целью настоящего исследования был анализ распространенности, структуры и почечного прогноза у пациентов с МГРЗ по данным клиники нефрологии Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова.
МАТЕРИАЛ И МЕТОДЫ
Из 1580 пациентов, которым было впервые выполнено морфологическое исследование почечной ткани в период с 2011 по 2018 г., были отобраны случаи, удовлетворяющие критериям МГРЗ [7]:
- наличие пролиферации клона В-клетки/плазматической клетки, не требующей инициации лечения по гематологическим показаниям;
- морфологически верифицированное поражение почек, ассоциированное с продукцией моноклонального белка.
Клинико-морфологические исследования. У включенных пациентов оценивали такие клинико-демографические показатели, как пол, возраст на момент установления диагноза и конца наблюдения, креатинин сыворотки, расчетную СКФCKD-EPI (рСКФ) [11], суточную протеинурию (СП), альбумин сыворотки крови. При диагностике МГ определяли парапротеин сыворотки крови и мочи методом иммунофиксации с типированием парапротеина, каппа и лямбда легкие цепи ИГ методом Freelite в сыворотке крови и их соотношение, а также уровень плазматических клеток костного мозга по данным миелограммы. Те же параметры, а также разницу между вовлеченной и не вовлеченной легкими цепями, оценивали на момент рестадирования заболевания. Поражение органов при AL-амилоидозе устанавливали на основании клинических симптомов, ассоциированных с отложением и токсическим действием амилоида на ткань вовлеченного органа, а также гистологической верификации амилоида [12]. Морфологические исследование почечной ткани, выполненное в лаборатории клинической иммунологии и морфологии НИИ нефрологии под руководством зав. к.м.н. В.Г. Сиповского, включало световую микроскопию, иммуноморфологические исследования и ультраструктурный анализ [13]. При световой микроскопии применяли следующие окраски: гематоксилин/эозин, ШИК-реакцию, серебрение по Джонсу, Конго-рот, трихромальную окраску по Массону, окраску на эластические волокна. Иммуноморфологические исследования – иммунофлюоресценцию (ИФ) или иммуногистохимию (ИГХ) из парафиновых блоков – выполняли с целью выявления в почечной паренхиме депозитов молекул моноклонального ИГ (панель антител к IgA, IgM, IgG, IgD, kappa, lambda, С3, С1q). В отдельных случаях иммуноморфологические методы были дополнены энзимным демаскированием антигенов.
Лечение и исходы. У всех включенных пациентов анализировали характер полихимиотерапии (ПХТ) и число выполненных курсов, а также факт проведения аутологичной трансплантации гемопоэтических стволовых клеток в сочетании с высокодозной химиотерапией (аутоТГСК). Гематологический ответ при AL-амилоидозе оценивали по критериям, предложенным Palladini и соавт. [14], а при других вариантах МГРЗ в зависимости от типа моноклонального белка [15]. Почечный ответ оценивали при анализе динамики рСКФ и СП до лечения и на момент конца наблюдения. Прогрессированием почечной дисфункции считали снижение рСКФ >25% от исходного значения или начало заместительной почечной терапии (ЗПТ). При нарастании рСКФ >25% или прекращении ЗПТ регистрировали улучшение функции почек. Остальные случаи расценивали как стабильную функцию почек. Снижение СП >30% от исходного значения при стабильной функции почек оценивали как ответ по протеинурии [16]. В остальных случаях констатировали отсутствие такового. В качестве комбинированной конечной точки почечного прогноза использовали начало ЗПТ или рСКФ <15 мл/мин/1,73м2 на момент конца наблюдения. Медиана наблюдения составила 12 (2; 22) мес.

 Статистический анализ. Полученные данные представлены в виде средних величин и стандартных отклонений (m±SD), медиан и интерквартильного размаха (М; 25–75%), а также частот (%). Для анализа различий между оцениваемыми параметрами в группах применялись критерий χ2, точный тест Фишера, критерий Манна–Уитни, t-критерий. Почечную выживаемость оценивали с помощью метода Каплана–Мейера. Статистическую значимость различий между кривыми выживаемости определяли с помощью Log-rank-теста. Дату летального исхода, наступившего при функционирующих почках, принимали за конец наблюдения, а случай учитывали как цензурированный. При значении p <0,05 различия считали достоверными.
Статистический анализ. Полученные данные представлены в виде средних величин и стандартных отклонений (m±SD), медиан и интерквартильного размаха (М; 25–75%), а также частот (%). Для анализа различий между оцениваемыми параметрами в группах применялись критерий χ2, точный тест Фишера, критерий Манна–Уитни, t-критерий. Почечную выживаемость оценивали с помощью метода Каплана–Мейера. Статистическую значимость различий между кривыми выживаемости определяли с помощью Log-rank-теста. Дату летального исхода, наступившего при функционирующих почках, принимали за конец наблюдения, а случай учитывали как цензурированный. При значении p <0,05 различия считали достоверными.
РЕЗУЛЬТАТЫ
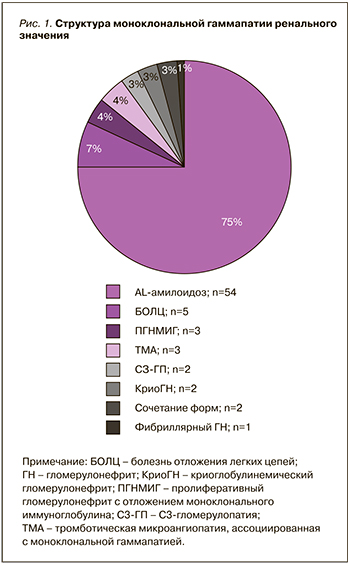
В анализ были включены 72 случая, соответствующие критериям МГРЗ. Распространенность МГРЗ составила 4,5% (от всего числа биопсий нативных почек, выполненных за указанный период времени в клинике). У 55 пациентов был диагностирован AL-амилоидоз. В 17 случаях диагностировали иной вариант МГРЗ, из них у трех больных поражение почек было ассоциировано с лимфоплазмоцитарной пролиферацией, соответствующей гематологическим критериям IgM-МГНЗ [7, 17]. Клинико-демографические параметры пациентов представлены в таблице. Спектр ренального поражения при МГРЗ отражен на рисунке 1.
Два случая МГРЗ были представлены сочетанием различных форм поражения почек: у одного пациента выявили AL-амилоидоз в сочетании с пролиферативным гломерулонефритом с отложением моноклонального ИГ, у второго пациента регистрировали болезнь отложения легких цепей в сочетании с проксимальной тубулопатией.
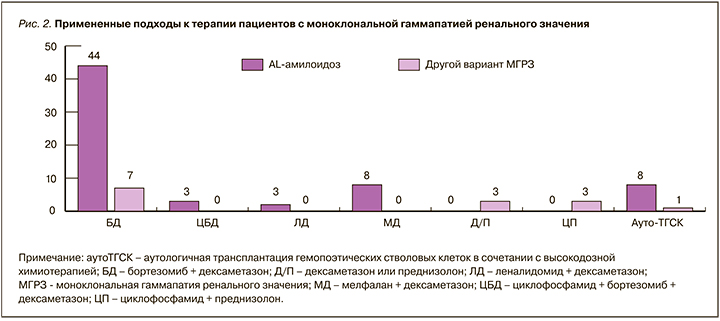
С целью лечения МГРЗ у большинства пациентов применяли различные схемы ПХТ, а также ауто-ТГСК (рис. 2). Один и тот же пациент мог получать последовательно несколько курсов клон-ориентированной терапии, а также разные схемы ПХТ. Два пациента с МГРЗ, ассоциированной с лимфоплазмоцитарной пролиферацией, получили курсы терапии ритуксимабом и преднизолоном, а один – курс бортезомиба с дексаметазоном в связи с непереносимостью анти-CD20 моноклонального антитела. В связи с выходом из-под наблюдения о терапии 8 пациентов не известно. В группе больных с AL-амилоидозом 4 пациента не получили лечения, так как умерли до его начала. Два случая неамилоидного варианта МГРЗ были оставлены под наблюдение из соображений риск осложнений/польза лечения, в одном из них спустя год наблюдения было выявлено прогрессирование МГ и развитие множественной миеломы.
 На фоне лечения гематологический ответ был получен у 60% больных, включая полный ответ в 38% случаях. Летальный исход зарегистрирован в 6 случаях, все пациенты с AL-амилоидозом.
На фоне лечения гематологический ответ был получен у 60% больных, включая полный ответ в 38% случаях. Летальный исход зарегистрирован в 6 случаях, все пациенты с AL-амилоидозом.
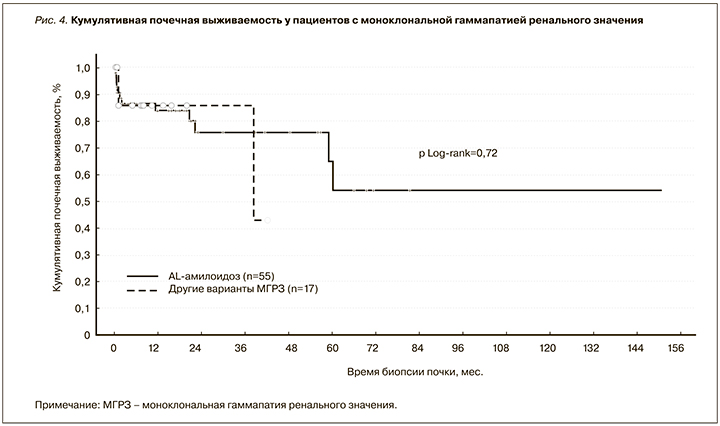
У пациентов с AL-амилоидозом ухудшение или улучшение/стабилизацию почечной функции регистрировали в 37 и 63% случаев соответственно. В остальных случаях МГРЗ наблюдали улучшение (20%) или стабилизацию почечной функции (80%). Ответ по протеинурии был зарегистрирован у 57% пациентов с AL-амилоидозом и у 50% больных с другими вариантами МГРЗ. Динамика суточной протеинурии в последней группе больных представлена на рисунке 3. Почечная выживаемость у пациентов с МГРЗ представлена на рисунке 4.
ОБСУЖДЕНИЕ
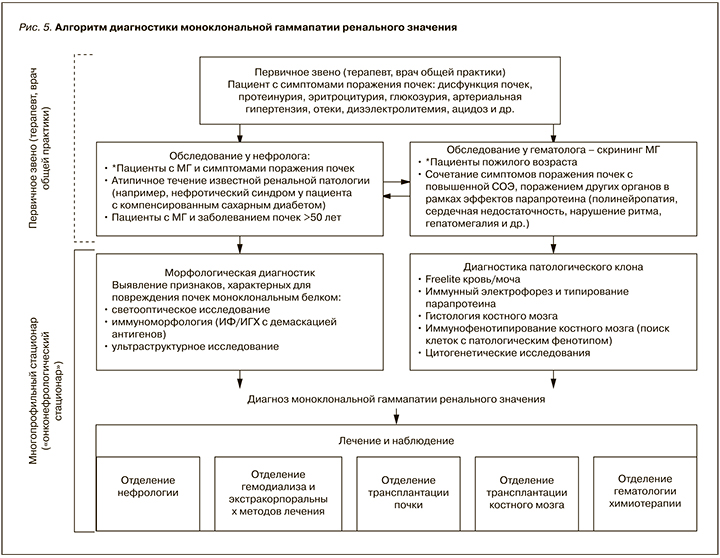
Данные, продемонстрированные как в нашем, так и других исследованиях [18–20], указывают на то, что МГРЗ не является ультраредкой патологией в практике нефролога и встречается примерно у каждого 20-го пациента, которому было выполнено морфологическое исследование почечной ткани в связи с выявлением того или иного нефрологического симптома. Принимая во внимание распространенность МГ, включая МГНЗ, особенно среди лиц пожилого возраста, истинная распространенность МГРЗ может быть несколько выше [21]. Низкая выявляемость этой патологии может быть обусловлена как недостаточной осведомленностью врачей-терапевтов первичного звена с этой новой для нефрологии и гематологии проблемой, так и ограничениями в проведении полноценных диагностических мероприятий, необходимых для верификации диагноза. МГРЗ – патология, находящаяся на стыке нефрологии и гематологии, требует междисциплинарного подхода к диагностике и соответствующих ресурсов (рис. 5), имеющихся, как правило, в распоряжении федеральных центров или крупных многопрофильных стационаров. В связи с крайней важностью проблемы поражения почек, ассоциированного с МГ, трудностью диагностики, необходимостью привлечения как гематолога, так и нефролога для ведения таких пациентов МГРЗ стала одной из областей интересов новой комбинированной подспециальности – онконефрологии и поводом для создания онконефрологических центров, что реализовано в некоторых странах за рубежом [22–25].
Морфологическая презентация МГРЗ крайне разнообразна [7, 26–28]. В изучаемой нами когорте больных в подавляющем большинстве случаев был диагностирован AL-амилоидоз почек, как и по данным других авторов [18, 20]. Однако почти в четверти случаев имели место иные морфологические паттерны болезни. Парапротеин, являясь молекулой ИГ или его частью (тяжелой и/или легкой цепью), может оказывать свое патологическое воздействие на паренхиму почек различными механизмами [7, 26]. Это объясняется особенностями строения и соответствующим изменением физико-химических свойств аномальной молекулы ИГ и особенностями ее взаимодействия с клеткой и местными факторами. Так, моноклональный ИГ может обладать токсическим действием на клетки, активировать иммунную систему, например систему комплемента, действовать наподобие антител по отношению к иным молекулам, взаимодействовать с мезангиальными и другими резидентными клетками почки и накапливаться в виде депозитов различной структуры, например в виде амилоидных фибрилл при AL-амилоидозе или аморфных масс при болезни отложения легких цепей. Клубочек является не единственной ренальной структурой, где моноклональный белок так или иначе реализует свое патологическое действие; последнее может осуществляться на уровне любого компартмента почечной паренхимы: канальцев, интерстиция, сосудов.
В связи с этим неудивительными являются и случаи сочетания различных вариантов поражения почек парапротеином, которые мы регистрировали у двух пациентов. Разнообразие взаимодействия моноклонального белка с ренальными структурами обусловливает как различные варианты морфологической, так и клинической презентации МГРЗ. Последняя может протекать в виде какого-либо симптома(ов) поражения почек – отеков, артериальной гипертензии, протеинурии и т.д. [28]. При этом у пациента отсутствуют симптомы, связанные с большой опухолевой массой, и больной с дебютом обсуждаемой патологии является первичным пациентом терапевта, врача общей практики, задачей которых является заподозрить возможную связь поражения почек с МГ и направить пациента для дальнейшего обследования к гематологу и нефрологу (см. рис. 5). Диагноз МГРЗ основан на подтверждении патогенетической связи изменений в паренхиме почек с моноклональным ИГ, в связи с чем очевидно, что неотъемлемым этапом диагностики является морфологическое исследование почечной ткани [7]. Последнее должно включать не только световую микроскопию, но и иммуноморфологическое исследование (ИФ/ИГХ), позволяющее выявить отложения моноклонального ИГ в структурах почки, а также ультраструктурный анализ, зачастую являющийся ключом к верификации таких типов МГРЗ, как фибриллярный и иммунотактоидный гломерулонефриты.
Несмотря на субклиническую ситуацию в отношении клона, МГРЗ нельзя считать доброкачественным состоянием, поскольку в патологический процесс вовлечены почки. Доказано, что при МГ именно ассоциированное поражение почек является одним из предикторов неблагоприятного прогноза [29–32]. Продолжающееся патологическое воздействие моноклонального ИГ на ренальную паренхиму неуклонно ведет к прогрессированию дисфункции органа и развитию терминальной стадии хронической болезни почек – известному предиктору сердечно-сосудистых заболеваний и смерти [33–36]. Безусловно, неблагоприятный почечный прогноз является одним из важных и неоспоримых аргументов в пользу клон-ориентированного лечения при МГРЗ. Показано, что пациенты с поражением почек, ассоциированным с МГ, не получившие своевременной специфической терапии, утратили функцию почек в 100% случаев [37]. Целью клон-ориентированного лечения, включающего курсы ПХТ, а также высокодозную химиотерапию с последующей ауто-ТГСК, является как гематологический, так и почечный ответы, которые были достигнуты у большинства исследуемых нами пациентов. При этом 5-летняя почечная выживаемость в исследуемой группе больных, большинство из которых получили лечение, составила всего 51% (см. рис. 4). Схожие данные по выживаемости были продемонстрированы и другими авторами [29, 30]. Вторым весомым аргументом, убеждающим в необходимости элиминации клона, является доказанный факт большей частоты прогрессии клона в злокачественный при наличии поражения почек [18]. Это подтверждает и наш опыт ведения пациента с МГРЗ, не получившего лечения, у которого спустя год была выявлена симптоматическая миелома.
ЗАКЛЮЧЕНИЕ
МГРЗ представляет собой патологию, ассоциированную с плохим почечным прогнозом и риском прогрессирования клона в злокачественную форму. В основе МГРЗ лежит поражение почек в результате воздействия нефротоксичного белка, продуцируемого клоном клетки В-клеточной линии дифференцировки, что требует междисциплинарного подхода в диагностике и ведении таких пациентов. Одной из целей данной статьи являлось ознакомление широкой аудитории врачей различных терапевтических специальностей с этой новой нозологией. Настороженность врачей первичного звена в отношении МГРЗ, нередкой причины поражения почек, особенно среди пациентов старшей возрастной группы, позволит эффективно выявлять данную патологию и своевременно инициировать клон-ориентированное лечение.


