С общебиологических позиций возможности адаптации к стрессу определяют возможности организма обеспечивать жизнедеятельность во всех ее проявлениях, включая когнитивный статус.
Одним из универсальных механизмов и причиной развития сосудистого когнитивного дефицита следует считать энергетический дефицит, в результате которого происходит нарушение работы мембранного ионного насоса, избыточное поступление в клетку кальция. Запускается активизация катаболических ферментов (киназы, кальмодулина, протеиназы, липазы), реактивных метаболитов кислорода, повреждается клеточная мембрана, развивается митохондриальная дисфункция. Реакции оксидативного стресса усиливают глутаматную эксайтотоксичность. На фоне нарушений энергозависимого транспорта ионов усугубляется глутаматкальциевый каскад. Таким образом, энергодефицит инициирует все три основных патологических механизма – глутаматную эксайтотоксичность, оксидантный стресс, апоптоз, которые потенцируют друг друга [1, 2].
Дефицит кислорода и глюкозы создает условия для формирования и/или прогрессирования как хронической ишемии головного мозга, так и нейродегенеративного процесса [3].
Таким образом, изучение особенностей развития энергетического дефицита с позиции патогенеза формирования сосудистого когнитивного снижения [4] является актуальной и современной задачей.
Целью исследования стало определение особенностей нейрофункциональной активности мозга и его адаптивных возможностей с позиции возрастного аспекта.
МАТЕРИАЛ И МЕТОДЫ
Для изучения особенностей нейрофункциональной активности мозга и его адаптивных возможностей с позиции возрастного аспекта проанализировано состояние уровня постоянных потенциалов (УПП), коррелирующего с состоянием резервного метаболизма в разных возрастных группах. С этой целью пациенты были разделены на две группы:
- 1-я группа – 29 пациентов с сосудистыми додементными когнитивными расстройствами (ДКР) в возрасте до 40 лет;
- 2-я группа – 35 пациентов с ДКР старше 50 лет.
Группу контроля составили 25 условно здоровых добровольца (средний возраст 41,8 ±10,1 лет).
Обследование включало изучение стандартного неврологического, эмоционально-личностного статуса, проведение нейропсихологического тестирования для определения когнитивного статуса. Возможности адаптации к стрессу изучались методом нейроэнергокартирования.
Нейроэнергокартирование (НЭК) представляет собой электрофизиологический метод, основанный на измерении уровня постоянных потенциалов (УПП) – сверхмедленных потенциалов головного мозга милливольтного диапазона, интегрально отражающего мембранные потенциалы гематоэнцефалитического барьера, глии, нейронов [5]. УПП коррелирует с состоянием кислотно-щелочного равновесия (КЩР) и показателями резервного анаэробного метаболизма головного мозга.
Исследования УПП достаточно давно проводятся как в нашей стране [6–8], так и за рубежом. В отечественной литературе такие потенциалы часто описывают как сверхмедленную электрическую активность головного мозга [9, 10], квазиустойчивую разность потенциалов, омега-потенциалы [11]. Иногда проводят параллель между УПП и постоянными составляющими (поздними компонентами) вызванных потенциалов [12]. В некоторых современных ЭЭГ-системах (Full-Band EEG) в настоящее время существуют каналы для регистрации сверхмедленной электрической активности головного мозга – по существу тех же УПП. За рубежом УПП получили название direct current potentals (DC-potentials) – потенциалы постоянного тока [13–15].
В практической медицине исследования УПП проводятся при изучении сосудистой патологии головного мозга, болезни Альцгеймера [16], паркинсонизме, депрессии, токсикоманиях, нарушениях сна, в геронтологии [17], спортивной медицине [18] и др.
Целесообразность исследования УПП мозга при додементных когнитивных расстройствах обусловлена рядом имеющихся публикаций о связи состояния энергетической активности мозга и способности к обучению [19], когнитивной деятельности.
Метод регистрации УПП был рекомендован к применению в методическом письме Минздравсоцразвития России от 06.02.2006 № 504-РХ «Организация специализированной нейрореабилитационной помощи больным с очаговыми поражениями головного мозга в результате инсульта, ЧМТ и других заболеваний центральной нервной системы».
После регистрации фонового метаболизма при НЭК проводят афферентные пробы: 3-минутную гипервентиляцию (модель физического стресса) и тест быстрой словесности (ТБСЛ) или «тест опосредованных литеральных ассоциаций» (модель эмоционального стресса). По показаниям прибора выделяли адекватную реакцию метаболизма, ригидную реакцию (отсутствие изменений УПП), извращенную реакцию (снижение УПП ниже фонового), чрезмерную реакцию. Адекватной считается реакция, когда УПП при гипервентиляции повышается в 1,5–1,9, а при ТБС в 1,4–2,0 раза.
После выполнения гипервентиляционной пробы оценивается степень восстановления УПП в постгипервентиляционном периоде (ПГВП) как проявление возможности организма восстанавливать гомеостаз. Выделяют адекватную реакцию (восстановление к исходному, фоновому уровню), чрезмерную реакцию (снижение уровня метаболизма ниже фонового), ригидную реакцию (нет восстановления УПП в ПГВП) и извращенную реакцию, когда УПП в ПГВП не снижается, а нарастает.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
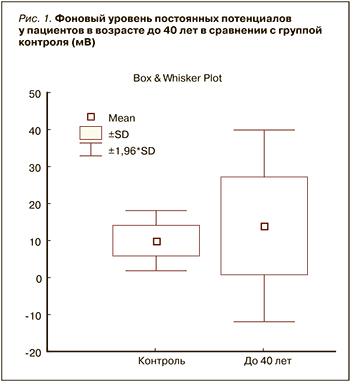 Как видно из приведенной диаграммы (рис. 1), фоновые показатели УПП у пациентов в возрасте до 40 лет широко варьируют. Встречаются как пониженные показатели УПП (в сравнении с группой контроля), так и повышенные. Такое разнообразие показателей метаболизма делает необходимым более дифференцированный подход к терапии. В некоторых случаях необходимо стимулировать метаболизм, а в некоторых, наоборот, снижать. Но, учитывая сложность определения состояния метаболизма в каждом клиническом случае, возможно, для пациентов с ДКР молодого возраста целесообразно активно не вмешиваться в регулирование метаболических процессов, ограничившись назначением антиоксидантов.
Как видно из приведенной диаграммы (рис. 1), фоновые показатели УПП у пациентов в возрасте до 40 лет широко варьируют. Встречаются как пониженные показатели УПП (в сравнении с группой контроля), так и повышенные. Такое разнообразие показателей метаболизма делает необходимым более дифференцированный подход к терапии. В некоторых случаях необходимо стимулировать метаболизм, а в некоторых, наоборот, снижать. Но, учитывая сложность определения состояния метаболизма в каждом клиническом случае, возможно, для пациентов с ДКР молодого возраста целесообразно активно не вмешиваться в регулирование метаболических процессов, ограничившись назначением антиоксидантов.
Кроме того, следует обратить внимание на то, что данные усредненного метаболизма у пациентов более молодого возраста (до 40 лет) отличаются от показателей в контрольной группе не достоверно (р=0,07).
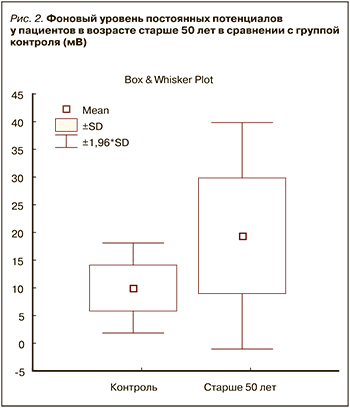 На рисунке 2 представлены данные о резервном метаболизме (УПП) у пациентов с ДКР в возрасте старше 50 лет. Он наглядно демонстрирует, что у пациентов старшей возрастной группы фоновый резервный метаболизм однозначно повышен в сравнении с контрольной группой, и эти различия достоверны (р <0,001). Эти данные свидетельствуют, что основной путь аэробного катаболизма глюкозы у пациентов старшего возраста недостаточен, и организм использует резервные пути – усиление анаэробного гликолиза, катаболизма кетоновых тел и аминокислот. В этой ситуации дополнительно медикаментозно стимулировать напряженный метаболизм нецелесообразно.
На рисунке 2 представлены данные о резервном метаболизме (УПП) у пациентов с ДКР в возрасте старше 50 лет. Он наглядно демонстрирует, что у пациентов старшей возрастной группы фоновый резервный метаболизм однозначно повышен в сравнении с контрольной группой, и эти различия достоверны (р <0,001). Эти данные свидетельствуют, что основной путь аэробного катаболизма глюкозы у пациентов старшего возраста недостаточен, и организм использует резервные пути – усиление анаэробного гликолиза, катаболизма кетоновых тел и аминокислот. В этой ситуации дополнительно медикаментозно стимулировать напряженный метаболизм нецелесообразно.
Сопоставление показателей метаболизма мозга у пациентов разных возрастных групп и в группе контроля на фоне функциональных проб (физической и эмоциональной нагрузки) приведено в таблице 1. Из нее видно, что у пациентов старшего возраста, в сравнении с контрольной группой условно здоровых пациентов, достоверно отличались показатели фонового метаболизма (р <0,005), а также метаболизм в гипервентиляционный (р <0,05) и в постгипервентиляционный периоды (р <0,05). У пациентов же до 40 лет большинство показателей метаболизма на фоне функциональных проб достоверно не отличалось от контрольной группы (р >0,05).

На основании этих результатов можно сделать вывод, что у пациентов старшей возрастной группы ухудшаются возможности адаптации в обеспечении жизнедеятельности (при физической нагрузке – гипервентиляции) и при поддержании гомеостаза (восстановление метаболизма в постгипервентиляционном периоде). При этом в ответ на эмоциональный стресс метаболизм у пациентов старше 50 лет меняется практически так же, как у здоровых испытуемых из группы контроля (отличия показателей недостоверны; р=0,22, р>0,05). Можно предположить, что пациенты старше 50 лет более «закалены» и тренированы к эмоциональным стрессам, чем к физическим.
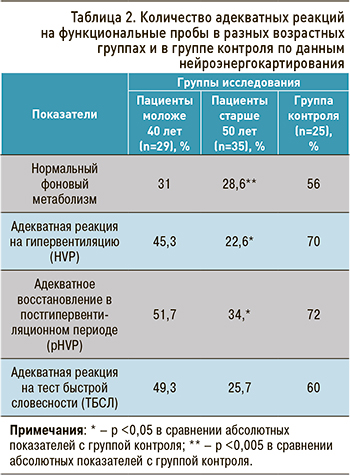
У пациентов старшей возрастной группы (вторая группа) значительно реже определялась адекватная реакция на гипервентиляцию – лишь в 22,6% случаев; у более молодых пациентов ( 1-я группа) она наблюдалась вдвое чаще (в 45,3% случаев). У пациентов 2-й группы чаще определялась извращенная реакция (22,9%), когда вместо должного усиления нейрометаболизма в ответ на гипервентиляцию происходило его уменьшение. У пациентов до 40 лет такая неадекватная реакция была зарегистрирована только в 3,5% случаев.
Однако неадекватная чрезмерная реакция, когда в ответ на гипервентиляцию метаболизм повышался более чем в 1,9 раза, чаще определялась в 1-й группе (24,1%), чем во 2-й (17,1%). В группе контроля адекватная реакция определялась в 70%, ригидная – в 5%, чрезмерная – в 25%.
Таким образом, наиболее выраженные нарушения адаптации к гипервентиляции определены у пациентов старше 50 лет (вторая группа). У них чаще определялись такие неадекватные реакции, как ригидность и извращенная реактивность, когда вместо должного усиления метаболизма на фоне физического стресса регистрировалось его понижение.
Адекватное восстановление нейрометаболизма после стресса – проявление способности организма сохранять свой гомеостаз. Как показали результаты исследования, полное восстановление УПП наблюдалось лишь в 34,3% случаев в группе пациентов старше 50 лет и в 51,7% случаев среди пациентов моложе 40 лет.
Отсутствие восстановления УПП (ригидность реакции) также чаще выявлялось у пациентов 2-й группы – в 31,4% случаев (против 13,8% в группе моложе 40 лет). Дальнейшее нарастание УПП в постгипервентиляционном периоде – ПГВП (извращенная реакция восстановления), напротив, несколько чаще имело место в 1-й группе – 34,5% (против 25,7% в группе старше 50 лет).
Еще один вид неадекватной реакции восстановления – чрезмерная реакция, когда уровень метаболизма в постгипервентиляционном периоде опускался ниже фонового, определялся в группе пациентов с ДКР старше 50 лет (в 8,6%). Таким образом, нарушение возможностей адаптации в поддержании гомеостаза определяется чаще у пациентов старшей возрастной группы (в 65,7 %). Именно в этой группе чаще наблюдались неадекватные ригидная и чрезмерная реакции восстановления метаболизма в постгипервентиляционном периоде.
Адекватная реакция на эмоциональный стресс была зафиксирована в 49,3% случаев у пациентов до 40 лет и в 25,7% у пациентов 2-й группы (старше 50 лет). В контрольной группе она была зарегистрирована в 60% случаев.
 Все это свидетельствует о том, что у пациентов старшего возраста (старше 50 лет) чаще происходят неадекватные реакции (чрезмерная реакция, ригидность реакции) на эмоциональный когнитивный стресс, чем у пациентов младше 40 лет. Одновременно с этим во 2-й группе определялось уменьшение общего количества адекватных реакций на когнитивный (эмоциональный) стресс.
Все это свидетельствует о том, что у пациентов старшего возраста (старше 50 лет) чаще происходят неадекватные реакции (чрезмерная реакция, ригидность реакции) на эмоциональный когнитивный стресс, чем у пациентов младше 40 лет. Одновременно с этим во 2-й группе определялось уменьшение общего количества адекватных реакций на когнитивный (эмоциональный) стресс.
Данные о количестве адекватных реакций на гипервентиляцию, тест быстрой словесности (ТБСЛ – модель эмоционального, когнитивного стресса) и адекватное восстановление в постгипервентиляционном периоде в разных возрастных группах и в группе контроле приведены в таблице 2.
ЗАКЛЮЧЕНИЕ
Сохранение когнитивных способностей с возрастом очень актуально для человека и важно для поддержания определенного уровня качества жизни. Существует мнение, что с возрастом когнитивные возможности снижаются. В неврологии имеет место такой клинический синдром, как доброкачественная старческая забывчивость (возрастное нарушение памяти или возрастная когнитивная дисфункция), который определяет даже не болезнь, а естественное снижение когнитивных возможностей. Он проявляется в большей степени снижением внимания и скорости психических процессов; в меньшей степени снижается память, причем в основном страдает процесс воспроизведения информации, а не узнавание.
Одной из главных функций организма является способность к адаптации. Именно эта способность быстро перестраиваться, гибко приспосабливаться к изменяющимся обстоятельствам страдает с возрастом. Пожилому человеку труднее переносить быструю смену часовых поясов, атмосферных факторов, изменения в жизненных стереотипах и ценностях, труднее быстро усваивать новую информацию, перестраивать собственные взгляды и мнения.
Состояние резервного метаболизма у пациентов с ДКР меняется с возрастом. У пациентов в старшей возрастной группе отмечается более выраженное напряжение метаболизма, использование резервного его пути.
В основе многих заболеваний, в том числе и возрастной когнитивной дисфункции, лежит нарушение адаптации в поддержании гомеостаза и обеспечении деятельности. Проведенные исследования доказывают ухудшения адаптации к стрессу (физическому и эмоциональному) у пациентов старшего возраста. Кроме того, у пациентов с возрастом нарастают нарушения адаптации в поддержании внутреннего гомеостаза. Такие больные наиболее метеолабильны, их работоспособность более зависима от внешних атмосферных, климатических факторов.
Таким образом, медицинские и реабилитационные мероприятия должны быть направлены на повышение адаптивных возможностей пожилых пациентов любыми доступными средствами.


