Депрессия – одна из ведущих проблем не только в психиатрической, но и общемедицинской клинической практике. Согласно представленным в литературе данным, среди пациентов, обращающихся за медицинской помощью по различным причинам, у 10% имеются проявления депрессии, а у больных с диагностированной соматической патологией (сердечно-сосудистые заболевания, диабет) ее частота превышает таковую для популяции более чем в 3 раза [1, 2].
Наличие депрессии негативно влияет на течение и исход соматических заболеваний, а сопутствующая соматическая патология, в свою очередь, отрицательно сказывается на течении депрессии [3, 4, 5]. Использование антидепрессантов в терапии депрессивного расстройства у пациентов с коморбидными соматическими заболеваниями зарекомендовало себя эффективным, что было подтверждено надежной доказательной базой [6, 7]. По данным исследований, общие принципы терапии в таких случаях кардинально не отличаются от таковых при лечении депрессии без сопутствующей соматической патологии. Так, оптимальный антидепрессивный эффект препаратов достигался через 4–5 нед от начала терапии и при их регулярном приеме сохранялся более нескольких месяцев [7].
В то же время как психиатры, так и специалисты других медицинских направлений регулярно сталкиваются с проблемой оптимального подбора антидепрессивной терапии у пациентов с коморбидной психической и соматической патологией. Это обусловлено и сложностью сочетания различных групп антидепрессантов с препаратами соматической практики, и потенциальными нежелательными побочными эффектами антидепрессивной терапии, которые могут усугубить имеющиеся соматические нарушения.
К сожалению, информация о тактике терапии депрессии у пациентов с теми или иными соматическими заболеваниями практически не представлена в практических гайдлайнах и основана преимущественно на результатах исследований в общей популяции.
В связи с этим цель нашего обзора – рассмотреть особенности терапии депрессии при различных вариантах соматических заболеваний, уделив основное внимание вопросам безопасности подбора антидепрессантов в подобных случаях.
ТЕРАПИЯ ДЕПРЕССИИ У ПАЦИЕНТОВ С СЕРДЕЧНО-СОСУДИСТЫМИ ЗАБОЛЕВАНИЯМИ
Сердечно-сосудистые заболевания (ССЗ) остаются одной из основных причин инвалидизации и смертности [8]. При этом данные исследований показали, что у пациентов с депрессией риск ССЗ возрастал в 2–4 раза, а наличие депрессивной симптоматики у пациентов с ишемической болезнью сердца (ИБС) и хронической сердечной недостаточностью (ХСН) в разы повышало риск смертельного исхода [9].
В связи с этим лечение депрессии у пациентов с ССЗ может потенциально способствовать снижению риска негативного исхода, влияя как на физиологические (воспалительный компонент, вегетососудистые нарушения), так и вторичные (курение, употребление психоактивных веществ) факторы. Потенциально положительными эффектами антидепрессантов у пациентов с ССЗ являются влияние на реактивность тромбоцитов, вариабельность сердечного ритма и стабилизации показателей липидного спектра [9, 10]. Вместе с тем существует ряд ограничений, которые необходимо учитывать при лечении депрессии у пациентов с сердечно-сосудистой патологией.
Ограничения, связанные с побочными эффектами антидепрессантов
Применение антидепрессантов первых поколений (в частности, из групп трициклических антидепрессантов и ингибиторов моноаминоксидазы) чаще связано с нежелательными лекарственными взаимодействиями при ССЗ [9].
У пациентов с гипертонической болезнью следует избегать назначения ингибиторов моноаминоксидазы (иМАО) ввиду их способности повышать показатели артериального давления (АД) и возможности провокации гипертонического криза. Данные о развитии клинической гипертензии на фоне приема групп трициклических антидепрессантов (ТЦА) достаточно противоречивы и, как правило, не рассматриваются как противопоказание для их использования. В таких случаях более уместно регулярное мониторирование АД и коррекция антигипертензивной или антидепрессивной терапии при необходимости.
Развитие гипертензии на фоне использования селективных ингибиторов обратного захвата серотонина (СИОЗС) происходит достаточно редко и варьирует в области 1–2% [11]. Влияние селективных ингибиторов обратного захвата серотонина и норадреналина (СИОЗСиН) на показатели АД более вариабельно и дозозависимо. Случаи гипертонических кризов отмечались у <1% пациентов, принимавших дулоксетин [11]. Наиболее выраженное повышение показателей АД наблюдалось на фоне применения венлафаксина в дозах свыше 200 мг/сут. В связи с этим титрацию СИОЗиН у пациентов с риском ССЗ целесообразно начинать с минимальных доз и тщательно контролировать АД в процессе лечения.
Назначения ТЦА следует избегать у пациентов с ИБС, особенно в периодах острой коронарной патологии [12]. На основании крупных рандомизированных клинических исследований в 2008 г. AHA Depression и Coronary Heart Disease Science Advisory рекомендовали в качестве препаратов первого выбора для таких пациентов сертралин и циталопрам [12]. При этом последние исследования в большей степени поддерживают использование сертралина, так как он связан с меньшим риском увеличения интервала QT и желудочковых аритмий.
У СИОЗС, с одной стороны, отмечается целый ряд положительных эффектов в отношении коронарных нарушений: восстановление сердечного ритма, снижение воспалительной активности, улучшение эндотелиальной функции и снижение агрегации тромбоцитов [13]. С другой стороны, миртазапин и пароксетин не следует использовать у пациентов с ИБС и сопутствующим ожирением. Также миртазапин не показан при неконтролируемой гипертензии и в сочетании с клонидином [9].
Исследования использования антидепрессантов у пациентов с ХСН показали, что в большинстве случаев польза от такой терапии превышала возможные риски [14]. Препаратами первого выбора зарекомендовали себя СИОЗС, в то время как прием ТЦА чаще был сопряжен с нежелательными побочными эффектами. В то же время в ряде работ указывается, что при грамотной титрации доз ТЦА и мониторинге общего состояния положительный эффект от терапии депрессии перекрывает отдельные нежелательные явления [9].
Для пациентов с высоким риском развития желудочковой эктопической активности, особенно при наличии врожденного пролонгированного интервала QT, целесообразно избегать назначения антидепрессантов с потенциальным влиянием на этот показатель (ТЦА; СИЗОЗС – циталопрам, эсциталопрам, флуоксетин, пароксетин, сертралин; миртазапин, тразадон, венлафаксин) [15]. В то же время, согласно результатам исследований, при умеренном риске развития аритмии СИОЗС могут использоваться с осторожностью. У пациентов после острого коронарного приступа эсциталопрам, флуоксетин и сертралин не оказывали выраженного эффекта на интервал QT [15]. По данным литературы, наибольшая осторожность в таких случаях нужна при использовании циталопрама и эсциталопрама, особенно у пожилых пациентов, тогда как прием других СИОЗС был сопряжен с меньшим проаритмогенным риском [16].
Использования ТЦА также следует избегать при риске развития блока проводимости: в данном случае предпочтительнее СИОЗС, которые редко провоцируют брадикардию [9].
Ограничения, связанные с лекарственными взаимодействиями
Основные общие сведения о потенциальных нежелательных взаимодействиях антидепрессантов новых поколений и кардиотропных препаратов представлены в таблице 1.
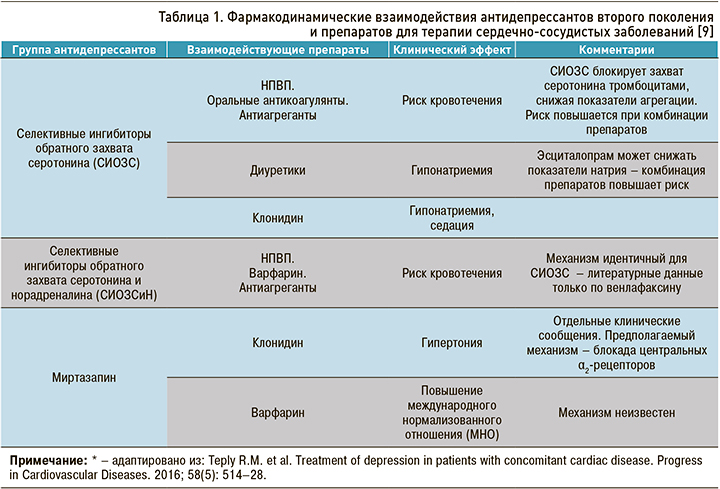
Пациенты с ССЗ, в терапии которых используется варфарин (антикоагулянт непрямого действия), имеют ряд ограничений по применению антидепрессантов. Клинически значимое усиление антикоагуляционного эффекта и повышение риска кровотечения отмечены для сочетаний флуоксетина и флувоксамина (ингибиторы CYP2C9) с варфарином [17]. Согласно данным крупного исследования стационарных пациентов, получавших терапию варфарином, использование у них миртазапина было связано с более низким риском кровотечения, чем прием СИОЗС [18].
В 2009 г. FDA сообщило, что клопидогрел (ингибитор агрегации тромбоцитов) не следует комбинировать с различными ингибиторами CYP2C19, включая флуоксетин и флувоксамин [19]. Это связано со снижением антитромбоциторной активности клопидогрела при сочетании с указанными препаратами.
Таким образом, способность СИОЗС снижать активность тромбоцитов и желудочную кислотность повышает риск желудочно-кишечных кровотечений [13]. Особенно это актуально для пациентов с кровотечением в анамнезе и/или сопутствующей антиагрегационной, антикоагуляционной терапией. Возможными тактиками при повышенном риске желудочно-кишечных кровотечений могут быть снижение доз антидепрессанта; добавление к терапии ингибиторов протонной помпы; замена антидепрессанта на препарат с меньшим риском кровотечения (например, на миртазапин) [20].
Сочетания флуоксетина с бета-адреноблокаторами метопрололом и пропранололом (субстраты CYP2D6) ведет к выраженной брадикардии и нарушениям проводимости [21]. Есть отдельные сообщения о случаях отеков, тошноты и гиперемии кожных покровов при единовременном назначении флуоксетина с блокаторами кальциевых каналов верапамилом и нифедипином, которые, вероятнее всего, связаны с ингибированием флуоксетином CYP3A4 [22].
ТЕРАПИЯ ДЕПРЕССИИ У ПАЦИЕНТОВ С МЕТАБОЛИЧЕСКИМИ НАРУШЕНИЯМИ
В настоящее время диабет является глобальной проблемой: распространенность заболевания в популяции превышает 400 млн человек [23]. Частота депрессии у таких пациентов варьирует от 10 до 15%, что в два раза превышает аналогичные показатели для общей популяции [23].
Ключевой вопрос использования антидепрессантов у пациентов с метаболическими нарушениями – влияние этих препаратов на массу тела и показатели глюкозы крови. При этом если о влиянии ряда антидепрессантов (ТЦА, миртазапина) на прибавку массы тела имеются достоверные сведения [24], то данные о риске развития диабета в связи с терапией антидепрессантами значительно более вариабельны. Так, метаанализ Yoon J.M. et al. выявил повышенную вероятность развития диабета у пациентов, получавших терапию антидепрессантами вне зависимости от использованной группы препаратов (ТЦА, СИОЗС), однако авторы допускают, что фактором риска нарушений метаболизма глюкозы могло быть не лечение, а собственно депрессия [25].
Результаты ряда исследований связывают использование циталопрама с улучшением метаболизма глюкозы и снижением веса, что, в свою очередь, ведет к лучшему гликемическому контролю [26]. При этом канадское исследование по влиянию циталопрама на показатели HbA1c в сравнении с амитриптилином, венлафаксином, тразадоном и эсциталопрамом не выявило для последних большей эффективности [27]. В то же время авторы отмечают, что, несмотря на отсутствие статистической значимости, для тразадона и эсциталопрама были получены данные о клинически более выраженном снижении показателей глюкозы в сравнении с циталопрамом.
Исследования по применению антидепрессантов при коморбидных случаях диабета и депрессии показали, что наиболее выраженное ухудшение контроля уровня глюкозы было связано с приемом нортриптилина (ТЦА), в то время как наиболее значимые положительные результаты были характерны для флуоксетина и сертралина (СИОЗС) [28].
Отдельное внимание в литературе уделено проблеме нарушений метаболизма глюкозы у пациентов с сочетанным применением правастатина и пароксетина [29]. По информации FDA, указанные препараты чрезвычайно часто используются в клинической практике, что способствует распространению этого лекарственного сочетания [30]. Анализ медицинской документации 2388 пациентов, получавших терапию данной комбинацией препаратов, показал, что сахарный диабет был основной проблемой указанной выборки как на определенных сроках терапии (от 36 до 43 дней), так и в анамнезе в целом [29]. В то же время некоторые исследования сообщают, что риск сахарного диабета 2 типа у пациентов, принимавших комбинированную терапию правастатином и пароксетином, не отличался от такового в случае раздельного применения этих препаратов [31].
Еще одна распространенная проблема у пациентов с диабетом, которую может усугублять антидепрессивная терапия, – это сексуальные дисфункции ввиду поражения сосудов и автономной нервной системы. Зарубежные авторы рекомендуют в таких случаях использовать в качестве терапии первого выбора бупропион [32]. Для сочетанной терапии диабетической невропатии и депрессии предлагается применение СИОЗСиН (венлафаксин, дулоксетин) [32].
ТЕРАПИЯ ДЕПРЕССИИ У ПАЦИЕНТОВ С ЗАБОЛЕВАНИЯМИ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА
Депрессия встречается при самых разнообразных вариантах заболеваний желудочно-кишечного тракта (ЖКТ) – от функциональных нарушений до тяжелой воспалительной и онкологической патологии [33].
Антидепрессанты, в особенности группы ТЦА, рассматриваются как препараты первой линии при терапии тяжелых и рефракторных случаев функциональных заболеваний ЖКТ, что во многом обусловлено их анальгетическим эффектом [34]. При этом данный эффект отмечен даже для небольших доз ТЦА и у пациентов без сопутствующей депрессивной симптоматики.
Для терапии пациентов, у которых функциональные нарушения ЖКТ сочетаются с выраженной тревогой, паническими эпизодами и обсессиями, рекомендовано использование терапевтических доз СИОЗС, несмотря на меньшую выраженность их анальгетического эффекта [34]. У пациентов с преобладанием нарушений ЖКТ в виде диареи может быть эффективным использованием препаратов с наибольшей выраженностью антихолинергических эффектов (малые дозы ТЦА, пароксетин) [34].
ТЕРАПИЯ ДЕПРЕССИИ У ПАЦИЕНТОВ С ОНКОЛОГИЧЕСКИМИ ЗАБОЛЕВАНИЯМИ
Частота депрессии у пациентов с онкологическими заболеваниями, по данным исследований, достигает 15%, а с учетом дистимии и отдельных проявлений депрессивной симптоматики превышает 25% [35]. Следует подчеркнуть, что депрессия была отнесена к независимым факторам повышения риска смертности при раке (на 26% – для отдельных симптомов; на 36% – для клинического диагноза депрессивного расстройства) [35].
Столь выраженное влияние даже легкой депрессивной симптоматики на прогноз онкологических заболеваний делает крайне актуальным вопрос подбора антидепрессивной терапии в этой группе пациентов. В настоящее время частота использования у пациентов с онкологическими заболеваниями ТЦА значительно снизилась во многом из-за того, что нежелательные побочные эффекты этих препаратов у таких больных могут быть крайней негативны и опасны [36]. Так, усугубление сухости слизистых оболочек неприемлемо для пациентов с мукозитом из-за проводимой химиотерапии, снижение перистальтики опасно в сочетании с опиоидными анальгетиками, а на фоне соматической слабости чаще могут отмечаться проявления спутанности.
Использование СИОЗС и СИОЗиН, напротив, имеет тенденцию к возрастанию, однако и при их назначении необходимо учитывать риск ряда нежелательных эффектов, в частности, желудочно-кишечных кровотечений, судорог, гипонатриемии и агранулоцитоза [36].
Примечательно, что ряд побочных эффектов антидепрессивной терапии в случаях ее назначения при онкологических заболеваниях может положительно влиять на состояние пациентов. Например, седативный эффект в сочетании с анальгетическими свойствами ряда антидепрессантов может значимо улучшить качество жизни у пациентов с болевым синдромом [37]. Сообщается, что анальгезирующий эффект выявлен как у ТЦА (в малых дозах), так и у СИОЗСиН (в терапевтических дозах: венлафаксин 75–150 мг; дулоксетин 60–120 мг). Таким образом, СИОЗСиН могут единовременно оказывать анальгетическое действие и в то же время эффективно влиять на депрессивную симптоматику.
Тамоксифен и ингибиторы ароматазы, используемые в терапии рака груди, часто могут быть сопряжены с ощущением «приливов», которые, в свою очередь, сопровождаются тревогой, депрессией и нарушениями сна [38]. СИОЗС и СИОЗСиН показали эффективность в терапии подобных состояний, однако имеются сведения, что сочетанное использование ряда антидепрессантов (пароксетин, сертралин, велафаксин) вело к снижению положительного эффекта от применения тамоксифена [38].
Другой распространенной и достаточно трудно курабельной проблемой у онкологических пациентов является кожный паранеопластический зуд. СИОЗС (сертралин, пароксетин, флуоксетин) и миртазапин в ряде клинических исследований снижали интенсивность его проявлений [36].
Анорексия, часто встречающаяся у пациентов онкологической практики, также подвергается терапевтическому воздействию антидепрессивными препаратами. Так, миртазапин и малые дозы оланзапина способствовали улучшению аппетита, прибавке массы тела. В то же время миртазапин следует использовать с осторожностью при наличии риска судорожных припадков и нарушениях лейкоцитарной формулы крови [36].
Отдельная трудность при курации онкологических пациентов с депрессией состоит в том, что они, как правило, получают массивную терапию по поводу основного заболевания. При этом ряд препаратов в лечении онкологических заболеваний имеет депрессогенный эффект (интерферон, стероиды), а сочетание такой терапии с антидепрессантами ведет к повышенному риску развития ряда побочных эффектов, в частности серотонинового синдрома [36]. В связи со всеми вышеуказанными факторами назначение антидепрессантов должно начинаться у таких пациентов с минимальных доз с их медленной последующей титрацией и тщательным мониторингом общего состояния и сопутствующих терапевтических назначений.
Общие сведения о применении антидепрессантов различных групп у онкологических пациентов представлены в таблице 2.

ЗАКЛЮЧЕНИЕ
Таким образом, в большинстве случаев антидепрессивная терапия у пациентов с коморбидными соматическими заболеваниями – необходимое условие и эффективная мера стабилизации как психического, так и соматического состояния и улучшения общего прогноза. В то же время перед началом лечения каждый случай должен оцениваться лечащим врачом индивидуально с учетом всех аспектов, которые могут повлиять на качество терапии и состояние пациента. Необходимо уделять тщательное внимание потенциальным побочным эффектам препаратов, спектру их безопасности, возможным взаимодействиям с сопутствующей терапией и соотношению «риск–польза» в отношении наиболее уязвимых систем организма. Лишь при таком индивидуализированном подходе пациентам может быть оказана оптимальная и наиболее качественная медицинская помощь, затрагивающая все аспекты представленных нарушений.


