Остеоартрит (ОА) представляет собой возраст-зависимое заболевание, которое является главной причиной боли, инвалидности, сокращения сроков трудовой жизни взрослых во многих странах, снижения качества жизни и необходимости эндопротезирования в исходе заболевания [1]. Всё это определяет высокую клиническую и социально-экономическую значимость ОА.
Наиболее частая локализация ОА – коленные суставы: распространенность этой формы заболевания увеличивается с возрастом и достигает 25% в популяции старше 50 лет. Кроме того, ОА коленных суставов характеризуется самой высокой частотой развития болевого синдрома [2], а наличие классификационных и диагностических критериев позволяет считать эту разновидность заболевания хорошей моделью для создания клинических рекомендаций.
Действительно, за последние 10 лет опубликовано множество рекомендаций по ведению ОА, разработанных обществами врачей различных специальностей в разных странах мира (рис. 1). Однако, несмотря на их большое количество, лечение больных до сих пор остается сложным вопросом, поскольку гайдлайны часто содержат противоречивые данные. Одно из объяснений этого заключается в том, что в настоящее время ОА рассматривается не как единая болезнь, а как синдром, включающий различные фенотипы заболевания, например метаболический, возрастной, генетический, травматический и др. Это отражено во всех метаанализах и обзорах, на основе которых создаются рекомендации по лечению ОА, где подчеркивается высокая гетерогенность популяции больных, включенных в исследования, что само по себе может влиять на эффективность медикаментозной терапии.
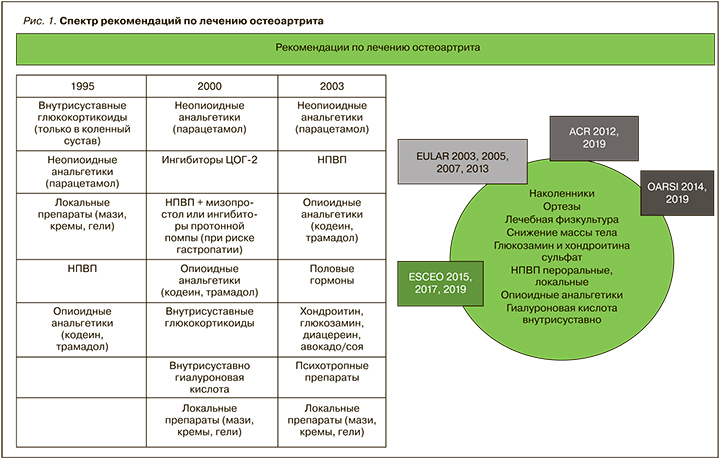
Другое возможное объяснение – проблема коморбидности, уровень которой при ОА выше по сравнению с другими ревматическими заболеваниями. Более того, сама коморбидность повышает риск развития ОА и появления хронической боли. Большое когортное исследование показало ассоциацию ОА с повышенным риском смерти [3], в связи с чем Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) в 2018 г. признало ОА серьезным заболеванием, указав на необходимость тщательного наблюдения за больными и более раннего назначения лечения.
Лечение ОА всегда комплексное: в первую очередь оно направлено на улучшение качества жизни пациентов вследствие уменьшения боли, улучшения функции суставов, замедления прогрессирования болезни и включает одновременное применение нефармакологических и фармакологических методов.
Как правило, рекомендации создаются для тех локализаций поражения, которые выделяют сообразно классификационным критериям: коленные, тазобедренные и мелкие суставы кистей. Изменения наших представлений о патогенезе ОА, осознание гетерогенности этой болезни, ее высокий коморбидный фон привели к необходимости создания дифференцированного подхода к лечению.
Первую такую попытку осуществило Американское общество по изучению ОА (Osteoarthritis Research Society International; OARSI), рекомендации которой учитывали локализацию ОА и наличие сопутствующих заболеваний [4]. Эти рекомендации вызвали широкое обсуждение, особенно в части применения нестероидных противовоспалительных препаратов (НПВП). В 2019 г. OARSI [5] предложило обновленные рекомендации для трех локализаций ОА (коленные, тазобедренные суставы и генерализованная форма ОА), в которых учитывались сопутствующие сердечно-сосудистые, желудочно-кишечные заболевания, наличие немощности, депрессии и распространенной боли. В таблице 1 представлены рекомендации по лечению ОА коленных суставов, из которых видно, что основными лекарственными препаратами для лечения этой формы заболевания по-прежнему остаются НПВП; в некоторых случаях с условной силой доказательства (по системе GRADE) рекомендуется внутрисуставное введение гормонов или препаратов гиалуроновой кислоты.
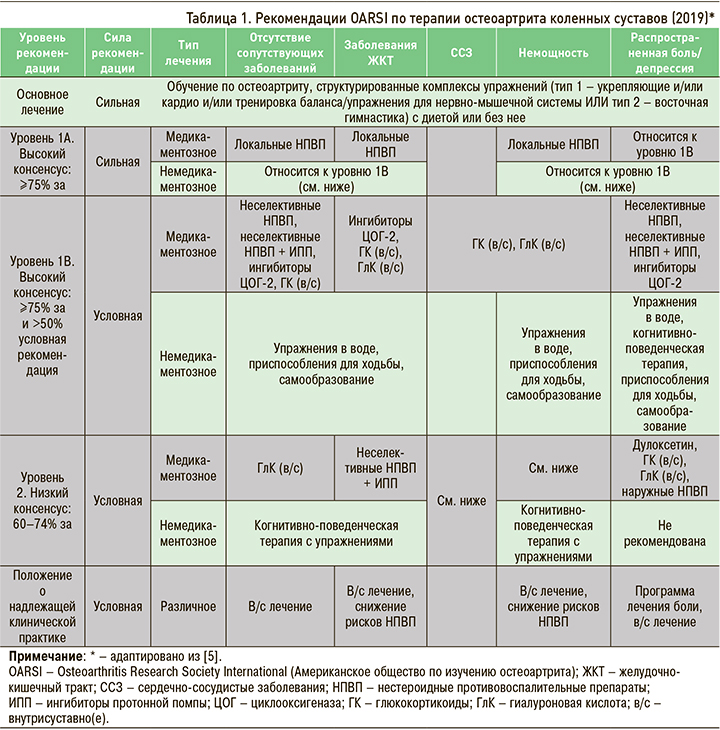
Алгоритм лечения в рекомендациях OARSI построен на принципах доказательной медицины, что, безусловно, правильно. Вместе с тем последние исследования подходов к лечению ОА свидетельствуют о некоторых преимуществах персонифицированной терапии, особенно в экономическом плане (рис. 2, 3) с учетом нескольких визитов пациента к врачу.
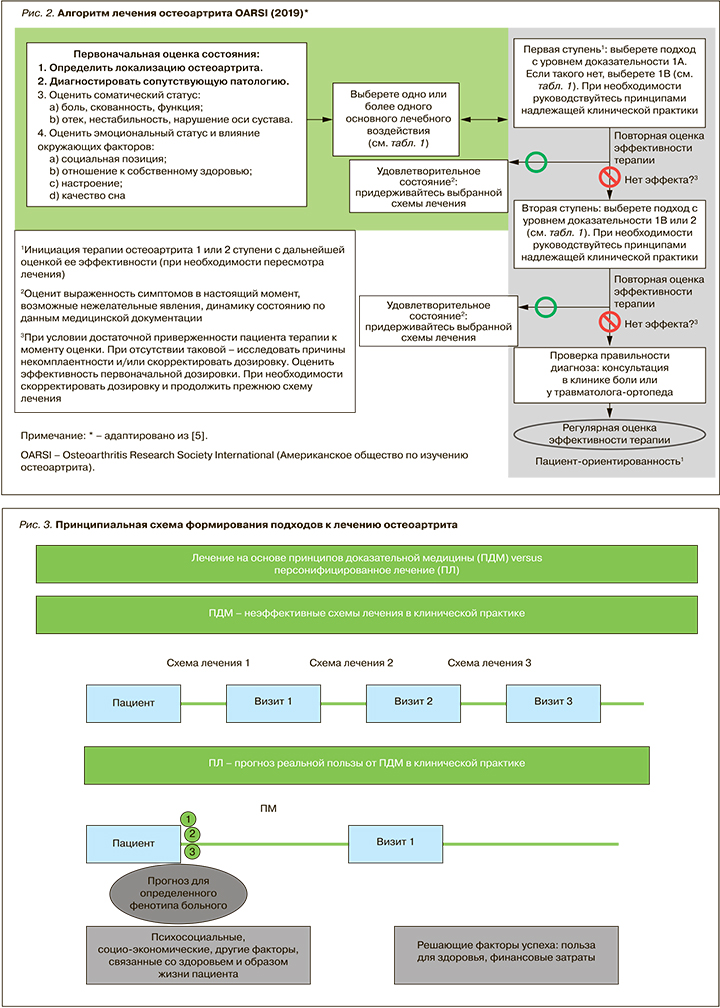
В 2019 г. Американский колледж ревматологии (American College of Rheumatology; ACR) представил 49 рекомендаций по ведению больных с ОА коленных, тазобедренных и суставов кистей [6], в которых 8 лекарственных средств строго не рекомендовались (табл. 2).
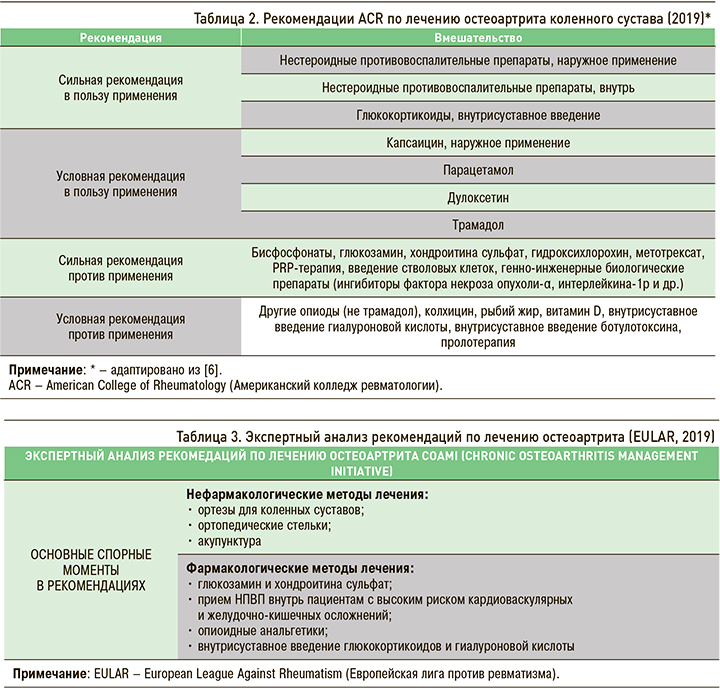
Результаты экспертного анализа рекомендаций OARSI и ACR и сравнение их с европейскими рекомендациями, проведенные COAMI (Chronic Osteoarthritis Management Initiative), обсуждались на конференции Европейской лиги против ревматизма (European League Against Rheumatism; EULAR) в 2019 г., где были опять отмечены разногласия по некоторым методам лечения ОА (табл. 3).
Рекомендации, пожалуй, наиболее приближенные к реальной клинической практике, впервые были разработаны Европейским обществом по клиническим и экономическим аспектам остеопороза и остеоартрита (European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases; ESCEO) [7], поскольку именно в них строго определена последовательность действий врача при ведении пациентов. В 2019 г. с учетом новых доказательств эффективности и безопасности препаратов алгоритм для лечения ОА коленных суставов был обновлен [8] (рис. 4).
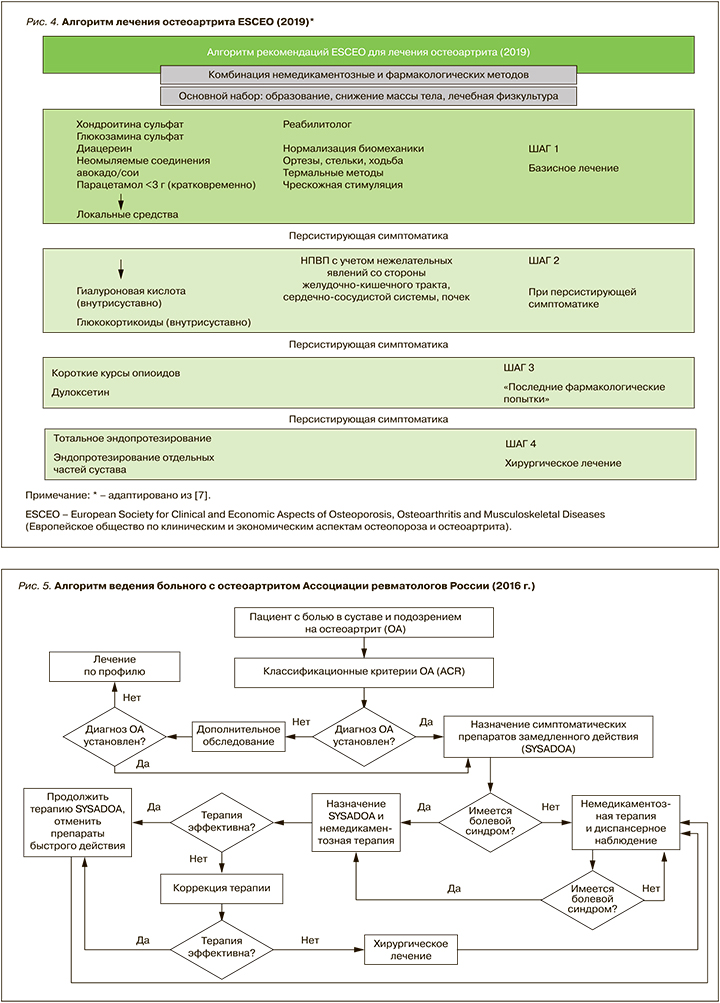
Отметим, что российские рекомендации по лечению ОА созвучны этому алгоритму (рис. 5). В них, как и почти во всех других рекомендациях, основной принцип лечения ОА заключается в комбинации немедикаментозных и фармакологических методов. Немедикаментозные методы, по возможности адаптированные к потребностям и предпочтениям больного, применяются на протяжении всего периода лечения, при этом особое внимание следует уделять физическим упражнениям, коррекции массы тела, ненормальной оси сустава. Возможно использование некоторых термальных методов.
В последних рекомендациях EULAR по немедикаментозным методам лечения больных с артритами в первичном звене здравоохранения содержатся указания на необходимость дополнительно включать в план персонифицированного управления болью психологические, социальные практики и вмешательства в процессы сна [9].
СИМПТОМАТИЧЕСКИЕ ПРЕПАРАТЫ ЗАМЕДЛЕННОГО ДЕЙСТВИЯ И ПАРАЦЕТАМОЛ
Симптоматические препараты замедленного действия (SYSADOA) занимают важное место в лечении ОА, поскольку было продемонстрировано их позитивное действие на боль и функциональные нарушения. Кроме того, получены доказательства долгосрочного влияния этой группы средств на течение заболевания.
Группа SYSADOA включает глюкозамин, хондроитин, диацереин и неомыляемые соединения сои и авокадо. Алгоритм ESCEO рекомендует использование этих препаратов в качестве базисного лечения (шаг 1). В то же время уровень рекомендаций относительно SYSADOA в других международных алгоритмах (например, в американских) не столь высок; вероятно, это вызвано тем, что во многих странах эти средства представлены в разных формах (рецептурные, безрецептурные лекарственные средства, а также пищевые добавки), содержащих различные активные ингредиенты. Поэтому среди доступных SYSADOA ESCEO особенно рекомендует использовать рецептурные препараты глюкозамина и хондроитина фармацевтического качества, доказательная база которых не вызывает сомнений [10].
Глюкозамин присутствует в организме в качестве основного субстрата для биосинтеза протеогликана, необходимого для поддержания целостности хряща. Хотя механизмы действия глюкозамина полностью не известны, установлено, что он блокирует провоспалительные эффекты интерлейкина-1 (ИЛ-1) в хряще и хондроцитах [11].
Многочисленные исследования влияния глюкозамина на симптомы ОА продемонстрировали неоднородность результатов в основном из-за разнообразия используемых препаратов на основе этой субстанции. Однако анализ работ, в которых применялся запатентованный кристаллический глюкозамина сульфата (pCGS), показал, что он превосходит плацебо в отношении боли (стандартизованная разница средних (SMD) -1,11; 95% доверительный интервал (ДИ): от -1,66 до -0,57) и функции (индекс Лекена SMD -0,47; 95% ДИ: от -0,82 до -0,12) по сравнению с другими формами глюкозамина [12]. Глюкозамина сульфат pCGS обладает хорошей биодоступностью (44%), что обеспечивает высокую концентрацию активного вещества в плазме, которая необходима для максимального воздействия на ИЛ-1 [11]. Частота нежелательных явлений при применении pCGS аналогична таковой у плацебо [13,14]. Доказательства структурно-модифицирующего действия препарата получены в двух 3-годичных исследованиях [13, 14].
Хондроитина сульфат (ХС) представляет собой сложный полисахарид, экстрагируемый из различных хрящей животных, и поэтому имеет различия по молекулярной массе и различные места сульфатирования, которые могут влиять на его химические свойства и фармакологическую активность [15]. ХС обладает противовоспалительным действием, увеличивает продукцию коллагена II типа и протеогликанов, снижает резорбцию костной ткани и способствует равновесию анаболических и катаболических изменений в хондроцитах [15]. В Кокрановском обзоре (43 рандомизированных клинических исследования) было продемонстрировано небольшое или умеренное уменьшение боли и улучшение функции суставов при использовании ХС по сравнению с плацебо при наблюдениях за пациентами продолжительностью до 6 мес [16]. А вот в исследованиях, в которых применялся ХС фармацевтического класса, через 3–6 мес наблюдалось уже значительное уменьшение боли и улучшение функции по сравнению с плацебо (p=0,05) [17]. Кроме того, ХС фармацевтического класса продемонстрировал эффективность, аналогичную селективному НПВП целекоксибу (200 мг/сут) в плане уменьшения боли и улучшения функции при применении в течение 6 мес [18].
Результаты трех 2-годичных клинических исследований показали, что ХС обладает модифицирующим действием на болезнь, замедляя скорость сужения суставной щели на 0,13 мм (95% ДИ: 0,06–0,19; p=0,0002), что соответствует величине эффекта 0,23 (95% ДИ: 0,11–0,35; p=0,0001) [17, 19]. ХС имеет хороший профиль безопасности при использовании в дозах до 1200 мг/сут [20].
Для достижения более быстрого клинического эффекта может быть целесообразным использование инъекционных форм SYSADOA. В России одним из известных препаратов этого ряда является биоактивный концентрат мелкой морской рыбы Алфлутоп®, который содержит мукополисахариды (хондроитина сульфат), аминокислоты, низкомолекулярные пептиды, ионы натрия, калия, кальция, магния, железа, меди и цинка. Недавно выполненный методический обзор серии из 37 клинических исследований Алфлутопа® (n=3676) показал хороший анальгетический потенциал этого препарата при ОА, а также при хронической неспецифической боли в спине и ревматической патологии околосуставных мягких тканей. В среднем после курса внутримышечных и/или внутрисуставных инъекций интенсивность скелетно-мышечной боли снижалась на 40–60%. При этом Алфлутоп® демонстрировал благоприятный профиль безопасности: на фоне его введения не было отмечено серьезных нежелательных реакций [21].
Диацереин и неомыляемые соединения сои и авокадо пока рассматриваются как средства альтернативного лечения ОА, хотя в недавнем отчете ESCEO применение диацереина позиционируется как возможный вариант фонового лечения заболевания, особенно у пациентов с противопоказаниями к НПВП или парацетамолу [22].
Парацетамол долгие годы использовался в качестве анальгетического средства при умеренных и легких болях в суставах, однако накопленные данные свидетельствуют о его низкой эффективности [23]. Кроме того, появились свидетельства повышения частоты развития неблагоприятных явлений со стороны сердечно-сосудистой системы, желудочно-кишечного тракта (ЖКТ), печени и почек при его применении [24]. В связи с этим парацетамол рекомендуется назначать коротким курсом при непереносимости НПВП и суточной дозе не выше 3,0 г.
В алгоритме ESCEO купирование боли рекомендуется начинать не с пероральных, а локальных НПВП, поскольку сравнение установило равную эффективность этих форм и лучший профиль безопасности препаратов для наружного применения вследствие их низкой системной абсорбции [25]. НПВП для наружного применения могут быть средствами выбора у пациентов старше 75 лет или больных, имеющих серьезную патологию со стороны ЖКТ и сердечно-сосудистой системы.
НПВП, ГИАЛУРОНОВАЯ КИСЛОТА, ГЛЮКОКОРТИКОИДЫ
При недостаточной эффективности нелекарственных методов, SYSADOA, локальных форм препаратов назначаются системные формы НПВП (шаг 2). У больных с умеренной или сильной болью в суставах НПВП могут применяться одновременно с SYSADOA, тем более что у последних клинический эффект развивается не сразу, а спустя 8–12 нед от начала приема.
НПВП подбираются дифференцированно с учетом коморбидности пациента. Эффективность этих средств доказана в многочисленных исследованиях по сравнению с плацебо, она имеет дозозависимый характер и сопоставима у селективных (сНПВП) и неселективных (нНПВП) препаратов.
Недавно опубликованный метаанализ безопасности НПВП в сравнении с плацебо продемонстрировал, что прием всех препаратов этого класса приводит к увеличению рисков развития нежелательных явлений со стороны верхних отделов ЖКТ: для коксибов ОР оказался равен 1,81 (95% ДИ: 1,17–2,81), диклофенака – 1,89 (95% ДИ: 1,16–3,09), ибупрофена – 3,97 (95% ДИ: 2,22– 7,1), напроксена – 4,22 (95%; ДИ: 2,71–6,56) [26]. Наименьшим гастроинтестинальным риском по сравнению с другими препаратами группы обладает целекоксиб [27].
Что касается нежелательных явлений со стороны сердечно-сосудистой системы, то с учетом данных последнего когортного исследования в алгоритм ESCEO внесена следующая рекомендация по длительности приема НПВП у больных с кардиоваскулярными заболеваниями: целекоксиб назначается курсом не более 30, а нНПВП – не более 7 дней [28].
Внутрисуставное введение препаратов гиалуроновой кислоты рекомендуется пациентам в случае неэффективности предшествующей терапии или наличии противопоказаний к применению НПВП (например, больным с высокой коморбидностью). Доказательства эффективности гиалуроновой кислоты по сравнению с плацебо и НПВП представлены во многих рандомизированных клинических исследованиях и метаанализах [29].
При наличии синовита рекомендуется внутрисуставное введение глюкокортикоидов (ГК) с частотой не более 1–2 раз в год. Однако действие этих препаратов кратковременно. В 2017 г. были опубликованы результаты длительного внутрисуставного применения глюкокортикоидов (4 инъекции в год в течение 2 лет), которые показали отрицательное влияние такой терапии на прогрессированние ОА коленных суставов [30].
ДРУГИЕ МЕТОДЫ ЛЕЧЕНИЯ
Шаг 3 в рекомендациях ESCEO обозначен как «последние фармакологические попытки» и относится прежде всего к трамадолу и дулоксетину. Трамадол рекомендовано назначать короткими курсами пациентам, которые не ответили на другие методы лечения, или при наличии очень интенсивной боли в суставах. Кроме того, в последнем систематическом обзоре [31] были продемонстрированы высокие риски развития побочных реакций со стороны ЖКТ и центральной нервной системы на фоне приема пероральных опиоидов для лечения ОА.
Эффективность дулоксетина подтверждена в двойном слепом плацебо-контролируемом исследовании при ОА коленных суставов и безрезультатности предшествующей терапии НПВП [32], особенно у пациентов с хронической болью и признаками центральной сенситизации [33]. Однако эта рекомендация ESCEO имеет слабую силу.
Заключительный 4 шаг в рекомендациях по лечению ОА – хирургические методы. К ним прибегают в случаях, когда болевой синдром не поддается терапевтическим воздействиям, значительно ухудшается качество жизни. У пациентов c последней стадией ОА эксперты ESCEO и EULAR рекомендуют проводить тотальное эндопротезирование коленного сустава.
ЗАКЛЮЧЕНИЕ
Таким образом, опубликованные в 2019 г. рекомендации ACR, OARSI и ESCEO опять содержат некоторые противоречия, относящиеся в основном к методам фармакологического лечения ОА коленных суставов. Вместе с тем нельзя не заметить, что с течением времени по мере накопления новых данных происходит сближение мнений экспертов этих обществ: это касается прежде всего внутрисуставного введения препаратов гиалуроновой кислоты и некоторых других аспектов. Предложенный ESCEO алгоритм терапии больных ОА коленных суставов суммирует все используемые немедикаментозные и фармакологические практики, используемые при лечении ОА, и основывается на актуальных доказательствах эффективности и безопасности различных методов. Эти рекомендации подчеркивают необходимость мультимодального подхода к ведению пациентов и предлагают последовательную схему назначения различных методов, представляющую собой руководство к действию для практикующих врачей разных специальностей, имеющих дело с больными ОА.



