На настоящий момент известно, что только около 10% всех видов онкологических заболеваний вызваны генеративными мутациями, остальные обусловлены приобретенными соматическими мутациями и влиянием факторов окружающей среды. Во многих случаях развитие онкологии связано с хронической инфекцией, влиянием употребляемой пищи, вдыхаемыми поллютантами, употреблением табака или аутоиммунным воспалением. Объединяющим принципом, лежащим в основе этих процессов, является хроническое воспаление, которое выступает длительной формой защитного ответа на продолжительное изменение гомеостаза тканей.
Первое задокументированное предположение об ассоциации между воспалением и онкологическим процессом приписывают немецкому патологу Рудольфу Вирхову. Данная гипотеза, основанная на обнаружении ученым воспалительных инфильтратов в солидных злокачественных новообразованиях, получила сильную эпидемиологическую и механистическую поддержку в последние десятилетия. Около 18% случаев онкологических заболеваний у человека связаны с инфекцией, а хроническое воспаление, вызываемое инфекцией, служит важным фактором канцерогенеза. Кроме того, повреждение тканей и травмы могут вызвать местное хроническое воспаление, которое также может стать причиной развития онкологического процесса [1, 2].
Несмотря на то что воспаление контролируется многочисленными иммунологическими медиаторами и путями, некоторые системы врожденного иммунитета выступают ключевыми регуляторами. Среди них известны так называемые хемокины – семейство низкомолекулярных, структурно родственных белков, которые взаимодействуют с семи трансмембранными рецепторами клеточной мембраны, связанными с гетеротримерными G-белками. Слово хемокин, полученное из «хемотаксического цитокина», обозначает хемоаттрактантную функцию и цитокиновую природу этих молекул. На настоящий момент у людей известно около 50 хемокинов и 20 хемокиновых рецепторов. Хемокиновая система признана основной группой белков, которые способствуют перемещению лейкоцитов в/из лимфоидных органов и тканей в условиях гомеостаза и патологического состояния внутренней среды организма. Временная и пространственная регуляция перемещения лейкоцитов важна для эффективного ответа на чужеродные антигены и другие повреждающие агенты. Неправильная регуляция экспрессии хемокинов или рецепторов хемокинов также является основным фактором, лежащим в основе хронического воспаления и онкогенеза. Опухоли представляются как «органы», состоящие из различных типов клеток, которые сожительствуют и взаимодействуют друг с другом. Эволюция в опухолях зависит от взаимодействия между опухолевыми клетками и стромальными клетками, которые включают эндотелиальные и иммунные клетки. Хемокины – важный компонент перекрестной связи между различными типами клеток в микроокружении опухоли; они не только регулируют доставку лейкоцитов в опухоль, но также воздействуют на опухолевые клетки и на другие компоненты стромальных клеток, способствуя или ингибируя развитие опухоли [3, 4].
Наиболее подверженным влиянию хемокинов является лейкоз, на который, по данным Интернационального агентства исследования онкологических заболеваний, к 2020 г. приходилось около 3,1% смертей от всех онкологических заболеваний. Среди всех лейкозов ведущее место по заболеваемости и смертности занимает острый миелоидный лейкоз (OМЛ). До 40% всех пациентов с этим заболеванием не реагируют на начальную терапию и в последующем остаются невосприимчивыми ко всем видам лечения, в связи с чем активно ведется поиск альтернативных методов терапии. Несмотря на то что в свете поиска лечения были проведены многочисленные исследования по влиянию хемокинов и их рецепторов (в частности, хемокина CXCL12 и его рецептора СXCR4) на миграцию клеток, а также прогрессирование OМЛ, до настоящего момента не была исследована возможная экспрессия гетерологичных рецепторов, вносящих значительный вклад в прогрессию OМЛ, в частности, ССR4 и EGFR.
Ранее нами была исследована миграция клеток по направлению к СXCL12 и лиганду TLR9, а также экспрессия таких генов, как CXCL12, EGFR, CCR4, выделенных от пациентов с OМЛ до лечения, а также от здоровых доноров [5, 6]. Поскольку в экспериментах не было выявлено значимого влияния лиганда TLR9 на миграцию опухолевых клеток, в дальнейшем работа была сосредоточена на исследовании влияния СXCL12, которое изучалось только на пациентах до химиотерапии. В связи с этим целью данной работы стало исследование влияния СXCL12 на хемотаксис клеток, а также экспрессию генов CXCL12, EGFR, CCR4 у пациентов с OМЛ до и после химиотерапии.
МАТЕРИАЛ И МЕТОДЫ
Нa первом этапе работы исследовался хемотаксис мононуклеарных клеток (МНК), выделенных от здоровых доноров, пациентов с OМЛ до и после химиотерапии (по протоколу 7+3:7 дней применения цитарабина +3 дня применения антрациклинового антибиотика или антрацендиона). На втором этапе исследовалась экспрессия генов CXCL12, EGFR, CCR4 в МНК данных групп.
Клиническим материалом служила кровь, выделенная от пациентов с OМЛ подтипа М4 по FAB классификации (n=10) с содержанием бластов в периферической крови не менее 70%, а также кровь от здоровых доноров (n=25).
Из крови выделялись мононуклеарные клетки методом наслоения на фиколл (ПанЭко, РФ) по стандартной методике [7]. Для исследования миграции МНК использовалась камера Бойдена фирмы MultiScreen Migration Invasion and Chemotaxis Filter Plate (MERCK, Германия). В качестве хемоаттрактанта применялся СXCL12 (ThermoFisher, США), который помещался в нижнюю камеру в количестве 150 мкл и концентрации 200 нг/мл; в качестве контроля миграции в нижней камере использовалась среда RPMI (ПанЭко, Россия). В верхнюю камеру помещались МНК в количестве 60 мкл и концентрации 1,0×106 клеток/ мл. Подсчет мигрировавших клеток производили через 15, 60 мин и 24 ч.
На втором этапе, согласно протоколу набора, проводилось выделение РНК с использованием набора «Рибо-сорб» (АмплиСенс, Россия), после чего производилось получение кДНК на полученной матрице РНК с использованием набора («ОТ-1», Синтол, РФ). Подбор праймеров для изучения экспрессии генов CXCL12, EGFR, CCR4 выполнялся с помощью GeneBank и программы Vector NTI 8. Подобранные праймеры были синтезированы в фирме Синтол (Россия).
Статистическая обработка проводилась в программе GraphPad Prism 7.00 с использованием непараметрических методов.
РЕЗУЛЬТАТЫ
Хемотаксис МНК, полученных от здоровых пациентов, по направлению к CXCL12 достоверно превышал контроль через 15, 60 мин, 24 ч в 1,5; 1,8 и 2,7 раз соответственно (р ≤0,05). Хемотаксис МНК по направлению к CXCL12, полученных от пациентов с OМЛ до начала химиотерапии, был достоверно ниже контроля через 60 мин в 1,8 раз (р ≤0,05). Хемотаксис МНК, полученных от пациентов с OМЛ после окончания первого курса химиотерапии, по направлению к CXCL12 был достоверно ниже контроля через 60 мин в 1,6 раз (р ≤0,05) (рис. 1).
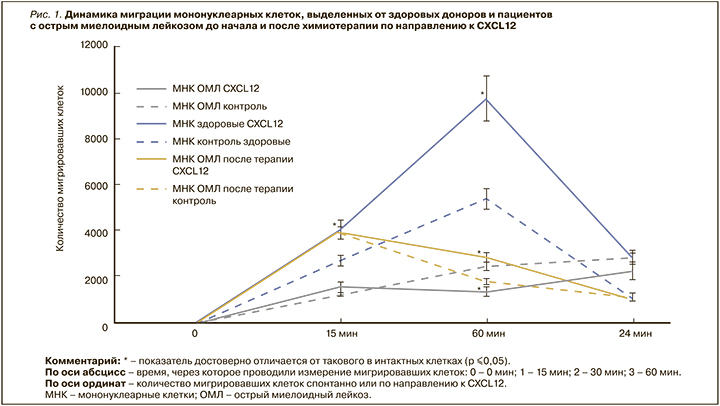
После исследования хемотаксиса МНК проводилось изучение экспрессии генов CXCL12, EGFR, CCR4 после воздействия CXCL12. Экспрессии гена CXCL12 в МНК здоровых пациентов через сутки была достоверно ниже контроля в 10 раз (р ≤0,05). Экспрессия гена CXCL12 в мигрировавших МНК пациентов с OМЛ до химиотерапии под действием CXCL12 была достоверно ниже контроля через 15, 60 мин и 24 ч в 16; 3,9 и 24,4 раз соответственно (р ≤0,05) (рис. 2). Была показана высокая отрицательная корреляционная зависимость хемотаксиса МНК от пациентов с OМЛ до химиотерапии с экспрессией гена CXCL12 через 60 мин и сутки (rs=0,75). Выявлено, что экспрессия гена CXCL12 в мигрировавших МНК, выделенных от пациентов с OМЛ после химиотерапии, под действием CXCL12 была достоверно ниже контроля через 60 мин и 24 ч в 2,9 и 5,9 раз соответственно (р ≤0,05) (см. рис. 2).
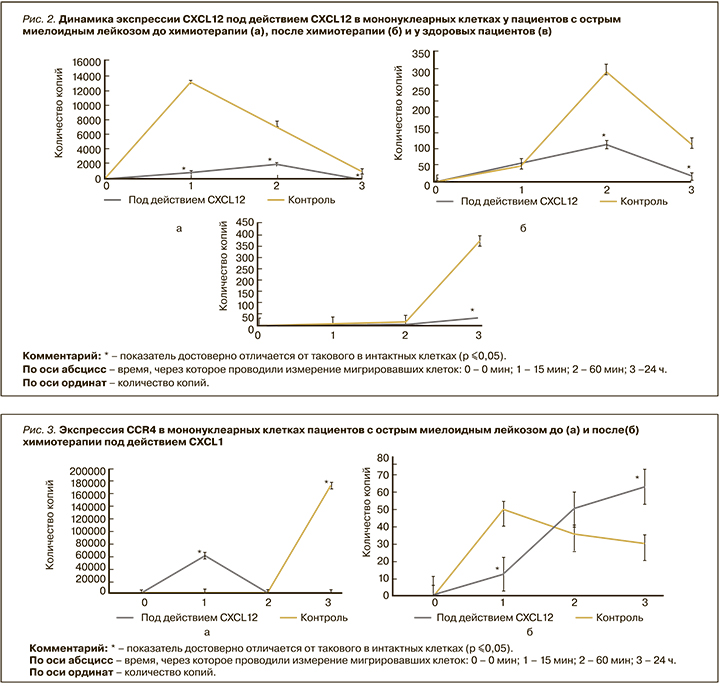
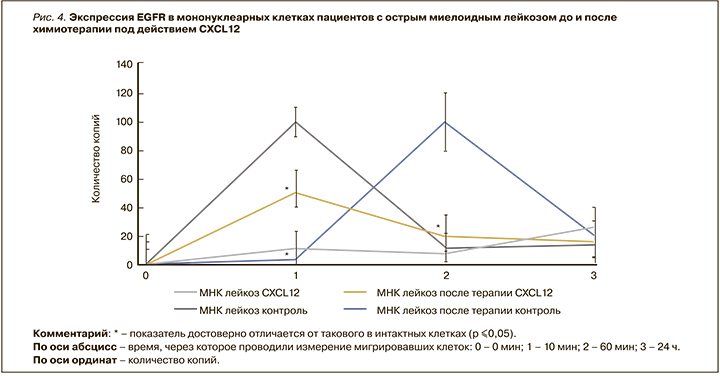
Экспрессия СCR4 в мигрировавших МНК здоровых пациентов под действием CXCL12 была достоверно выше контроля через 15 мин и ниже через 24 ч в 900 и 427 раз соответственно (р ≤0,05); через 60 мин эксперимента экспрессия достоверно не отличалась. Экспрессия гена ССR4 в мигрировавших МНК пациентов с OМЛ до начала химиотерапии под действием CXCL12 была достоверно выше контроля через 15 мин в 39,3 раза и ниже через 24 ч в 5128 раз (р ≤0,05). Экспрессия гена ССR4 в мигрировавших МНК пациентов с OМЛ после химиотерапии под действием СXCL12 была достоверно ниже контроля через 15 мин в 4 раза и выше через 24 ч в 2,1 раз (р ≤0,05; рис. 3).
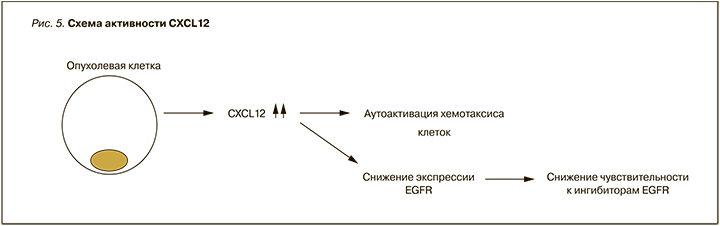
Экспресcия гена EGFR в МНК здоровых пациентов достоверно превышала контроль через 60 мин в 23 раза (р ≤0,05). Установлено, что экспрессия гена EGFR в мигрировавших МНК пациентов с OМЛ до начала химиотерапии под действием СXCL12 была достоверно ниже контроля через 15 мин в 8,3 раз (р ≤0,05). Экспрессия гена EGFR в мигрировавших МНК пациентов с OМЛ после химиотерапии под действием СXCL12 была достоверно выше контроля через 15 мин в 12,8 раза и ниже через 60 мин в 5 раз (р ≤0,05) (рис. 4).
ОБСУЖДЕНИЕ
Результаты исследования указывают на то, что динамика миграции МНК, выделенных от здоровых пациентов, по направлению к СXCL12 достоверно превышала таковую в контроле в течение всего эксперимента. При этом следует отметить, что миграция МНК у пациентов с OМЛ до начала химиотерапии под воздействием СXCL12 была значительно ниже контрольных показателей. После химиотерапии миграционная активность МНК у пациентов с OМЛ относительно СXCL12 увеличивалась.
В проведенных ранее исследованиях зарубежными учеными описаны противоположные результаты, которые авторы связывали с более высокой экспрессией CXCR4 на поверхности клеток лейкоза [8, 9]. Одна из причин этого феномена может заключаться в том, что гипоксические условия в нишах красного костного мозга (ККМ) ингибируют апоптоз. Однако не так давно стали появляться новые исследования, указывающие на то, что СXCL12 может не только активировать, но и ингибировать хемотаксис; одна из теорий, объясняющая такие результаты исследований, гласит, что вне клеток костного мозга нет необходимой гипоксии для индукции апоптоза, и воздействие CXCL12 вызывает активацию Bak, Noxa и Bcl-XL, а это, в свою очередь, опосредованно ведет к апоптозу [10]. Другая теорией, выдвинутой недавно американскими учеными, является теория о двойственном влиянии различных форм CXCL12 [11].
Для установления других причин данного феномена, полученного нами, была исследована экспрессия CXCL12 самими опухолевыми клетками. Было выявлено, что на протяжении всего эксперимента в МНК, полученных от здоровых пациентов, экспрессия CXCL12 не изменялась, в то время как экспрессия CXCL12 в МНК, выделенных от пациентов до химиотерапии, в контроле была значительно выше активированных МНК и экспрессии в МНК здоровых доноров. Это может говорить о высокой продукции CXCL12 самими опухолевыми клетками. Этот феномен может вызывать десенситизацию рецептора CXCR4, а также к его интернализацию, что приводит к отсутствую ответа на вводимый извне CXCL12 и объясняет низкую миграционную активность данных клеток. Таким образом, можно предположить, что клетки лейкоза самостоятельно продуцируют CXCL12 в количествах, превышающих таковые в здоровых клетках. Это способствует аутоактивации клеток лейкоза, их росту и прогрессии.
В 2011 г. было показано, что выработка CKLF1, который выступает лигандом CCR4, нарушается при различных воспалениях и аутоиммунных заболеваниях. CKLF1 может ингибировать CXCL12-индуцированный CXCR4-опосредованный хемотаксис и способствовать интернализации CXCR4. Как следствие, активация CCR4 может снижать хемотаксис опухолевых клеток по направлению к CXCL1 в связи с интернализацией и десентизацией рецептора CXCR4 [12]. В нашем исследовании мы изучили, возможен ли обратный эффект снижения экспрессии гетерологичного рецептора CCR4 путем добавления хемокина CXCL12, который является лигандом CXCR4. Полученные нами данные свидетельствуют о возможном снижении экспрессии гетерологичного рецептора CCR4 под воздействием CXCL12 при ОМЛ, что может использоваться в качестве идеи экспериментального лечения данной патологии.
В поисках альтернативных методов лечения ОМЛ учеными были проведены исследования по ингибированию EGFR, в которых были получены неоднозначные результаты [13, 14]. Несмотря на то что действительно была обнаружена высокая экспрессия этого рецептора на клетках ОМЛ, терапия ингибиторами EGFR не показала значимого результата [15]. В нашем исследовании оценивалась экспрессия EGFR после воздействия CXCL12, которое показало снижение экспрессии EGFR. Полученные данные могут объяснить отсутствие ответа при использовании ингибиторов этого рецептора.
Нами продемонстрировано, что химиотерапия значительно снижает экспрессию генов, ответственных за перекрестную десентизацию гетерологичных рецепторов, а также экспрессию CXCL12 (рис. 5), который является главным участником, способствующим миграции клеток в ККМ.
ЗАКЛЮЧЕНИЕ
Несмотря на многочисленные исследования, направленные на изучение пролиферации и миграции клеток онкологических заболеваний, в частности, лейкозов, в области лечения данных заболеваний остаются нерешенные вопросы. Наше исследование показало, что даже на уровне врожденного иммунного ответа существует различное множество путей активации и инактивации рецепторов, которые вносят свои в коррективы в течение заболевания, а также прогноз лечения.


