Рак желудка (РЖ) – одна из наиболее распространенных злокачественных опухолей пищеварительного тракта [1]. В структуре смертности от злокачественных новообразований (ЗНО) он занимает 2 место (9,3%) после опухолей трахеи, бронхов и легких [2].
Большинство видов РЖ представлено аденокарциномами. В последние годы отмечается рост заболеваемости перстневидно-клеточным РЖ [3], который является малодифференцированным подтипом с уникальными клиническими характеристиками и низкой выживаемостью.
Наличие трудностей диагностики перстневидно-клеточной формы РЖ побудили нас представить собственное клиническое наблюдение и обсудить важные аспекты диагностики этого заболевания.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
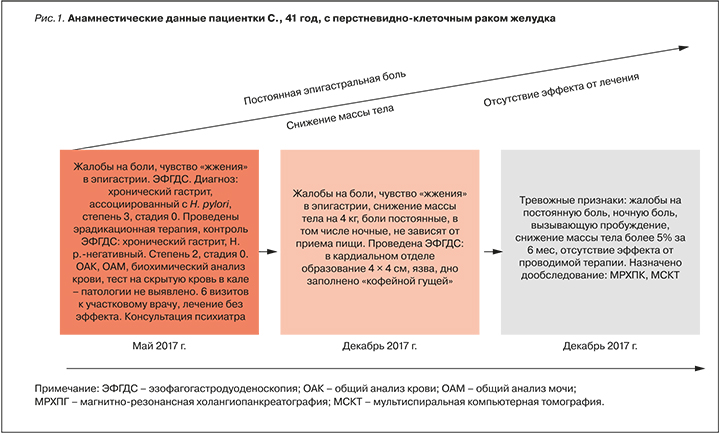
Пациентка С., 41 год, 04.12.2017 обратилась к гастроэнтерологу с жалобами на боли, чувство жжения в эпигастрии, снижение массы тела на 4 кг за период заболевания. Боли имели постоянный характер, не зависели от приема пищи, беспокоили пациентку даже ночью, вызывая пробуждение.
Anamnesis morbi: пациентка считала себя больной в течение 7 мес, с мая 2017 г. Обращалась к участковому терапевту по месту жительства. В июле 2017 г. ей была выполнена первая эзофагогастродуоденоскопия (ЭФГДС) с биопсией по стандарту. Выставленный диагноз «хронический гастрит, ассоциированный с Helicobacter pylori. Степень 3, стадия 0. Синдром диспепсии».
Пациентке было назначено лечение, направленное на эрадикацию H. pylori. Через 4 нед после такого лечения была выполнена контрольная ЭФГДС. Заключение: «хронический гастрит H. pylori-негативный. Степень 2. Стадия 0».
За период заболевания было проведено обследование, включавшее общий анализ крови и мочи, биохимический анализ крови, тест на скрытую кровь в кале иммунохимическим методом. Патология выявлена не была.
Anamnesis vitae: туберкулез, вирусный гепатит, ВИЧ отрицает. Гемотрансфузии, травмы отрицает. Аллергоанамнез не отягощен. Наследственность: рак молочной железы у матери.
Status praesens: на момент осмотра общее состояние пациентки было удовлетворительным. Живот мягкий, болезненный при пальпации в эпигастрии, изменений со стороны других систем не выявлено. Выставленный клинический диагноз: «хронический гастрит, ассоциированный с H. pylori. Степень 2. Стадия 0. Синдром диспепсии».
В связи с сохраняющимися жалобами и наличием тревожных признаков (постоянный характер эпигастральной боли, ночная боль, вызывающая пробуждение, снижение массы тела более 5% за 6 мес заболевания, отсутствие эффекта от проводимой терапии) рекомендовано дообследование: повторная ЭФГДС, магнитно-резонансная холангиопанкреатография (МРХПГ), мультиспиральная компьютерная томография (МСКТ) с контрастом (рис. 1).
Заключение по результатам МРХПГ (05.12.2017): признаки бластоматозной инфильтрации в области дна и тела желудка протяженностью 5 см, стенка желудка утолщена до 26 мм (рис. 2).
Заключение по результатам МСКТ органов брюшной полости с контрастом (06.12.2017): КТ-картина объемного образования кардиального отдела желудка с переходом на тело, регионарная парагастральная лимфаденопатия вторичного характера.
Заключение по результатам ЭФГДС (06.12.2017): в кардиальном отделе по малой кривизне выбухающее в просвет желудка подслизистое образование до 4×4 см, в центре глубокое изъязвление. Дно заполнено «кофейной гущей». Края изъязвления инфильтрированные.
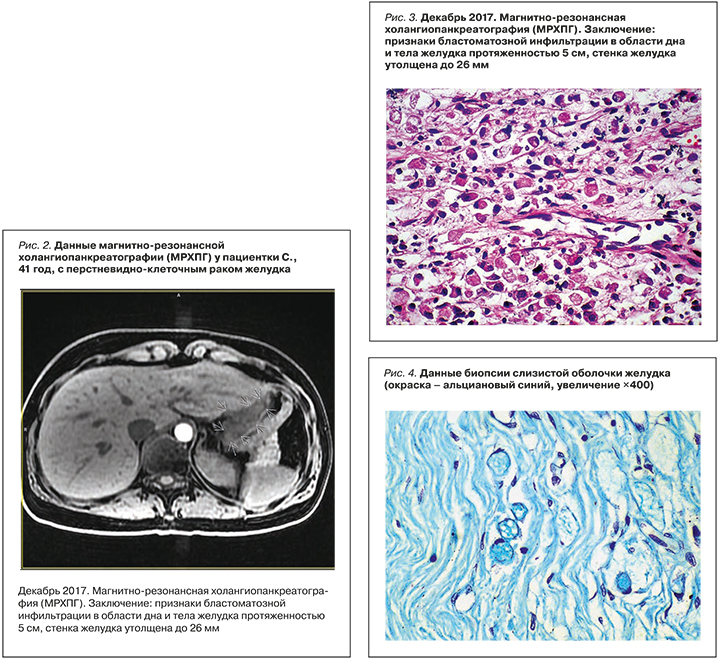
Гистологическое заключение: «перстневидно-клеточный РЖ» (рис. 3, 4).
06.12.2017 пациентка была госпитализирована в торакальное отделение областного онкологического диспансера. Диагноз: «C16.9 ЗНО кардиального отдела и тела желудка T: 3; N: Х; M: 0; St: 3б. Осложнение: кровотечение Forrest IIb».
13.12.2017 больной была выполнена гастроспленэктомия по Roux. Обнаружено: опухоль по малой кривизне до 7 см в наибольшем размере, прорастающая стенку. Лимфоузлы увеличены по ходу a. et v. gastrica sinistra до 1 см, аналогичные явления в большом сальнике и воротах селезенки.
Гистология (макроскопически): ближе к кардиальному отделу желудка по малой кривизне определяется опухолевидное образование 5,5×4×4 см, прорастающее всю стенку желудка в жировую клетчатку. В жировой клетчатке определяются мелкие лимфоузлы до 0,5 см серого цвета. В большом сальнике среди жировой ткани очаговое образование до 1 см.
Гистология (микроскопически): в материале из желудка наблюдается картина перстневидно-клеточного рака с прорастанием всех слоев стенки, инфильтрацией жировой клетчатки с метастазами в лимфатические узлы.
Заключительный диагноз: «ЗНО кардиального отдела и тела желудка T: 3; N: 2; M:0; St: 3б. Клиническая группа: 3».
С учетом распространенности процесса, удовлетворительного состояния и молодого возраста пациентки рекомендовано 4 курса полихимиотерапии.
В феврале 2018 г. после 4 курса адъювантной полихимиотерапии произведена ЭФГДС. Заключение: «состояние после гастрэктомии, стеноз анастомоза, дистальный фибринозный эзофагит».
11.04.2018 проведено бужирование стриктуры эзофагоэнтероанастомоза под эндоскопическим контролем. Баллонная дилатация 10–11–12 мм.
12.05.2018 пациентка умерла от причин, связанных с основным заболеванием.
ОБСУЖДЕНИЕ
Перстневидно-клеточный фенотип РЖ – прогностически неблагоприятная и наиболее сложная для диагностики форма заболевания на ранних стадиях РЖ. Причинами неблагоприятного прогноза в данном случае считаются биологическая активность, обусловленная гистологическим типом опухоли, неполное или несвоевременное обследование пациента.
В представленном клиническом наблюдении время от первого обращения пациентки по поводу диспепсического симптомокомплекса до верификации диагноза составило 7 мес, от постановки диагноза до смерти – 5 мес.
Проводившиеся в рамках амбулаторно-поликлинического этапа исследования (ЭФГДС, трансабдоминальная ультрасонография, общий и биохимический анализ крови) не выявили признаков ЗНО. Однако наличие «тревожных признаков», регистрировавшихся у пациентки (персистирующая эпигастральная боль, снижения массы тела, отсутствие эффекта от проводимой терапии в стандартные сроки по поводу хронического гастрита и диспепсии), стали основанием для пересмотра клинического диагноза при повторном обращении, а отягощенный анамнез по раку молочной железы – показанием для генетического тестирования.
Одной из основных причин развития перстневидно-клеточного РЖ выступает мутация гена CDH1, который кодирует белок Е-кадгерин, ответственный за межклеточные соединения и дифференцировку эпителиальных клеток. Герминальные CDH1 мутации определяются в 60–80 % семей [4]. В связи с этим один из важных аспектов ранней диагностики заболевания – выявление отягощенной наследственности по онкологическим заболеваниям в семьях.
Важным аспектом является также анализ симптомов, тщательный сбор анамнеза заболевания, семейного анамнеза по РЖ и дольковому раку молочной железы, генетический скрининг (выявление мутаций CDH1). Определение мутации CDH1 в семьях с подозрением на наследственный РЖ показано при обнаружении:
- двух или более случаев РЖ в семейной группе с наличием, по крайней мере 1 случая, диффузного РЖ, диагностированного в возрасте до 50 лет;
- трех или более подтвержденных случаев диффузного РЖ у родственников первой или второй степени родства вне зависимости от возраста возникновения заболевания;
- диффузного РЖ в возрасте до 40 лет без наличия положительного семейного анамнеза;
- диффузного РЖ и долькового рака молочной железы (у пациента или членов его семьи), при этом хотя бы в одном случае диагноз должен был быть установлен в возрасте до 50 лет [5].
Носителям мутации CDH1 настоятельно рекомендуется профилактическая гастрэктомия в возрасте от 20 до 30 лет. Женщинам с мутацией CDH1 после 30 лет необходимо ежегодное наблюдение: осмотр, магнитно-резонансная томография молочных желез, маммография. Профилактическая мастэктомия не рекомендуется [6].
Эндоскопия верхних отделов пищеварительного тракта с биопсией служит информативным методом исследования, позволяющим визуализировать опухоль, определить размеры, локализацию и макроскопический тип, оценить угрозу осложнений и получить материал для морфологического исследования. Однако перстневидно-клеточный фенотип РЖ менее благоприятен для эндоскопической диагностики, так как на начальных его стадиях отмечается рост в пределах подслизистого слоя, а макроскопические изменения слизистой оболочки желудка, как правило, выявляются лишь на терминальных стадиях заболевания [7].
Сочетание на догоспитальном этапе визуального и эндосонографического исследований в едином диагностическом процессе позволяет улучшить диагностику РЖ в ранней стадии, определить глубину инвазии опухоли, наличие патологически измененных или увеличенных вовлеченных лимфоузлов, провести дифференциальную диагностику рака с новообразованиями иного гистологического типа, повысить эффективность верификации опухолей.
ЗАКЛЮЧЕНИЕ
Представленное клиническое наблюдение служит примером для онконастороженности врача первичного звена: оно показывает важность внимательной оценки «тревожных признаков» при каждом обращении пациента, а при отсутствии эффекта от проводимой терапии в стандартные сроки по поводу ранее выставленного диагноза – необходимость пересмотра ранее выставленного диагноза. В случае синдрома диспепсии этот срок составляет 4–8 нед [8].
Реализация на территории России скрининговых программ по РЖ, внедрение в практику первичного звена здравоохранения стандартов обследования и наблюдения за пациентами с предраковыми изменениями из групп риска позволит повысить долю выявленных больных с ЗНО желудка, уменьшит процент запущенных форм заболевания, показатели смертности, снизит затраты на лечение ЗНО на любых стадиях опухолевого процесса.



