В настоящее время первичный гиперпаратиреоз (ПГПТ) занимает по частоте третье место среди всех эндокринных заболеваний и может быть представлен манифестной, асимптомной и нормокальцемической формами [1]. В отличие от стран Европы и Северной Америки, в России до сих пор преобладает манифестная форма ПГПТ [2].
К классическим проявлениям ПГПТ принято относить нарушения со стороны опорно-двигательного аппарата (остеопороз, фиброзно-кистозный остеит, деформации костей, патологические переломы, нарушения походки), патологию почек (нефролитиаз/нефрокальциноз, снижение фильтрационной и концентрационной функций почек) и реже поражения желудочно-кишечного тракта (рецидивирующие дефекты слизистой оболочки двенадцатиперстной кишки и желудка, панкреатиты, панкреокалькулез) [3]. Помимо этого, сегодня обсуждают так называемые неклассические проявления ПГПТ, под которыми понимают заболевания сердечно-сосудистой системы (артериальная гипертензия, гипертрофия миокарда и диастолическая дисфункция левого желудочка, нарушения ритма и проводимости сердца) и нейрокогнитивные расстройства [4, 5].
Панкреатит, приводящий к развитию сахарного диабета (СД), не относится к частым проявлениям ПГПТ [6–10]. Тем не менее в литературе имеются указания на связь ПГПТ с возникновением острого и хронического панкреатита, сопровождающегося нарушениями углеводного обмена [11–15].
Целью настоящей публикации стало представление клинического случая манифестного ПГПТ, осложнившегося развитием СД на фоне кальцифицирующего панкреатита.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Пациентка М., 30 лет, с двумя преждевременными родами (на сроке гестации 26 и 33 нед) и хроническим панкреатитом неясной этиологии в анамнезе поступила в эндокринное отделение НМИЦ им. В.А. Алмазова.
Данные анамнеза: впервые жалобы, имеющие отношение к клинической картине основного заболевания, в виде болей в поясничной области появились у пациентки при первой беременности и повторились после 20-й недели во время второй беременности. Дополнительно к этим жалобам в III триместре последней беременности присоединились утиная походка и хромота, в связи с чем на сроке гестации 26/27 нед пациентке было рекомендовано выполнение магнитно-резонансной томографии (МРТ) пояснично-крестцового отдела позвоночника и тазобедренных суставов.
МРТ в области правого крестцово-подвздошного сочленения позволило выявить патологическое образование в структуре подвздошной кости и боковой массы крестца размером 28×51×41 мм неоднородной структуры, в левой бедренной кости – похожее образование неправильной формы с неровными бугристыми контурами размером 30×28×20 мм.
По результатам МРТ пациентка была направлена на консультацию к онкологу, по рекомендации которого выполнена биопсия образования правой крестцово-подвздошной области (рис. 1).
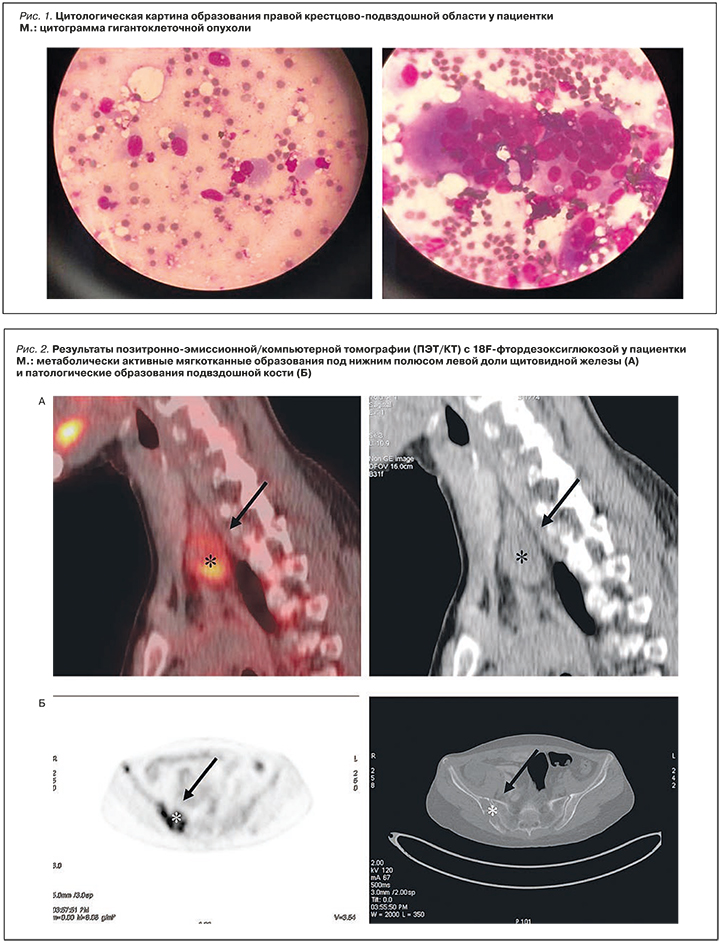
На основании данных биопсии больной был установлен диагноз остеобластокластомы, рекомендовано пролонгирование беременности и выполнение полихимиотерапии после родоразрешения. На 33-й неделе гестации в связи с преждевременной родовой деятельностью в Перинатальном центре НМИЦ им. В.А. Алмазова выполнено экстренное родоразрешение путем операции кесарева сечения. Масса ребенка при рождении составила 2600 г (крупный плод), первые дни жизни осложнились развитием судорожного синдрома.
В послеродовом периоде по рекомендации онколога для уточнения степени поражения костной ткани выполнена позитронно-эмиссионная/компьютерная томография (ПЭТ/КТ) с 18F-фтордезоксиглюкозой всего тела, результаты которого впервые выявили образование у нижнего полюса левой доли щитовидной железы (рис. 2А) и подтвердили наличие множественных метаболически активных образований в костях скелета (в структуре подвздошной кости и левой бедренной кости; рис. 2Б).
На основании полученных результатов у больной была заподозрена аденома левой нижней околощитовидной железы (ОЩЖ) и наличие ПГПТ. Данные биохимического и гормонального обследований подтвердили диагноз ПГПТ: уровень ионизированного кальция сыворотки крови составил 1,5 ммоль/л (1,16–1,32), общего кальция – 2,77 ммоль/л (<2,5), паратиреоидного гормона (ПТГ) – 1275 пг/мл (15,0–65,0). Результаты ультразвукового исследования (УЗИ) органов шеи также выявили наличие гипоэхогенного образования неправильной формы, расположенного по задней поверхности левой доли щитовидной железы.
Пациентке была выполнена селективная паратиреоидэктомия (ПТЭ). Данные гистологического исследования подтвердили наличие аденомы левой нижней ОЩЖ. Интраоперационно и послеоперационно у больной наблюдались нормализация уровня кальция и ПТГ в сыворотке крови до 1,15 (1,11–1,29) ммоль/л и 39,44 (15,00–65,00) пг/ мл соответственно. Также пациентка отметила уменьшение вплоть до полного исчезновения болей в поясничной области и нормализацию походки.
Через 6 мес после ПТЭ при плановом визите к эндокринологу больная М. стала предъявлять жалобы на жажду, сухость во рту и полиурию. С уровнем глюкозы плазмы крови 48,0 ммоль/л и подозрением на диабетический кетоацидоз пациентка была срочно госпитализирована в эндокринологическое отделение НМИЦ им. В.А. Алмазова.
Данные объективного обследования: рост 164,0 см, масса тела 45,0 кг, индекс массы тела (ИМТ) 18,2 кг/м2. При активном расспросе больной установлено, что полиурия и полидипсия появились в течение нескольких предыдущих месяцев, когда параллельно с данными жалобами пациентка отметила снижение массы тела на 5 кг. На основании результатов обследования был диагностирован СД и инициирована базис-болюсная инсулинотерапия.
Данные биохимического анализа крови: уровень гликолизированного гемоглобина (HbA1c) – 16,9%; pH крови – 7,39; уровень С-пептида – 0,80 нг/мл (1,10–4,40); антитела к глутаматдекарбоксилазе (GAD) (0,28 Ед/мл) – отрицательные. Эти данные подтвердили абсолютную недостаточность инсулина неаутоиммунного генеза. Уровень ионизированного кальция сыворотки крови составил 1,12 ммоль/л (1,11–1,29), общего кальция – 2,30 ммоль/л (2,15–2,65), ПТГ – 27,32 пг/мл (15,0–65,0).
При ретроспективном анализе медицинской документации, относящейся к периоду беременностей, обнаружены указания на повышение гликемии натощак до 6,55 ммоль/л, а также эпизоды гипергликемии в течение дня до 11,88 ммоль/л. Из медицинской документации периода подросткового возраста получена информация о наличии хронического панкреатита с частыми обострениями. Дополнительное обследование в виде УЗИ органов брюшной полости и пересмотр результатов ПЭТ/КТ всего тела с 18F-фтордезоксиглюкозой, выполненного в послеродовом периоде, обнаружило множественные кальцинаты диаметром 3–6 мм в паренхиме поджелудочной железы и признаки хронического панкреатита (рис. 3).
Данные проведенного молекулярно-генетического исследования не выявили наличие мутации гена МEN и мутации гена кальций-специфических рецепторов (CaSR). При этом был обнаружен вариант нуклеотидной последовательности в гене SDHB (Chr1:17380507, rs11203289, NM 003000.2:c.C8T:p.Ala3Val) в гетерозиготном состоянии, расценивающийся в соответствии с критериями Американской коллегии по медицинской генетике и геномике (ACMG) от 2015 г. как вариант с неопределенной клинической значимостью, который тем не менее может иметь отношение к фенотипу пациента в случае получения дополнительных подтверждающих тестов. Также не было получено данных в пользу носительства полиморфных вариантов гена панкреатического секреторного ингибитора трипсина (SPINK-1).
Результаты повторно проведенной ПЭТ/КТ с 18F-фтордезоксиглюкозой, проведенной через один год после паратиреоидэктомии, показали наличие признаков фиброзирующей остеодистрофии с уменьшением объема и метаболической активности очагов с преимущественно склеротическими изменениями (рис. 4).

Таким образом, представленный клинический случай демонстрирует позднюю диагностику ПГПТ, клинически проявлявшегося фиброзно-кистозным остеитом, у молодой женщины с неклассическим проявлением ПГПТ в виде кальцифицирующего панкреатита с развитием абсолютной недостаточности инсулина и СД.
ОБСУЖДЕНИЕ
Описанный клинический случай иллюстрирует, что ПГПТ у молодой женщины может быть одной из причин развития СД вследствие кальцифицирующего панкреатита. Очевидно, что СД у данной больной имел вторичный характер на фоне длительно существующей гиперкальциемии и кальцификации поджелудочной железы, что было подтверждено результатами иммунологического исследования и отсутствием антител к глутаматдекарбоксилазе.
Впервые на наличие панкреатита у больных ПГПТ обратил внимание Erdheim J. еще в 1903 г. С течением времени накопились не только доказательства взаимосвязи между ПГПТ и панкреатитом, но и появлялись данные, свидетельствующие о первичной роли ПГПТ [11]. Установлено, что встречаемость острого панкреатита среди больных ПГПТ составляет около 1,5% [6], и в настоящее время описано несколько возможных механизмов патогенеза его развития.
Во-первых, на фоне гиперкальциемии интенсифицированы процессы камнеобразования в выводных протоках поджелудочной железы, что провоцирует развитие обструктивного панкреатита [16]. Во-вторых, гиперкальциемия стимулирует процесс активации трипсиногена, в результате которого образуется трипсин, способный инициировать процессы ферментативного аутолиза поджелудочной железы [16]. Более новые экспериментальные исследования на моделях животных с ПГПТ подтвердили развитие альтерации ткани поджелудочной железы, гистологически характерной для острого панкреатита, а также преждевременной эктопической активации трипсиногена на фоне гиперкальциемии [15]. Вместе с тем определенную роль могут играть и молекулярно-генетические факторы. Так, описано, что миссенс мутация N34S в гетерозиготном состоянии гена SPINK 1 (serine protease inhibitor Kazal type 1) и гетерозиготные мутации F508del, R553X гена CFTR (cystic fibrosis transmembrane conductance regulator) ассоциированы с повышением риска развития острого панкреатита у пациентов с ПГПТ [17, 18].
Как известно, наличие панкреатита может не только проявляться нарушением экзокринной функции поджелудочной железы, но также в случае развития кальцифицирующего панкреатита ассоциироваться с повреждением клеток островков Лангерганса, развитием абсолютного дефицита инсулина и формированием СД, требующего инсулинотерапии. Если, по данным литературы, у лиц с хроническим панкреатитом распространенность нарушения толерантности к глюкозе составляет 60–70%, а СД – 30–40%, то наличие кальциноза поджелудочной железы дополнительно увеличивает риск последнего, вследствие чего СД может встречаться в 70% случаев [10].
В представленном клиническом случае множественные крупные остеолитические очаги в различных отделах скелета, анамнез панкреатита свидетельствуют о длительно не диагностированном заболевании, которое в условиях отсутствия генетических предикторов стало причиной преждевременных родов у пациентки М. и осложнений в виде судорожного синдрома в раннем периоде жизни ребенка. Данные осложнения, как известно, характерны для ПГПТ и встречаются у 13% беременных и у 25% детей, рожденных матерями с ПГПТ [19]; при этом их можно избежать при своевременной постановке диагноза и хирургическом лечении. Необходимо отметить тот факт, что изменения костной ткани в виде фиброзно-кистозного остеита хоть и выступают классическим проявлением ПГПТ, однако сохраняются лишь в некоторых странах, например в Индии, являясь в настоящее время редкостью для стран Европы и Северной Америки [4]. Вместе с тем следует отметить, что гистологическая и цитологическая картина так называемых бурых опухолей при фиброзно-кистозном остеите не отличается от изменений, типичных для остеобластокластомы, гигантоклеточной остеосаркомы; это может приводить к неправильному диагнозу и тактике ведения пациента [20]. К сожалению, в представленном случае мы видим именно такую трактовку результатов обследования и не только выжидательную тактику ведения пациентки, но и обсуждение вопроса о проведении полихимиотерапии.
Дополнительно к вышесказанному необходимо отметить, что в патогенезе семейных форм ПГПТ, а также развитии аденокарциномы ОЩЖ могут лежать мутации в ряде генов, а именно MEN1, CDC73, RET и CDKN1B. Доказано, что мутация гена MEN1 служит наиболее частой генетической причиной ПГПТ в рамках МЭН 1 синдрома [21]. Помимо этого, однонуклеотидные полиморфизмы гена CASR A986S (rs1081725) и R990G (rs1042636) ассоциированы с увеличением риска развития ПГПТ [22]. Учитывая, что выявленная в представленном клиническом случае мутация в гене SDHB (Chr1:17380507, rs11203289, NM 003000.2:c.C8T:p.Ala3Val) в гетерозиготном состоянии может рассматриваться как маркер множественной эндокринной неоплазии, включая наличие феохромоцитомы или параганглиомы [23, 24], больной было проведено дополнительное обследование и не получено данных в пользу наличия синдрома множественной эндокринной неоплазии (МЭН). Однако, мы полагаем, что в данной ситуации больная должна находиться под динамическим наблюдением для своевременной диагностики и лечения в случае появления других проявлений МЭН.
ЗАКЛЮЧЕНИЕ
Представленный случай развития СД на фоне кальцифицирующего панкреатита в рамках манифестной формы ПГПТ демонстрирует, что длительное течение ПГПТ, сопровождающееся поражением поджелудочной железы, может осложняться панкреатогенным СД. Несмотря на редкость такого проявления, сочетание классических признаков (фиброзно-кистозный остеит, преждевременные роды, осложнения гиперкальциемии в раннем послеродовом периоде со стороны новорожденного), а также анамнез хронического панкреатита с частыми обострениями должны вызвать настороженность практического врача в отношении ПГПТ и развития панкреатогенного СД, требующего своевременного назначения инсулинотерапии. Хочется отметить, что своевременная диагностика ПГПТ и его хирургическое лечение в III триместре беременности являются основными способами профилактики развития осложнений как со стороны матери, так и ребенка.


