ВВЕДЕНИЕ
Согласно международным согласительным документам (GOLD, 2021), хроническая обструктивная болезнь легких (ХОБЛ) является заболеванием, обусловленным изменениями в респираторных и бронхиальных отделах легкого, в клинической картине которого преобладают респираторные симптомы (продуктивный кашель, одышка), возникающие на фоне ограничения воздушного потока [1]. На выраженность обструктивного синдрома, безусловно, влияет присоединение вторичных инфекционно-воспалительных процессов.
Первоочередная роль в диагностике ХОБЛ принадлежит инструментальным методам исследования вентиляционной функции легких, позволяющим оценить степень бронхиальной обструкции [2, 3]. Вопрос информативности лучевых методов по сравнению с функциональными легочными пробами остается дискутабельным. Вместе с тем в ряде публикаций по оценке вентиляционной недостаточности у больных ХОБЛ отражена роль инспираторно-экспираторной компьютерной томографии (ИЭКТ) [4, 5]. Вторичная эмфизема относится ко второму варианту развития клинической картины ХОБЛ, который визуализируется при рентгенографии и компьютерной томографии (КТ) [6]. В публикациях последних лет сообщается, что визуальная качественная и количественная оценка эмфиземы при КТ служит методом анализа коморбидного фона, связанного с повышенным риском рака легкого [7–9].
Поскольку ХОБЛ – это болезнь людей старшего возраста, особое внимание при этой патологии должно уделяться сопутствующим состояниям и их влиянию на патогенетические особенности воспаления, клиническую картину и прогноз заболевания. Курение сигарет, выступая основным фактором риска развития ХОБЛ, также является и фактором риска развития рака легкого. Связь между обструктивными заболеваниями и раком легкого известна уже более четырех десятилетий [10]. Хотя причинно-следственная корреляция с курением очевидна и в прошлом была подтверждена множеством научных исследований, в последнее время интерес к этим проблемам возобновился. Однако анализ большинства публикаций не позволяет ответить на вопрос, является ли именно ХОБЛ непосредственным фактором риска развития рака легкого или же курение и неблагоприятные условия среды способствуют повышению вероятности этого неблагоприятного события [7].
Сочетание ХОБЛ и рака легкого, по данным разных исследований, встречается в 22–60% случаев [11–13]. Оно накладывает существенные ограничения на полноценное лечение каждого из этих заболеваний. Многие публикации свидетельствуют о том, что хронический обструктивный бронхит и эмфизема способствуют развитию рака легкого. Данные, полученные в результате скрининговых исследований, показали, что изменение архитектоники легочной ткани (эмфизема легких) у больных ХОБЛ часто встречается и при раке легкого [14–17]. Во многих публикациях изучалась роль ХОБЛ в развитии и прогнозировании исхода рака легкого, но полученные данные интерпретируются неоднозначно.
В связи с вышеизложенным представляется важным изучение влияния коморбидной обструктивной болезни на течение рака легкого, который продолжает оставаться наиболее частой причиной смерти у пациентов с онкологическими заболеваниями.
Целью нашего исследования стало определение взаимосвязи между функциональными и структурными изменениями у больных раком легкого с коморбидной ХОБЛ.
МАТЕРИАЛЫ И МЕТОДЫ
В наше исследование был включен 41 пациент с немелкоклеточным раком легкого (НМРЛ). Возраст больных варьировал от 38 до 83 лет, средний возраст составил 62,2±10,2 года (95% доверительный интервал (ДИ): 58,9–65,4). Из 41 пациента 27 (65,9%) были мужчины, 14 (34,1%) – женщины, соотношение по полу составило 1,9:1. Общая выборка пациентов с НМРЛ была упорядоченно распределена на две подгруппы (табл. 1):
- 27 (65,9%) пациентов с ХОБЛ, средний возраст 64±9,2 лет (95% ДИ: 60,4–67,6);
- 14 (34,1%) больных без ХОБЛ, средний возраст 58,6±11,4 лет (95% ДИ: 52–65,2).
Среди обследованных пациентов 24 (58,5%) были со стажем курения 13 и более лет. Их средний возраст составил 62,3±9,6 года (95% ДИ: 58,2–66,4). 17 (41,5%) больных не курили, их средний возраст был 61,9±11,3 года (95% ДИ: 56,1–67,7). В группе курящих преобладали мужчины (р=0,008).
Всем пациентам, вошедшим в исследование, для оценки внешнего дыхания проводились функциональные пробы на спирографе MasterScreen Pneumo, при этом были использованы рекомендации Американского торакального общества (ATS) / Европейского респираторного общества (ERS), принятые в 2005 г. Кроме того, всем больным выполнялась ИЭКТ грудной клетки на компьюторном томографе Somatom Definition AS. Аксиальные изображения ИЭКТ были дополнены мультипланарной реконструкцией. Анализу подверглись признаки клапанного вздутия («воздушные ловушки»), вид эмфиземы, утолщение стенок бронхов, участки пневмофиброза, средняя плотность легочной ткани на вдохе и на выдохе и градиент плотности (разница плотностей на вдохе и выдохе). Интерпретация качественных показателей осуществлялась двумя специалистами-рентгенологами.
Диагноз НМРЛ в 100% случае был подтвержден морфологически.
Статистическая обработка материала проводилась с использованием пакета прикладных программ IBM SPSS Statictics 23. Описание количественных данных были представлены в виде средневыборочного ± стандартного отклонения и 95% ДИ в случае нормального распределения в выборке или медианы (Ме) и квартилей Q1 и Q3 в формате Ме (Q1; Q3) в случае, если не было оснований для принятия гипотезы о нормальности распределения. Для проверки гипотезы о нормальности распределения применялся критерий Шапиро–Уилка. С целью обнаружения различий между пораженным и здоровым легким использовался критерий Стьюдента для зависимых выборок или критерий Вилкоксона (в зависимости от нормальности распределения). Для выявления возможной связи между показателями был проведен корреляционный анализ с определением коэффициента линейной корреляции Пирсона или ранговой корреляции Спирмена (r).
Результаты считали статистически значимыми при уровне p <0,05.
РЕЗУЛЬТАТЫ
Диагноз ХОБЛ был подтвержден у 27 (65,9%) пациентов с НМРЛ.
Тяжесть обструкции определялась в соответствии с международными согласительными документами: степень 1 – объем форсированного выдоха за 1-ю секунду (ОФВ1) 80%, степень 2 – 80–50%. Было установлено, что частота степени 2 обструкции (GOLD 2) была статистически значимо в 18,9 раз выше у курильщиков (95% ДИ: 2,2–167,3; р=0,002). Связь между степенью обструкции и фактом курения была статистически достоверной (р=0,002). Так, частота обструктивных нарушений в группе курящих была значительно выше, чем в группе некурящих (р=0,008), риск обструкции у курящих в 7,1 раз (95% ДИ 1,7–30,3) превышал таковой у некурящих пациентов (табл. 2).
Влияние факта курения на выраженность обструктивных нарушений также было подтверждено при выполнении ИЭКТ. В таблице 3 отражены изменения легочной ткани, полученные при выполнении этого метода исследования. В группе курильщиков томографические проявления поражения легочной ткани статистически не отличались от группы некурящих. Однако у курильщиков значимо выше (в 9,8 раз) был риск отклонения от нормы, чем у некурящих пациентов (95% ДИ: 1,7–55,3).
Нами не было выявлено статистически достоверных различий в степени структурных легочных изменений у пациентов с различной выраженностью обструкции (р >0,05).
При сравнении пораженного опухолью и «здорового» легкого было установлено, что существует отрицательная линейная связь между градиентом плотности легочной ткани на вдохе и выдохе и ОФВ1. Для стороны поражения она оказалась более значительной (r =-0,640; p <0,001), а для контралатеральной стороны – умеренной (r =-0,497; p=0,001; табл. 4).
Обращают на себя внимание различия в градиенте плотности выдоха в пораженном легком в зависимости от тяжести обструкции (табл. 5).
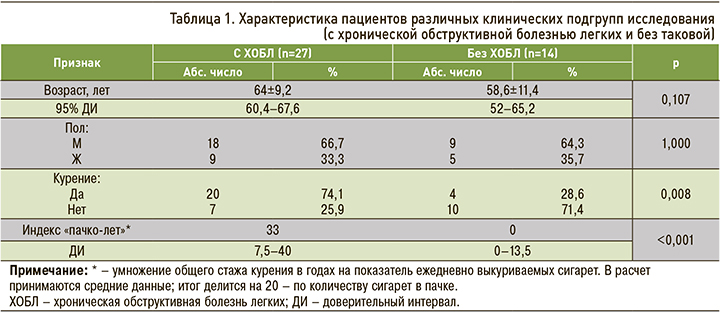
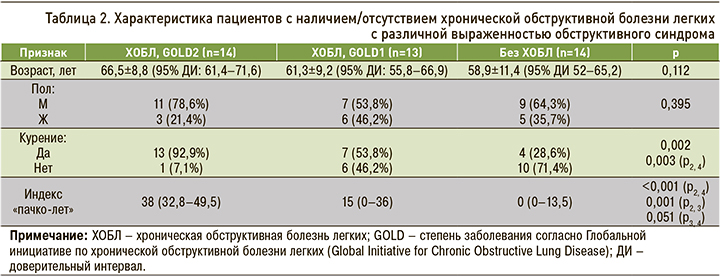
Корреляционный анализ показал наличие взаимосвязи градиента плотности и ОФВ1 от пола и факта курения (рис. 1 и 2).
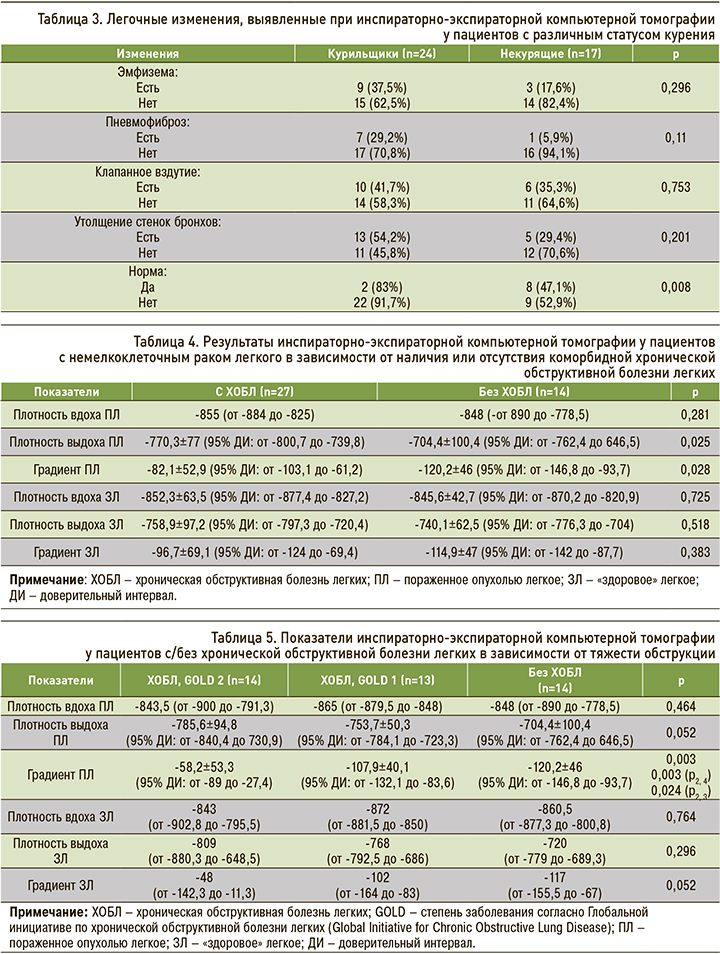
У мужчин средний градиент плотности был значительно снижен со стороны пораженного легкого и напрямую коррелировал с индексом «пачко-лет» (ρ=0,613; р=0,001). У женщин не наблюдалась связь между индексом и градиентом плотности (р=0,888), но была выявлена значительная корреляционная связь с ОФВ1 (ρ=-0,618; p=0,018). У мужчин корреляционная связь между ОФВ1 и индексом «пачко-лет» оказалась сильнее (ρ=-0,789; p <0,001; см. рис. 2).
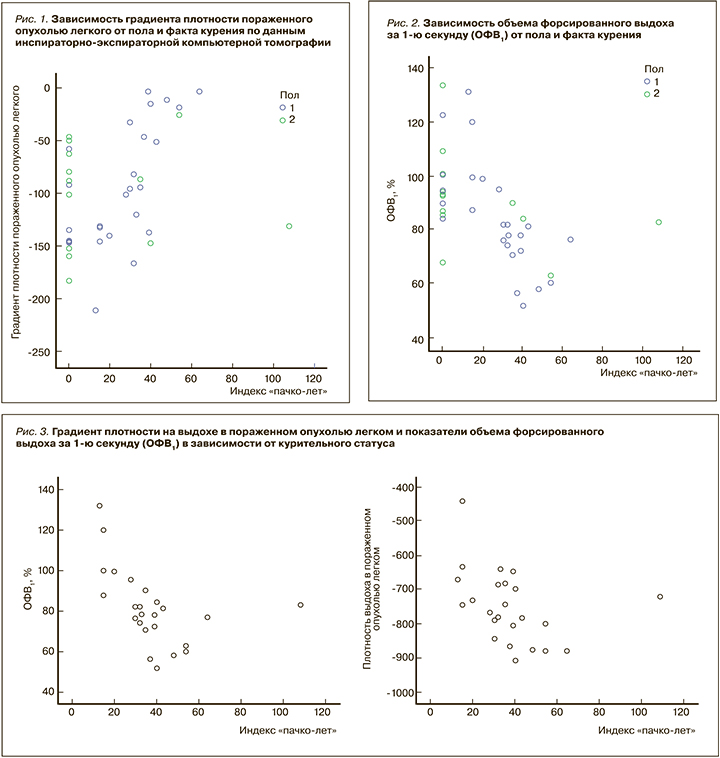
Кроме того, наблюдалась связь между индексом «пачко-лет» и ОВФ1 (ρ=-0,642; p=0,001), а также индексом «пачко-лет» и градиентом плотности на выдохе в пораженном легком (ρ=-0,518; p=0,01). Корреляции с градиентом плотности на вдохе в пораженном легком обнаружено не было (p=0,795; рис. 3).
ЗАКЛЮЧЕНИЕ
Результаты нашей работы позволили выявить корреляцию между состоянием функции внешнего дыхания и структурными изменениями легочной ткани, выявляемыми при ИЭКТ и спирометрии. Данное наблюдение имеет принципиальное значение для комплексной оценки функциональных резервов пациента перед выполнением хирургического этапа лечения опухолей легкого.
Так, ИЭКТ позволяет оценить изменения как со стороны пораженного опухолью легкого, так и с контралатеральной стороны для оценки резервных возможностей «здорового» легкого при планировании пульмонэктомии.
Кроме того, большая выраженность структурных изменений со стороны пораженной опухолевым процессом легочной ткани может быть следствием патогенетически значимых для карциногенеза процессов и служить предиктивным фактором возникновения опухоли у больных с ХОБЛ. Это, однако, требует дополнительного подтверждения в более крупных исследованиях.



