ВВЕДЕНИЕ
Вирус гепатита Е (HEV) был обнаружен в начале 1980-х гг., когда среди ограниченного контингента советских войск была зарегистрирована крупная вспышка острого вирусного гепатита «ни-А, ни-В». Чтобы доказать, что заболевание вызвано неизвестным вирусом, советский ученый М.С. Балаян выпил суммарный образец из фекалий инфицированных солдат, после чего у него развился острый гепатит. С помощью электронной микроскопии в фекалиях исследователя был обнаружен новый вирус [1], геном которого позднее был клонирован и получил название HEV [2].
HEV – это небольшой одноцепочечный РНК-вирус (HEV RNA – рибонуклеиновая кислота вируса гепатита Е), относящийся к семейству Hepeviridae. Существует несколько генотипов HEV: генотипы 1 и 2 выявляются только у человека и распространены преимущественно в эндемичных регионах – жарких странах; генотипы 3 и 4 относятся к антропозоонозным и встречаются как у людей, так и животных.
Инфекция, вызванная HEV, является наиболее распространенной среди острых вирусных гепатитов населения планеты [3–5]. Ежегодно в мире наблюдается не менее 20 млн случаев инфицирования HEV и 60 000 смертей от гепатита Е. HEV может служить причиной смерти почти у 30% беременных женщин [6]. Профилактическая вакцина против этой инфекции была разработана, но она лицензирована только в Китае, и по сути в настоящее время не существует эффективного, нетератогенного лечения ГЕ.
Пациенты с острым гепатитом Е спонтанно освобождаются от вируса. Однако примерно в 50% случаев у лиц со сниженным иммунитетом, получающих иммуносупрессивную терапию, после трансплантации солидных органов и тканей может развиться хронический гепатит Е (ХГЕ) [7–10], а при прогрессировании заболевания – и цирроз печени (ЦП).
Ниже мы приводим наше клиническое наблюдение больного ХГЕ с лимфомой Беркитта.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Пациент Д., 30 лет, кавказоид, болен с мая 2019 г., когда впервые стал отмечать быструю потерю веса, боли в животе, кашицеобразный стул. При комплексном обследовании выявлена опухоль слепой кишки, осложненная инвагинацией и кишечной непроходимостью. Выполнена лапароскопическая правосторонняя гемиколэктомия (03.07.2019) с последующим гистологическим и иммуногистохимическим исследованием слизистой оболочки илеоцекальной области. Установлен диагноз лимфомы Беркитта с поражением тонкой и толстой кишки, брыжейки толстой кишки, забрюшинных лимфоузлов, t (8;14) (q24; q32), Ki-67 >98%, стадия IVB.
Гистологических признаков лимфомы в пунктате костного мозга не найдено. При проведении позитронно-эмиссионной томографии/компьютерной томографии (ПЭТ/КТ) 12.07.2019 экстранодальные очаги не обнаружены.
Согласно клиническим рекомендациям, пациенту была начата полихимиотерапия (ПХТ) [11], проведение которой осложнилось развитием гепатотоксичности (десятикратное увеличение аминотрансфераз от верхней границы нормы), лабиального герпеса, мукозита в виде эрозивного поражения слизистой оболочки ротовой полости и глотки. Для коррекции нежелательных явлений дополнительно назначались бициклол, адеметионин, орнитин. С целью подавления реактивации герпетической инфекции был рекомендован длительный прием ацикловира (400 мг/сут).
При контрольной ПЭТ/КТ (сентябрь, 2020) отмечено прогрессирование процесса с лимфаденопатией в воротах печени, продолжена ПХТ. Сохранялась выраженная гиперферментемия в отсутствие гепатитов В и С (маркеры не обнаружены). Проведение 4-го курса ПХТ (октябрь, 2020) планировалось с последующей мобилизацией и аферезом стволовых клеток. Впервые в препаратах аутологичных стволовых клеток обнаружены РНК вируса гепатита Е (HEV RNA) и ДНК цитомегаловируса (СМV DNA). При ретроспективной оценке анамнеза заболевания, со слов пациента, после первого курса ПХТ в августе 2020 г. имел место эпизод потемнения цвета мочи и желтушности кожных покровов, который не получил должной интерпретации, поскольку пациент не сообщил лечащим врачам об этих симптомах, полагая, что они являются следствием проводимой терапии. С учетом гиперферментемии, регистрируемой в течение 3 мес у пациента с иммунодефицитным состоянием (лимфома) на фоне проводимой ПХТ, нельзя было исключить развитие ХГЕ, СМV-инфекции. Начата терапия рибавирином (РБВ) в дозе 800 мг/сут.
Пациент получил 7 курсов ПХТ (июль, 2019 – февраль, 2020). Терапию перенес удовлетворительно. В динамике проводилась ПЭТ/КТ, исследование костного мозга, ликвора. Признаков прогрессирования лимфомы не обнаружено. Однако при клинико-биохимическом мониторинге была выявлена выраженная лейкопения (табл.) со снижением содержания лимфоцитов до 9%, периодически наблюдавшаяся ранее в процессе ПХТ. Это послужило основанием для повторного введения гранулоцитарного колониестимулирующего фактора (ГКСФ) – липэгфилграстима – с целью стимуляции лейкопоэза.
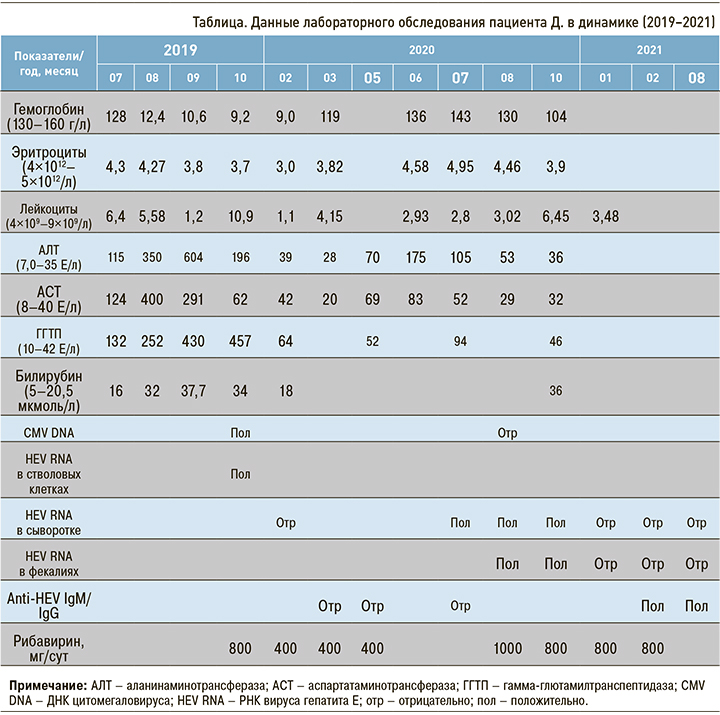
Эта нежелательная реакция, наиболее вероятно, была обусловлена проводимой ПХТ. Не исключено также, что РБВ способствовал развитию лейкопении/лимфоцитопении, хотя среди его негативных эффектов наиболее часто отмечается анемия [12]. Тем не менее, поскольку HEV RNA не определялась (после 4 мес терапии РБВ), а функциональные показатели печени нормализовались, было принято решение снизить дозу РБВ до 400 мг/сут и продолжить прием препарата пациентом еще в течение 8 нед. Аnti-HЕV IgM/IgG в сыворотке крови обнаружены не были (март, 2020).
Однако через 2 мес после завершения терапии РБВ было вновь отмечено увеличение активности аминотрансфераз (см. табл.), а в сыворотке крови и фекалиях пациента выявлена HEV RNA (июль, 2020). Было выполнено секвенирование по Сэнгеру полученной последовательности HEV RNA с использованием набора Applied Biosystems BigDie Terminator v3.1 Cycle Sequencing Kit. По результатам секвенирования данный HEV относится к 3-му генотипу.
Учитывая рецидив виремии HEV, была возобновлена терапия РБВ в дозе 1000 мг/сут. СMV DNA, антитела к вирусу иммунодефицита человека (ВИЧ) обнаружены не были.
Через 10 нед приема РБВ отмечено развитие нормохромной анемии легкой степени тяжести, увеличение содержания неконъюгированного билирубина (см. табл.). Гемолиз эритроцитов был исключен. Проведено молекулярно-генетическое исследование, выявившее полиморфизм rs8175347 в гомозиготном состоянии – генотип (ТА)7/(ТА)7, что свидетельствовало о синдроме Жильбера (СЖ). Ранее установлено, что СЖ у пациентов, получающих РБВ, может приводить к развитию нежелательных лекарственных реакций и межлекарственных взаимодействий вследствие нарушения синтеза ферментов, участвующих в их метаболизме; это приводит к повышению содержания билирубина [13]. Доза РБВ у пациента была уменьшена до 800 мг/сут.
Повторный курс РБВ в дозе 1000–800 мг/сут составил 8 мес. При контрольном исследовании зарегистрированы нормальные показатели трансаминаз и билирубина, HEV RNA в сыворотке крови и фекалиях пациента не обнаружена. Впервые выявлены аnti-HЕV IgМ/IgG, что свидетельствовало о достижении полного биохимического и вирусологического ответа. Наблюдение за пациентом продолжено.
ОБСУЖДЕНИЕ
Значительная распространенность ГЕ в мире и серьезные последствия, вызываемые HЕV, позволяют отнести эту инфекцию к серьезным, но недооцененным проблемам здравоохранения. У пациентов с ослабленным иммунитетом HEV может вызывать хронический гепатит, с высокой вероятностью – прогрессирование фиброза и, возможно, развитие ЦП [10].
Одно из первых описаний ХГЕ опубликовано в 2007 г. [14]. Авторы исследования протестировали 68 образцов сывороток крови на маркеры вирусов при неуточненной этиологии гепатита. Было выявлено 2 случая инфицирования HEV, один из которых обнаружен у пациента с Т-клеточной лимфомой, получавшего на фоне ПХТ переливания эритромассы. Установлен редкий для HEV парентеральный путь передачи. У больного наблюдалась длительная, более 6 мес, персистенция вируса (HEV RNA), при гистологическом исследовании в ткани печени была выявлена лимфоидноклеточная инфильтрация и фиброз. При этом пациент оставался негативным по anti-HEV в течение всего периода наблюдения.
В исследовании, проведенном у реципиентов трансплантата солидных органов, было показано, что спонтанный клиренс HEV происходит в течение первых 3 мес после инфицирования [15], а виремия, сохраняющаяся более 3 мес, может свидетельствовать о развитии ХГЕ [10]. Как правило, это пациенты с 3-м генотипом вируса [16]. Среди факторов риска развития ХГЕ указаны иммуносупрессивные состояния, трансплантация органов, низкое количество лимфоцитов при постановке диагноза, применение такролимуса [17].
РБВ служит препаратом выбора в лечении ХГЕ, однако его эффективность не оценивалась в плацебо-контролируемых исследованиях [18, 19]. Не отмечено различия в сроках формирования устойчивого вирусологического ответа (УВО) у тех, кто получал РБВ в течение 3 или ≥6 мес. Метаанализ, включивший 395 пациентов, показал, что сокращение приема иммуносупрессивных препаратов, а также терапия РБВ индуцируют клиренс HEV у 32 и 78% пациентов соответственно [20]. Было также установлено, что снижение концентрации HEV RNA ≥0,5 log10 МЕ/мл на седьмой день терапии РБВ является положительным прогностическим фактором развития УВО [19]. Напротив, определение вируса в фекалиях при не обнаруживаемой HEV RNA в сыворотке крови ассоциировалось с повышенным риском развития виремии после прекращения приема РБВ [21].
Поиск предикторов прогрессировании фиброза также показал, что у иммунокомпрометированных пациентов с ВИЧ-инфекцией определенное значение в развитии ХГЕ имеет снижение количества CD8+ [22].
В недавно выполненном исследовании отмечено увеличение гетерогенности HEV на фоне приема РБВ, что, по-видимому, может приводить к резистентности или рецидивам инфекции [23, 24]. Глубокое секвенирование выявило несколько мутаций HEV RNA. Так, мутация G1634R в полимеразе HEV, возможно, повышает репликативную компетентность генома HEV и, как было показано, придает устойчивость к лечению РБВ [24], которая преодолевается при увеличении дозы препарата или продолжительности терапии [25].
Установлено, что резистентность к РБВ связана с ассоциацией мутаций Y1320H, K1383N и G1634R в вирусной полимеразе HEV, а также со вставкой в HVR, содержащей дупликацию и фрагмент полимеразы [26].
До сих пор неизвестны оптимальные дозы и длительность лечения РБВ. Препарат может вызывать нежелательные явления в виде развития дозозависимой анемии, сухого кашля, кожной сыпи, повреждения почек, что требует проведения тщательного мониторинга при его использовании. Кроме того, РБВ обладает высокой тератогенностью и не может применяться у определенных групп пациентов (в частности, у беременных женщин, инфицированных 1-м генотипом HEV). При наличии противопоказаний к приему РБВ в качестве меры снижения виремии у пациентов с ХГЕ может быть рекомендовано уменьшение дозы иммуносупрессивных препаратов [25]. Для лечения ХГЕ также предлагается использование сочетания РБВ с интерферонами, софосбувиром [27, 28].
ЗАКЛЮЧЕНИЕ
Нами впервые описан случай ХГЕ на территории России. Несмотря на то что случаи острой инфекции HEV часто проходят бессимптомно, пациенты, получающие иммуносупрессивную терапию, имеют более высокий риск развития хронической инфекции, вызванной HEV, и это может приводить к тяжелым поражениям печени. Поскольку у таких пациентов нередко антитела к HEV не детектируются, единственно надежным диагностическим тестом служит обнаружение HEV RNA, а применение РБВ – предпочтительным методом противовирусного лечения. Продолжительность терапии должна определяться мониторингом наличия HEV RNA в образцах сыворотки крови и фекалиях [9, 18, 29].


