ВВЕДЕНИЕ
Вирус SARS-CoV-2, возбудитель новой коронавирусной инфекции COVID-19, способен заражать любые возрастные группы; тяжесть течения заболевания и клиническая симптоматика отличаются достаточно высокой вариабельностью. По данным метаанализа 212 исследований (11 стран/регионов, n=281 461), средний возраст пациентов с COVID-19 составил 46,7 года, тяжелое течение было отмечено у 23%, а уровень смертности достигал 5,6% [1]. Согласно результатам анализа данных Китайского центра по контролю и профилактике заболеваний, минимальная распространенность COVID-19 наблюдается у пациентов в возрасте до 19 (1%) и старше 80 лет (3%); основная доля случаев заболевания приходилась на группу пациентов от 30 до 79 лет – 87% [2]. В этом же исследовании доля пациентов с тяжелым течением COVID-19 составила 14%, критическим – 5%, летальный исход был зафиксирован в 2,3% случаев.
Анализ 1 320 488 случаев COVID-19 в США продемонстрировал, что среди сопутствующих болезней у пациентов с этой инфекцией преобладали сердечно-сосудистая патология (32%), сахарный диабет (30%) и хронические заболевания дыхательной системы (18%). Доля госпитализированных пациентов равнялась 14%, из них 2% поступило в отделения реанимации и интенсивной терапии (ОРИТ); смертность при этом регистрировалась на уровне 5% [3].
Тяжелое течение COVID-19 включает прежде всего поражение нижних отделов дыхательных путей и манифестирует в виде двустороннего вирусного поражения легких. Частым спутником тяжелого течения становится острый респираторный дистресс-синдром (ОРДС) [4, 5]. В случае развития ОРДС уровень смертности может превышать 88% [6, 7]. В метаанализе, вобравшем материалы международных баз данных (10 815 случаев ОРДС у пациентов с COVID-19), общая оценка смертности составила 39% (95% доверительный интервал (ДИ): 23–56%). При анализе отдельных стран аналогичный показатель для Китая составил 69% (95% ДИ: 67–72%), для Польши – 73% (95% ДИ: 58–86%), для Германии – 13% (95% ДИ: 2–29%) [8].
В основе тяжелого течения COVID-19, сопровождающегося развитием ОРДС, лежит гипертрофированная реакция со стороны систем как врожденного, так и приобретенного иммунного ответа. Метаанализ 83 исследований позволил обнаружить, что для пациентов с тяжелым течением COVID- 19 были характерны значительно более высокие уровни С-реактивного белка (СРБ), скорости оседания эритроцитов, прокальцитонина (ПКТ), интерлейкина 6 (ИЛ-6), ИЛ-10, ИЛ-2R, сывороточного амилоида A и отношения нейтрофилов к лимфоцитам [9]. Была продемонстрирована связь высоких уровней маркеров воспаления при COVID-19 с худшим конечным прогнозом (ферритин, p <0,001; CРБ, р <0,001; ИЛ-6, р=0,007; ПКТ, р=0,005; молочная кислота, р=0,004) [10].
Основным эффективным терапевтическим инструментом воздействия в случае «цитокинового шторма» являются глюкокортикостероиды (ГКС), в частности дексаметазон и метилпреднизолон [11–13]. Вместе с тем, согласно результатам Кохрановского обзора (11 рандомизированных клинических исследований, n=8075), существуют лишь доказательства среднего уровня достоверности, свидетельствующие в пользу снижения смертности от всех причин у госпитализированных пациентов с COVID-19, и доказательства с низким уровнем достоверности, свидетельствующие о сокращении числа дней без искусственной вентиляции легких (ИВЛ) на фоне применения ГКС [14]. Фармакологическое вмешательство в механизмы функционирования иммунной системы и соответствующие изменения его параметров были эффективными в случае назначения препаратов на основе моноклональных антител к рецепторам ИЛ-6 – левилимаба [15], тоцилизумаба [16], сарилумаба [17]. В соответствии с современными представлениями оптимизация стратегии вмешательства в иммунные процессы может включать не только их ингибирование, но и стимулирующее воздействие [18].
Азоксимера бромид (Полиоксидоний®) представляет собой высокомолекулярный синтетический иммуномодулятор с комплексным механизмом действия, включающим активацию гуморального и клеточного звеньев иммунитета, антиоксидантный и дезинтоксикационный эффекты, и благоприятным профилем безопасности [19–21]. В работах отечественных ученых была продемонстрирована эффективность применения этого препарата у госпитализированных пациентов с COVID-19 [22, 23], равно как и его потенциал в ведении больных с пневмониями [24–26]. Исходя из положительного опыта применения азоксимера бромида, показанного в соответствующих работах, нами было решено провести свое исследование эффективности включения этого лекарственного средства в терапию пациентов с тяжелым течением COVID-19, госпитализированных в ОРИТ.
Цель исследования – оценка эффективности включения азоксимера бромида в схему стандартного ведения пациентов с тяжелым течением COVID-19, осложненного развитием двустороннего полисегментарного вирусного поражения легких, в условиях ОРИТ.
МАТЕРИАЛ И МЕТОДЫ
На базе ГБУЗ «Городская клиническая больница № 24 Департамента здравоохранения города Москвы» было проведено открытое нерандомизированное обсервационное одноцентровое проспективное исследование эффективности включения азоксимера бромида (Полиоксидоний®) в комплексную терапию пациентов, госпитализированных в ОРИТ с новой коронавирусной инфекцией COVID-19 (вирус идентифицирован) и двусторонним полисегментарным вирусным поражением легких (первый этап работы). Включение пациентов осуществлялось последовательным образом.
Исследование выполнялось в соответствии со всеми применимыми законами и нормативными актами, включая рекомендации Международного совета по гармонизации надлежащей клинической практики (ICH-GCP) и этические принципы, регламентируемые Хельсинкской декларацией. Исследование носило наблюдательный характер и включало пациентов в возрасте от 41 до 86 лет, госпитализированных в стационар в период с 30.09 по 31.11.2021. Назначение препарата Полиоксидоний врачебным консилиумом производилось в соответствии с официальной инструкцией по медицинскому применению. Все пациенты подписали форму добровольного информированного согласия.
Для осуществления сравнительного анализа полученных результатов на втором этапе было выполнено рандомизированное ретроспективное фармакоэпидемиологическое исследование, включавшее данные госпитализированных в ОРИТ пациентов с тяжелым течением COVID-19 и двусторонним полисегментарным вирусным поражением легких, получавших стандартную терапию (рандомизация методом случайных чисел). Критерии включения на обоих этапах исследования: госпитализированные в ОРИТ мужчины и небеременные женщины с подтвержденным методом полимеразной цепной реакции (ПЦР) диагнозом COVID-19, осложненным двусторонней полисегментарной вирусной пневмонией тяжелого и крайне тяжелого течения. Сравнительный анализ содержал данные двух групп: исследуемой (пациенты, включенные в проспективное исследование и получавшие стандартную терапию + Полиоксидоний 6 мг 3 раза/сут внутримышечно в течение 4 дней) и контрольной (пациенты на стандартной терапии, изученные в рамках рандомизированного ретроспективного фармакоэпидемиологического исследования). Стандартная терапия определялась лечащим врачом в соответствии с действовавшими на момент проведения исследования Временными методическими рекомендациями «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)» (версия 13 от 14.10.2021) [27].
В качестве первичных конечных точек исследования использовались показатели (%) летальных исходов, доли пациентов с развитием осложнений (ОРДС, тромбоэмболия легочной артерии, гидроторакс, полиорганная недостаточность, сепсис, септический шок), с потребностью в ИВЛ, неинвазивной ИВЛ (НИВЛ) и высокопоточной оксигенотерапии (ВПО) во время терапии в ОРИТ. Вторичные конечные точки включали данные динамики лабораторных данных (ферритин, С-реактивный белок, лактатдегидрогеназа, число лейкоцитов крови, абсолютное число лимфоцитов крови).
Статистический анализ выполнялся с использованием методов описательной статистики (среднее, стандартное отклонение (SD), медиана, межквартильный размах (IQR), min, max).
РЕЗУЛЬТАТЫ
Характеристики контрольной (n=20) и исследуемой (n=12) групп представлены в таблице 1.
100% пациентов обеих групп с первых суток госпитализации получали противовирусную терапию (ремдесивир), препараты для лечения «цитокинового шторма» (левилимаб, дексаметазон), будесонид в виде ингаляций через небулайзер, антикоагулянтную терапию (далтепарин натрия). После верификации сопутствующей бактериальной инфекции пациентам назначалась антибактериальная терапия (АБТ). В исследуемой группе АБТ включала бета-лактамные антибиотики (100%, n=12), фторхинолоны (66,7%, n=8), оксазолидиноны (33,3%, n=4), гликопептиды (25%, n=3), аминогликозиды (16,7%, n=2), макролиды (16,7%, n=2). В контрольной группе пациентам назначались те же классы противомикробных средств, но с иной частотой: бета-лактамные антибиотики – 70% (n=14), фторхинолоны – 60% (n=12), аминогликозиды – 40% (n=8), макролиды – 25% (n=5), оксазолидиноны – 5% (n=1), гликопептиды – 15% (n=3).
В исследуемой группе Полиоксидоний назначался в среднем на 12,9-е сутки госпитализации после выполнения всех требований временных методических рекомендаций [27] и введения анти-ИЛ-6 препаратов и ГКС (в среднем на 3,6-е сутки пребывания в ОРИТ). Обязательным условием назначения препарата была нормализация (или тенденция к нормализации) показателей сывороточного ИЛ-6.
На момент поступления в ОРИТ пациенты исследуемой и контрольной групп имели выраженное поражение легочной ткани: двустороннее полисегментарное вирусное поражение легких, КТ 4 – у 40% пациентов в контрольной группе и у 25% в исследуемой. За время госпитализации у пациентов сформировались дополнительные осложнения, приведенные в таблице 2. Летальный исход был зарегистрирован у 65% пациентов контрольной группы против 50% в исследуемой группе. Средняя длительность госпитализации была выше в исследуемой группе (26,5 против 16,8 сут в контрольной группе), что связано с большим числом выживших пациентов. Средний возраст выживших в исследуемой группе составил 74,3+10,6 против 62,0+20,3 лет в контрольной.
В анализ были включены данные лабораторных параметров пациентов исследуемой группы, полученные в следующих временных точках:
- 1 – на момент госпитализации (1-е сутки);
- 2 – перед назначением первой дозы препарата Полиоксидоний;
- 3 – последний анализ перед выпиской/летальным исходом.
В контрольной группе для анализа были также использованы лабораторные данные, определенные в трех точках: 1 – на момент госпитализации; 2 – в срок, приближенный к сроку получения Полиоксидония в исследуемой группе (среднее значение – 9,5 сут для контрольной группы и 9,8 сут для исследуемой); 3 – последний анализ перед выпиской/летальным исходом.
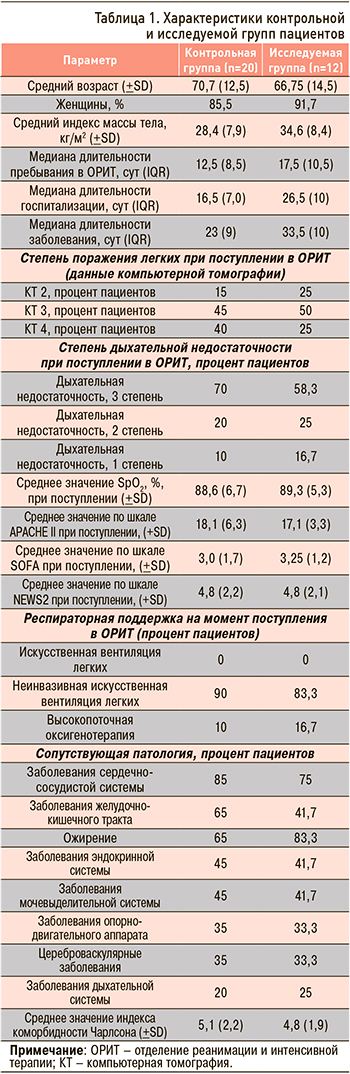
Анализ динамики средних значений ферритина обнаружил схожие тенденции роста на протяжении госпитализации в обеих группах (рис. 1). Доля пациентов с подъемом ферритина в точке 3 в сравнении с точкой 1 в контрольной группе составила 55%, в исследуемой – 58%. Прирост среднего уровня ферритина в точке 3 в сравнении с точкой 1 в среднем равнялся 152% в контрольной группе и 112% – в исследуемой.
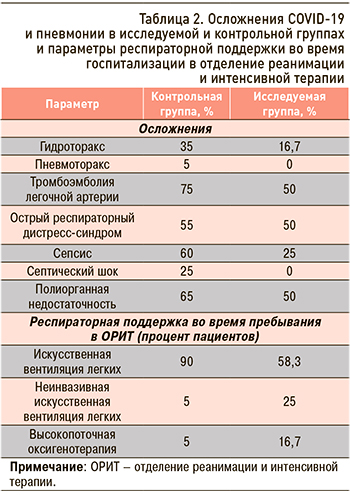
Среднее значение и медиана лактатдегидрогеназы (ЛДГ) в исследуемой группе обнаружили тенденцию к снижению величин за время госпитализации на фоне стабильного роста показателя в контрольной группе (рис. 2). Доля пациентов с увеличением уровня ЛДГ в точке 3 относительно исходного значения в точке 1 в контрольной группе составила 70%, в исследуемой – 41,7%. Прирост значения ЛДГ в точке 3 в сравнении с точкой 1 достиг в среднем 53% в контрольной группе против 18,9% в исследуемой.
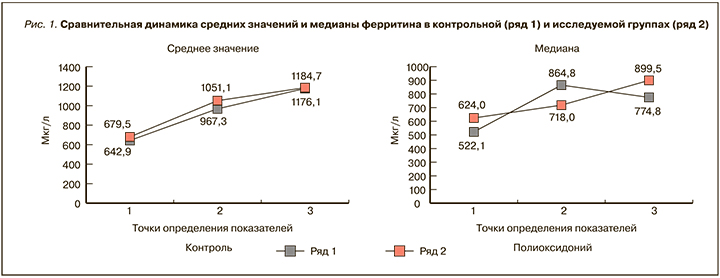
Среднее значение и медиана СРБ в исследуемой и контрольной группах характеризовались схожей динамикой роста в трех проанализированных точках (рис. 3). Доля пациентов с подъемом СРБ в точке 3 в сравнении с точкой 2 в контрольной группе составила 25%, в исследуемой – 41,7%.
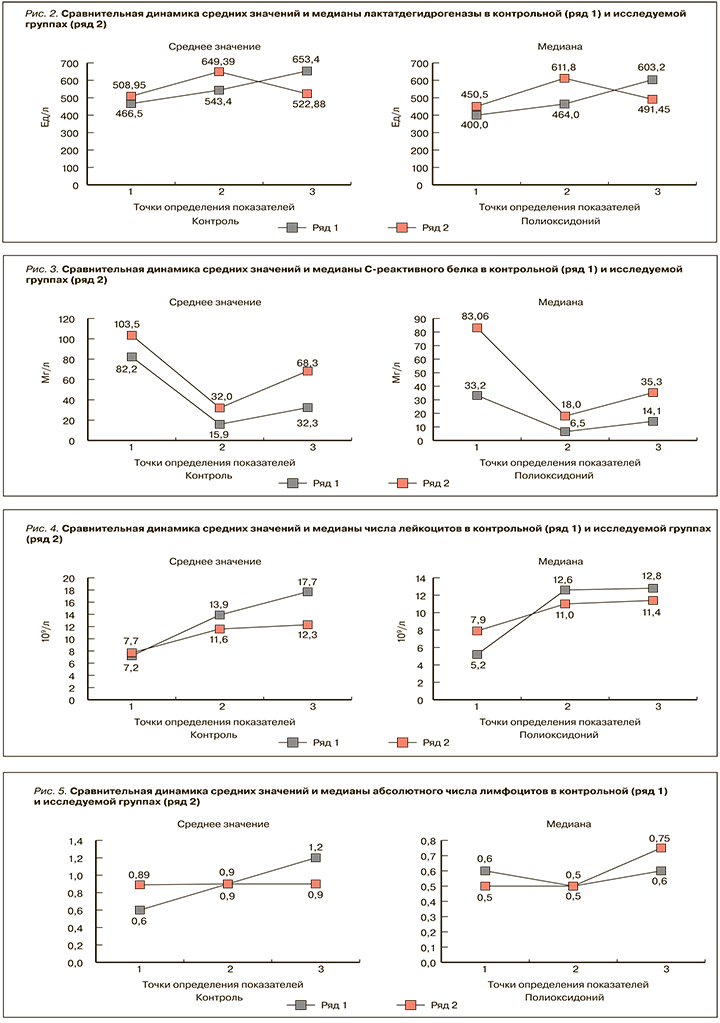
Лейкоцитоз был более выражен в точке 3 в контрольной группе, несмотря на более низкие значения числа лейкоцитов крови на момент поступления (рис. 4). Доля пациентов с ростом числа лейкоцитов крови в точке 3 в сравнении с точкой 2 составила в контрольной группе 95 против 66,7% в исследуемой. Средний прирост числа лейкоцитов в контрольной группе достиг 227,2%, в исследуемой – 98,6%.
Абсолютное число лимфоцитов продемонстрировало больший рост среднего значения в контрольной группе (рис. 5). Тем не менее ненормальное распределение признака в данном случае делает более репрезентативным значение медиан, динамика которых обнаруживает более выраженный рост у пациентов исследуемой группы.
ОБСУЖДЕНИЕ
Пациенты контрольной и исследуемой групп, включенные в наше исследование, принадлежали преимущественно к категории пожилых: средний возраст – 70,7 (+12,5) и 66,75 (+14,5) лет соответственно. Пожилой возраст является одним из основных факторов риска тяжелого течения COVID-19 и летального исхода [28–31].
В метаанализе Katzenschlager S. et al. (2021), включившем 88 исследований и 69 762 пациента, было установлено, что среди сопутствующей патологии наиболее значимую ассоциацию с поступлением в ОРИТ и с летальным исходом имела цереброваскулярная патология: отношение шансов (ОШ) 5,88 (95% ДИ: 2,35–14,73) и 3,45 (95% ДИ: 2,42–4,91) соответственно [31]. Согласно нашим данным, приблизительно треть всех пациентов как в контрольной (35%), так и в исследуемой (33,5%) группе имела различные хронические нарушения мозгового кровотока. Наиболее распространенной сопутствующей патологией в нашем исследовании были заболевания сердечно-сосудистой системы (у 85% пациентов в контроле и 75% в исследуемой группе), среди которых лидировала гипертоническая болезнь (100% в контрольной группе и 95% в исследуемой).
Представляют интерес результаты метаанализа, включившего 45 метаанализов, демонстрирующих, что вероятность тяжелого течения COVID-19 у пациентов с сердечно-сосудистыми заболеваниями выше более чем в 3 раза; при этом шансы на тяжелое течение COVID-19 более чем в 2,5 раза выше у гипертоников по сравнению с пациентами с нормальными значениями артериального давления [32].
Наши результаты обнаружили широкую распространенность хронических заболеваний эндокринной системы (45% в контрольной группе и 41,7% в исследуемой) с преобладанием сахарного диабета 2-го типа (85 и 95% соответственно). Ожирение присутствовало у 65% пациентов контрольной и у 83,3% пациентов исследуемой группы. По данным систематического обзора и метаанализа, охватившего 41 исследование (n=21 060), тяжелое течение COVID-19 связано с наличием ожирения (ОШ: 1,89; 95% ДИ: 1,44–2,46), артериальной гипертензии (ОШ: 2,42; 95% ДИ: 2,03–2,88), сахарного диабета (ОШ: 2,40; 95% ДИ: 1,98–2,91), ишемической болезни сердца (ОШ: 2,87; 95% ДИ: 2,22–3,71), хронической болезни почек (ОШ: 2,97; 95% ДИ: 1,63–5,41), цереброваскулярных заболеваний (ОШ: 2,47; 95% ДИ: 1,54–3,97), хронической обструктивной болезни легких (ОШ: 2,88; 95% ДИ: 1,89–4,38), злокачественных новообразований (ОШ: 2,60; 95% ДИ: 2,00–3,40) и хронических заболеваний печени (ОШ: 1,51; 95% ДИ: 1,06–2,17) [29].
Влияние ожирения на течение новой коронавирусной инфекции также было продемонстрировано в метаанализе 22 исследований из 7 стран Северной Америки, Европы и Азии: его наличие было связано с более высоким риском развития тяжелой симптоматики при COVID-19 (ОШ: 3,03; 95% ДИ: 1,45–6,28; р=0,003; 4 исследования, n=974), ОРДС (ОШ: 2,89; 95% ДИ: 1,14–7,34; р=0,025; 2 исследования, n=96), с большей потребностью в госпитализации (ОШ: 1,68; 95% ДИ: 1,14–1,59; р <0,001; 4 исследования, n=6611), большим риском поступления в ОРИТ (ОШ: 1,35; 95% ДИ: 1,15–1,65; р=0,001; 9 исследований, n=5298) и большей частотой проведения ИВЛ (ОШ: 1,76; 95% ДИ: 1,29–2,40; р <0,001; 7 исследований, n=1558) [33]. Таким образом, профиль пациентов, включенных в наше исследование, полностью соответствовал типичному профилю пациентов с тяжелым течением COVID-19 и высоким риском летального исхода.
Доля выживших пациентов в контроле составила 35 против 50% в исследуемой группе, что сопровождалось большей длительностью госпитализации в последнем случае. По данным обсервационного исследования, оценивавшего исходы у реанимационных пациентов с тяжелым течением COVID- 19, продолжительность госпитализации в случае выживших значительно превышала таковую для умерших пациентов; было отмечено снижение смертности в случае продолжительности жизни более 24 ч (0,412; 95% ДИ 0,173–0,982; р=0,045) [34]. Результаты работы Rahim F. et al. (2020) продемонстрировали общий уровень смертности пациентов, равный 77%, при этом неинвазивная ИВЛ применялась у 61,8%. Смертность значительно возрастала у пациентов с ИВЛ (93,6 против 66,7%; р <0,001) и больных старше 60 лет (87,3 против 72,3%; р=0,019); у пациентов без сопутствующей патологии этот показатель составлял 75,2%, а при наличии одного сопутствующего заболевания увеличивался до 79,7% [34].
В контрольной группе за время нахождения в ОРИТ доля пациентов, потребовавших ИВЛ, оказалась равной 90 против 58,3% в исследуемой группе на фоне частоты развития ОРДС в 55 и 50% случаев соответственно. Гидроторакс развился у 35% пациентов контрольной группы и 16,7% исследуемой группы, ТЭЛА – у 75 и 50% соответственно, сепсис и полиорганная недостаточность – у 65 и 25% соответственно. Согласно опубликованным данным, частота ОРДС у пациентов с COVID- 19 весьма вариабельна: так, в исследовании Wu C. et al. (2020) она равнялась 41,8% [35], тогда как, по данным обзора Tzotzos S.J. et al. (2020), встречаемость этого осложнения среди пациентов, госпитализированных в ОРИТ, достигала 75%, причем потребность в ИВЛ составила 63% [36]. Продемонстрированная в нашем исследовании частота развития ТЭЛА как в контрольной, так и в исследуемой группе превосходит ранее опубликованные данные: в работе Leonard-Lorant I. et al. (2020) развитие этого осложнения было выявлено у 30% пациентов [37], а по данным Poyiadji N. et al. (2020), – у 22% [38]. Согласно результатам объединенного анализа 9 исследований (n=3066), совокупная распространенность ТЭЛА составила 15,8% (95% ДИ: 6,0–28,8%, I2=98%), для пациентов <65 лет это значение возрастало до 20,5% (95% ДИ: 17,6–24,8%). В одноцентровых исследованиях распространенность ТЭЛА равнялась 12,9% (95% ДИ: 1,0–30,2%), в многоцентровых – 19,5% (95% ДИ: 14,9–25,2%; p <0,05) [39].
Отмеченная в нашем исследовании частота сепсиса составила 65% для контрольной группы и 25% для исследуемой, при этом септический шок наблюдался только у пациентов контрольной группы (25%). Распространенность инфекций кровотока у пациентов с тяжелым течением COVID- 19, по результатам многоцентрового ретроспективного исследования, достигала 34% [40]. По данным Ketcham S.W. et al. (2021), септический шок как причина смерти выявлялся у 40,2% с COVID-19 [41]. В свою очередь, по данным Bardi T. et al. (2021), у пациентов с тяжелым течением COVID- 19, госпитализированным в ОРИТ, септический шок встречался с частотой 60% [42].
Полиорганная недостаточность у пациентов, согласно нашим результатам, имела место в 65% случаев в контрольной группе и в 50% – в исследуемой. В работе Ketcham S.W. et al. (2021) распространенность данного осложнения как причины летального исхода составила 67,1%.
Полученные в нашем исследовании результаты продемонстрировали увеличение доли выживших пациентов в группе, получавшей Полиоксидоний, на фоне значительно меньшего числа эпизодов сепсиса, отсутствия развития септического шока и меньшей потребности в ИВЛ. Возможным объяснением этому может быть отмеченное в исследуемой группе изменение динамики маркеров и медиаторов воспаления. Так, анализ средних значений и медиан ЛДГ продемонстрировал уверенную тенденцию к их снижению после назначения препарата Полиоксидоний: при анализе данных в точках 2 и 3 (см. рис. 2) среднее значение ЛДГ уменьшилось на 19,5%. В контрольной группе, напротив, при анализе средних значений в точках 2 и 3 (см. рис. 2) был отмечен рост этого показателя на 20,2%. Напомним, что ЛДГ играет ключевую роль в качестве маркера тяжелого течения COVID- 19, который также может быть использован в качестве предиктора летального исхода [43, 44]. Согласно результатам метаанализа 21 исследования (n=10 399), возрастание концентрации ЛДГ было характерно для 44% (34–53%) пациентов с COVID-19; с повышенным уровнем этого маркера коррелировали диабет (ОШ: 1,01; 95% ДИ: 1,00–1,02; р=0,038), мужской пол (р=0,068) и артериальная гипертензия (р=0,969). Метаанализ показал, что повышенный уровень ЛДГ был связан с комбинированным плохим исходом (ОШ: 5,33; 95% ДИ: 3,90–7,31; p <0,001; I2: 77,5%) и увеличивал смертность (ОШ: 4,22; 95% ДИ: 2,49–7,14, p <0,001; I2=89%) [45]. В метаанализе Huang Y et al. (2021) было обнаружено, что именно повышенный уровень ЛДГ максимально увеличивает риск тяжелого течения COVID-19 (OШ:8,33; 95% ДИ: 1,75–39,69) [46].
Следующим лабораторным параметром, продемонстрировавшим выраженную положительную динамику в исследуемой группе, было число лейкоцитов крови. После назначения препарата Полиоксидоний в исследуемой группе была обнаружена стабилизация средних значений и медиан этого показателя без дальнейшего роста. Средний прирост числа лейкоцитов за время госпитализации в исследуемой группе составил 98,6 против 227,2% в контроле. Опубликованные ранее работы подтверждают однозначное отрицательное прогностическое значение лейкоцитоза для исходов пациентов с COVID-19 [46–49]. Параллельно с лейкоцитозом литературные данные свидетельствуют о признании лимфопении как еще одного маркера тяжелого течения заболевания и отрицательных исходов [47, 48]. В нашем исследовании динамика медианных значений обнаружила тенденции к увеличению абсолютного числа лимфоцитов на момент окончания госпитализации, которые были более выражены в случае исследуемой группы. В группе азоксимера бромида отмечалось повышение уровня лимфоцитов у выживших пациентов. Систематический обзор и метаанализ Zhao Q. et al. (2020) показали, что лимфопения характерна для пациентов с тяжелой формой COVID-19 (медианная разница, MD: -0,31×109/л; 95% ДИ: от -0,42 до -0,19×109/л), ее присутствие было ассоциировано с почти трехкратным увеличением риска тяжелого течения COVID-19 (модель случайных эффектов, ОШ: 2,99; 95% ДИ: 1,31–6,82) [50]. Связь лимфопении с летальным исходом, ОРДС и госпитализацией в ОРИТ была установлена в метаанализе Huang I. et al. (2020) [51]. В исследовании Toori K.U. et al (2021) была выявлена значительная связь между лимфопенией и тяжестью COVID-19, а также смертностью (<0,001); регрессионный анализ продемонстрировал, что лимфопения служит предиктором тяжести заболевания (<0,001) [52].
Среди типичных маркеров тяжелого течения COVID-19 и высокого риска летального исхода, согласно литературным данным, присутствуют СРБ и ферритин [46, 47, 53–55]. В нашем исследовании среднее значение ферритина продемонстрировало рост на момент окончания госпитализации как в исследуемой, так и в контрольной группах. Уровень СРБ на момент окончания госпитализации снизился в 2,35 раза по сравнению с исходным в обеих группах. Интересен при этом факт исходно более высокого среднего уровня СРБ в исследуемой группе (103,5 против 82,2 мг/л в контроле), что обычно коррелирует с большим риском летального исхода. При этом наши результаты продемонстрировали меньшую долю умерших пациентов при назначении препарата Полиоксидоний – 50 по сравнению с 65% в контрольной группе.
Возможными ограничениями данного исследования являются малый размер выборки пациентов и высокая вариабельность показателей лабораторных данных.
ЗАКЛЮЧЕНИЕ
Применение препарата Полиоксидоний в комплексной терапии госпитализированных в ОРИТ пациентов с тяжелым течением COVID-19, осложненным развитием двустороннего полисегментарного вирусного поражения легких, способно улучшать прогноз, снижая частоту развития сепсиса, септического шока и потребность в ИВЛ. Требуются дальнейшие исследования для получения свидетельств направленного положительного влияния этого препарата на прогноз у критически больных пациентов с COVID-19.


