ВВЕДЕНИЕ
Гипертрофическая кардиомиопатия (ГКМП) является аутосомно-доминантным заболеванием, которое приводит к гипертрофии левого желудочка (ЛЖ) и вызывает множество осложнений, включая обструкцию выносящего тракта ЛЖ (ВТЛЖ), диастолическую дисфункцию ЛЖ, ишемию миокарда, сердечную недостаточность, что повышает риск внезапной смерти. Распространенность ГКМП составляет 1:500 [1, 2].
В настоящее время нарушение кровообращения в ЛЖ и нарушения ритма играют основополагающую роль в развитии осложнений у больных ГКМП, при этом желудочковые аритмии становятся основной причиной внезапной сердечной смерти, особенно у молодых пациентов с этим заболеванием [3, 4].
Фибрилляция предсердий (ФП) – наиболее частая устойчивая аритмия при ГКМП. Ее распространенность зависит от степени гипертрофии, динамической обструкции и диастолической дисфункции ЛЖ и встречается примерно у 25% пациентов с ГКМП с частотой 3% в год [5, 6].
Своевременная диагностика и лечение ФП, а также профилактика ее рецидивов необходимы для улучшения как качества жизни, так и клинических исходов у пациентов с ГКМП, у которых она развивается, поскольку данные больные имеют более высокий уровень смертности и риск таких осложнений, как кардиоэмболический инсульт, функциональные нарушения, декомпенсация сердечной недостаточности [7, 8]. Было показано, что правильное лечение ФП с применением антикоагулянтной терапии, антиаритмических препаратов, катетерной абляции и миэктомии имеет большой успех в уменьшении осложнений.
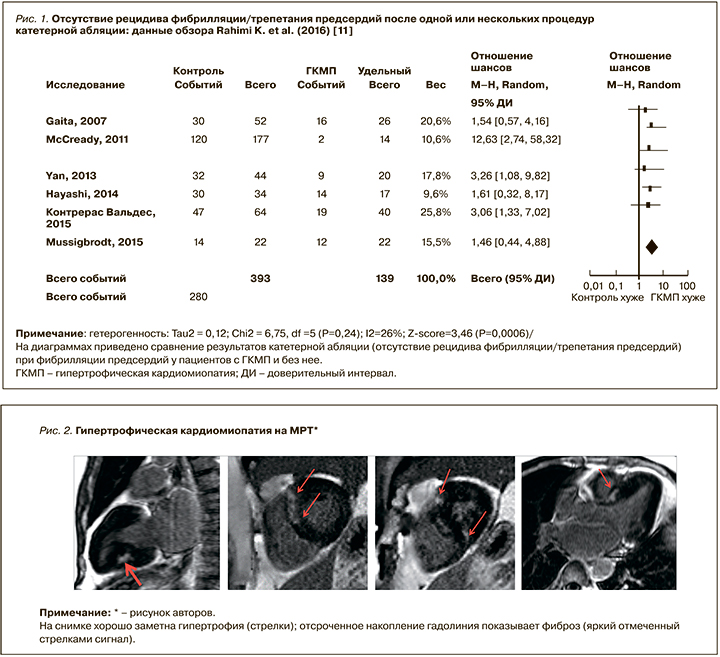
К сожалению, рецидивы ФП случаются примерно у 70% пациентов после фармакологической либо электрической кардиоверсии; этот показатель может быть уменьшен с помощью антиаритмических препаратов (ААП). В последнее десятилетие хирургическое лечение ФП, в основном путем изоляции устьев легочных вен, стало эффективным и безопасным вмешательством для восстановления и поддержания синусового ритма. Вместе с тем рецидивы ФП после катетерной абляции устьев легочных вен случаются в 20–45% случаев, особенно у пациентов с органической патологией сердца, и прежде всего с ГКМП. Rahimi K. et al. проанализировали данные когортных исследований, сравнивавших частоту успеха и осложнений после абляции ФП у пациентов с ГКМП и без нее: результаты показали, что при наличии ГКМП вероятность рецидива аритмии после однократной инвазивной терапии в 2 раза выше, нежели в отсутствие этой патологии (рис. 1) [6–11].
ПАТОФИЗИОЛОГИЯ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ ПРИ ГИПЕРТРОФИЧЕСКОЙ КАРДИОМИОПАТИИ
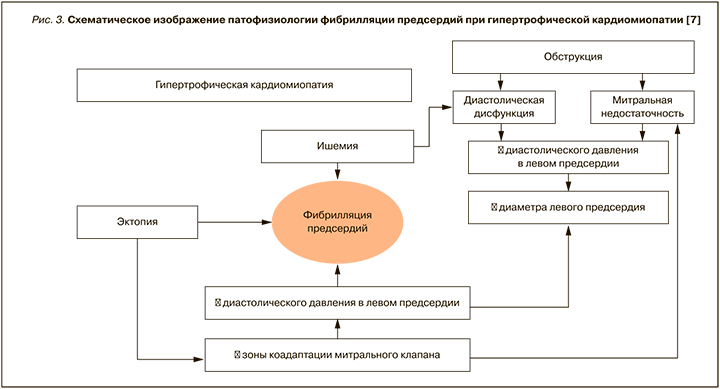
Для адекватного наполнения ЛЖ сокращение предсердий играет фундаментальную роль, особенно у пациентов с ГКМП, имеющих нарушение диастолической функции ЛЖ. В связи с этим при наличии ФП ухудшается обструкция оттока из ЛЖ, нарастают митральная недостаточность, диастолическая дисфункция и ишемия миокарда [11–13]. Взаимодействие между ФП и функциональными и анатомическими изменениями ГКМП является сложным патофизиологическим процессом, в котором ФП выступает и как триггер, и как результат морфологических и физиологических изменений в анатомии сердца [12]. Установлено, что наличие фиброза миокарда, определяемого с помощью магнитно-резонансной томографии (МРТ), нарушает регулярную электрическую активность, а это, в свою очередь, приводит к усилению эктопии предсердий и желудочков миокарда (рис. 2) [12, 13].
Фиброз миокарда у больных ГКМП со сниженной диастолической релаксацией вызывает повышение давления в ЛЖ, что способствует возрастанию давления в левом предсердии (ЛП); возникающий при этом стресс в предсердиях в конечном итоге приводит к их дилатации и развитию ФП. Функция митрального клапана нарушается при обструкции ВТЛЖ, что приводит к клапанной недостаточности; частота такого нарушения достигает 30% у пациентов с ГКМП [12–14].
Увеличение размера ЛП и нарушение его функции выступают частыми проявлениями ГКМП и однозначно являются следствием нарушения диастолической функции ЛЖ, связанного с гипертрофией и ригидностью ЛЖ. Все это представляет собой субстрат для возникновения ФП (рис. 3). С одной стороны, прогрессирование ФП напрямую связано с тяжестью фиброза и структурного ремоделирования в ЛП, но с другой – наличие фиброза миокарда может обеспечить субстрат для медленной проводимости и внутрижелудочковой re-entry и, следовательно, может увеличить восприимчивость ААП к новым триггерам, тем самым повысить их проаритмогенные эффекты.
В текущих руководствах по ведению больных с ГКМП рекомендуется усиленный мониторинг с целью выявления ФП у пациентов с дилатацией ЛП, а также у пожилых пациентов и больных с симптомами сердечной недостаточности III– IV классов по классификации NYHA [11–14]. Надлежащее наблюдение за пациентами с ГКМП включает оценку риска их внезапной сердечной смерти с помощью шкалы HCM-SCD. Важная лечебная мера для таких больных – имплантация кардиовертера-дефибриллятора [12, 15].
При этом до сих пор отсутствует шкала прогнозирования или оценки новых случаев ФП у пациентов ГКМП. Правда, существует ряд исследований, которые позволяют устанавливать определенные клинические, лабораторные и визуальные параметры, способные предсказывать пароксизмы ФП у пациентов с ГКМП в будущем. В настоящее время проводится поиск эффективных методов наблюдения, которые способны предсказывать рецидивы ФП у пациентов с ГКМП.
В различных исследованиях сообщалось, что определенные генетические субстраты, которые не были точно идентифицированы, предрасполагают к возникновению ГКМП и ФП. Однако общие генотипы ГКМП не могут стратифицировать риск развития ФП [14–16].
При отсутствии стеноза митрального клапана функция и давление наполнения ЛП и ЛЖ во время желудочковой диастолы тесно физиологически связаны. На этом основании Pezel T. et al. исследовали индекс связи ЛП с ЛЖ, определяемый соотношением между их объемами, измеренными при удаленной диастоле желудочков. Полученные результаты позволяют заключить, что изменения этого простого индекса независимо связаны с частотой возникновения ФП, поэтому его использование может улучшить стратификацию риска возникновения этой патологии у пациентов с ГКМП по сравнению с традиционными методами [16, 17].
Проспективные исследования выявили предикторы развития пароксизмов ФП у пациентов с ГКМП. К наиболее заметным среди них относятся пожилой возраст, симптомы сердечной недостаточности, высокая концентрация натрийуретического пептида типа B [18, 19].
РОЛЬ ЭЛЕКТРОКАРДИОГРАФИИ ПРИ ГИПЕРТРОФИЧЕСКОЙ КАРДИОМИОПАТИИ
Электрокардиография (ЭКГ) из-за своей широкой доступности считается фундаментальной основой при обследовании пациентов с ГКМП. Ее данные могут значительно меняться по мере течения и прогрессирования заболевания, отражая долгосрочную морфофункциональную эволюцию. На начальном этапе ГКМП на электрокардиограмме могут наблюдаться изменения напряжений QRS, а также аномалии в сегменте ST и зубце T; при этом у соответствующих пациентов не было установлено никакой связи между изменениями на ЭКГ в 12 отведениях с появлением новых пароксизмов ФП [19]. У некоторых больных наблюдалось расширение зубца P, неспецифические изменения зубца T, а также блокада правой ножки пучка Гиса, которая могла быть связана с возрастом пациента, но прямой ассоциации с риском возникновения ФП не имела (рис. 4) [20].
РОЛЬ ЭХОКАРДИОГРАФИИ ПРИ РЕЦИДИВАХ ПАРОКСИЗМОВ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ У ПАЦИЕНТОВ С ГИПЕРТРОФИЧЕСКОЙ КАРДИОМИОПАТИЕЙ
Считается, что механизм, приводящий к развитию ФП у пациентов с ГКМП, связан с ремоделированием предсердий, вторичным по отношению к диастолической дисфункции ЛЖ. Для наблюдения динамических изменений этих характеристик пациентам с ГКМП целесообразно периодическое выполнение эхокардиографии (ЭхоКГ). Основным эхокардиографическим изменением, способным предсказывать возникновение ФП, которое было обнаружено в различных исследованиях, является увеличение размера ЛП [20]. Кроме того, физическая нагрузка во время стрессовой ЭхоКГ, прежде всего повышенный градиент ВТЛЖ, также является предиктором индукции аритмии [20, 21].
Продольное напряжение предсердий <13%, определяемое с помощью ЭхоКГ, способно предсказать возникновение ФП при последующем наблюдении, независимо от увеличения ЛП. Это, в свою очередь, может помочь быстро выявить аритмию, своевременно начать ее лечение и предотвратить серьезные сопутствующие заболевания и фатальные события, такие как инсульт [21].
РОЛЬ МРТ СЕРДЦА У ПАЦИЕНТОВ С ПАРОКСИЗМОМ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ И ГИПЕРТРОФИЧЕСКОЙ КАРДИОМИОПАТИЕЙ
Проведенные ранее исследования показали, что фиброзный процесс, возможно, играет решающую роль в прогрессировании и поддержании ФП. Позднее усиление гадолинием ЛЖ с помощью МРТ при ГКМП стало высокоинформативным биомаркером, имеющим большое значение для диагностики и прогноза заболевания [23, 24].
Лица с ГКМП и поздним усилением гадолинием на МРТ имеют больше маркеров, связанных с внезапной сердечной смертью, и более высокую частоту неблагоприятных сердечно-сосудистых событий, включая прогрессирование заболевания, симптомы сердечной недостаточности, желудочковые аритмии, а также смертность от всех причин и сердечную смертность [25].
В серии сравнительных исследований сообщалось о более высокой распространенности и бремени фиброза ЛЖ при МРТ у пациентов с ГКМП и ФП, но связь между фенотипом желудочковой ГКМП и возникновением ФП проспективно подтверждена не была [24–27]. Таким образом, в настоящее время неясно, какое значение имеет фиброз в развитии ФП, и этот вопрос, несомненно, требует прояснения в будущих исследованиях. Однако уже можно точно утверждать, что фиброз оказывает влияние на эффективность и безопасность антиаритмической терапии.
ЗНАЧЕНИЕ МИОКАРДИАЛЬНОГО ФИБРОЗА У ПАЦИЕНТОВ С ГИПЕРТРОФИЧЕСКОЙ КАРДИОМИОПАТИЕЙ
Фиброз миокарда играет важную роль в развитии тяжелых нарушений ритма, диастолической дисфункции, прогрессировании сердечной недостаточности при ГКМП. На протяжении долгого времени фиброзообразование при этом заболевании интерпретировалось как вторичный ответ на ремоделирование миокарда, обусловленный длительно протекающим заболеванием, гипертрофией кардиомиоцитов, обструкцией ВТЛЖ, аномалией микроциркуляторного русла, нарушениями ритма [27]. Однако работы последних лет делают все больший акцент на фиброзе миокарда как на возможном первичном факторе развития ГКМП. Предполагается, что мутация саркомера запускает патологическое фиброобразование еще задолго до возникновения других морфологических проявлений ГКМП. Но что именно является молекулярным триггером фиброобразования и какова связь между мутациями саркомера и увеличенной пролиферацией немиоцитов, пока что представляется недостаточно ясным [27].
Гистологически ГКМП характеризуется гипертрофией ЛЖ, поражением миоцитов и интерстициальным фиброзом. Форма фиброза при ГКМП (интерстициальный фиброз и заместительный фиброз) отличается от формы, наблюдаемой при ишемической болезни сердца (ИБС). Механическая стимуляция предсердий, такая как напряжение стенки и давление, способствует образованию коллагена, экспрессии ангиотензина II и GFR-β1, а также ремоделированию предсердий. Корреляция между поздним усилением гадолинием ЛП и ЛЖ может свидетельствовать о том, что фиброз ЛП вторичен по отношению к ремоделированию ЛЖ и увеличению давления наполнения [19, 27].
Гипертрофическая кардиомиопатия в значительно большей степени увеличивает содержание миофибробластов в предсердиях, нежели в желудочках, что явно связано с предсердной избирательностью фиброзных процессов и их ролью в ФП. Точные механизмы, с помощью которых фиброз способствует развитию ФП, представляют большой интерес. Учитывая большое значение фиброза предсердий в патофизиологии ФП, терапевтические подходы, нацеленные на функцию фибробластов, видятся перспективной областью для будущих исследований.
В настоящее время считается, что фиброзообразование миокарда связано с экспрессией трансформирующего фактора роста (TGF- β), мощного стимулятора продукции коллагена фибробластами.
ТАКТИКА КОНТРОЛЯ РИТМА ПРИ ГИПЕРТРОФИЧЕСКОЙ КАРДИОМИОПАТИИ
Стратегия ритм-контроля в настоящее время рекомендуется для всех симптоматических пациентов с впервые выявленной ФП. Хотя на сегодня нет доступных данных, сравнивающих стратегию контроля ритма и стратегии контроля частоты сердечных сокращений (ЧСС) у пациентов с ГКМП, в то же время есть сведения, показывающие, что поддержание синусового ритма как можно дольше и восстановление синусового ритма как можно скорее полезно и для контроля симптомов, и для улучшения гемодинамики [7].
При этом антиаритмическая терапия до сих пор остается дискутабельным и не решенным до конца вопросом. Согласно современным гайдлайнам, выбор ААП сильно ограничен. Препараты IС класса не рекомендованы к применению при структурных изменениях со стороны сердца (гипертрофия межжелудочковой перегородки >14 мм), постинфарктном кардиосклерозе и низкой фракции выброса ЛЖ в связи с риском развития их проаритмического эффекта. ААП III класса соталол также противопоказан при ГМЖП >14 мм. Таким образом, единственным препаратом в рассматриваемом нами случае остается амиодарон, нередко приводящий к побочным реакциям, хотя его эффективность у пациентов с ГКМП подтверждена лишь в небольших исследованиях [8]. ААП IA класса дизопирамид безопасен при назначении для контроля обструкции ВТЛЖ, но его эффективность в предотвращении рецидивов ФП не установлена. ААП III класса соталол можно рассматривать при ГКМП, только при условии, если у больного имплантирован кардиовертер-дефибриллятор, однако клинический опыт его использования все же ограничен [8, 27].
ААП IС класса (флекаинид, пропафенон), соталол или дронедарон не рекомендуются при ГКМП из-за потенциальных побочных эффектов, однако по ним не проводились рандомизированные клинические исследования [8, 27]. Результаты крупного и единственного ретроспективного наблюдательного исследования Chung R.et al. [28] поставили дилемму, с которой мы имеем дело при рассмотрении амиодарона в качестве основного ААП выбора у пациентов с персистирующей ФП и ГЛЖ. Прием этого препарата в этом исследовании ассоциировался с более низкой выживаемостью пациентов (log rank p=0,001) по сравнению с другими вариантами антиаритмической терапии и лечением без ААП, в том числе после коррекции данных на возраст, фракцию выброса ЛЖ и ИБС (p=0,023). Так, оцененная нескорректированная 1, 5 и 10-летняя выживаемость в группе пациентов, не получавших антиаритмическую терапию составила 93, 69 и 46%, в группе «неамиодарона» (ААП IC класса и соталол) – 96, 84 и 60%, в группе амиодарона – 90, 58 и 35% соответственно. В сопоставимых когортах с гипертрофией ЛЖ, получавших «неамиодароновую» терапию (ААП IC класса и соталол) или амиодарон (n=65 в каждой группе), ранняя выживаемость пациентов во втором случае была ниже (р=0,05). Применение ААП 1С класса ассоциировалось с лучшей выживаемостью в сравнении с амиодароном (поправка Cox р=0,032).
Российское многоцентровое проспективное рандомизированное исследование ПРОСТОР продемонстрировало лучший профиль безопасности пропафенона (Пропанорм®) по сравнению с амиодароном при проведении антиаритмической терапии у пациентов с артериальной гипертензией, ИБС и хронической сердечной недостаточностью с сохранной фракцией выброса. При использовании пропафенона нежелательных явлений как таковых отмечено не было, тогда как на фоне приема амиодарона их частота составила 31,6%. При этом по своей антиаритмической эффективности у указанных групп больных пропафенон (Пропанорм®) не уступал амиодарону как через 6 мес (67,4% против 62,7%), так и через 12 мес (54,2% против 52,9%) терапии [29].
Приведенные данные диктуют необходимость проведения дальнейших проспективных рандомизированных исследований в этой области, тем более что полученные результаты расходятся с текущими руководящими документами, рекомендующими амиодарон и исключающими назначение ААП IС для больных с ГКМП
Пациентам с рецидивирующей ФП может помочь радиочастотная абляция, особенно если сравнивать инвазивное лечение с использованием амиодарона. Многие исследования подтвердили, что катетерная абляция безопасна и эффективна для пациентов с ГКМП. Однако общий показатель успеха при ее применении ниже, чем у больных без ГКМП, и для достижения контроля синусового ритма, как правило, таким больным требуется больше процедур абляции по сравнению с пациентами без этой патологии, что обусловлено большим размером предсердий, длительностью персистирования ФП и степенью обструкции (ВТЛЖ) при ГКМП [8, 27–31].
ОБСУЖДЕНИЕ
Недавние исследования показали, что структурное ремоделирование, включающее заметные фиброзные изменения, выступает критическим фактором, определяющим сохранение ФП, и синергетически способствует электрическому ремоделированию субстрата ФП. Фиброз предсердий является отличительной чертой аритмогенного структурного ремоделирования при клинической ФП.
Cochet H. et al. выполнили проспективное исследование, в котором проанализировали МРТ-предикторы предсердий и желудочков при развитии ФП у пациентов с ГКМП. Полученные ими результаты подтверждают, что годовая распространенность и частота ФП при ГКМП высоки, и будущее развитие ФП прогнозируется по маркерам ремоделирования предсердий, ранее определенным с помощью ЭхоКГ, а также по симптомам сердечной недостаточности и наличию фиброза в точках введения ЛЖ, определенных с помощью ЭхоКГ или МРТ [32].
Couto Pereira S. et al. в своем клиническом исследовании обнаружили, что распределение фиброза, динамическая обструкция ВТЛЖ и отсроченное позднее усиление гадолинием при МРТ служили предикторами ФП. С другой стороны, Papavassiliu Т. et al. определили, что диастолическая дисфункция была независимо связана с ФП в анамнезе у пациентов с ГКМП [33].
Castelo A. et al. в исследовании с участием 55 пациентов продемонстрировали, что отсроченное повышение уровня гадолиния (РТГ) в нижней средней межжелудочковой перегородке является независимым предиктором возникновения ФП у пациентов с ГКМП, а дилатация левого предсердия улучшает прогноз ФП у этих больных [34].
Установлено, что пациенты с ГКМП имеют более высокую трансмуральную дисперсию реполяризации и, следовательно, более высокий риск полиморфной желудочковой тахикардии. Таким образом, ответ на вопрос о применении ААП при гипертрофии ЛЖ остается сложной задачей в клинической практике; из-за беспокойства по поводу проаритмического эффекта ААП действующие клинические рекомендации предостерегают нас от использования препаратов IC или III класса у пациентов со значительной гипертрофией ЛЖ [34].
Другой важный вопрос – оценка степени гипертрофии ЛЖ, которая рассматривается как критерий безопасности и возможности применения ААП IC класса. Возможно, здесь нужно принимать во внимание не размер межжелудочковой перегородки (размер в 14 мм был определен как значимый в 2001 г. группой экспертов), а наличие или отсутствие фиброза миокарда ЛЖ по данным МРТ сердца, так как данный фиброз по рискам развития проаритмий сопоставим с фиброзом после инфаркта миокарда.
У пациентов с симптомной ФП предпочтительна быстрая электрическая кардиоверсия для восстановления синусового ритма в соответствии с рекомендациями Американской кардиологической ассоциации (AHA) / Американского колледжа кардиологов (ACC) / Общества нарушений сердечного ритма (HRS) от 2020 г., Европейского общества кардиологов (ESC) от 2016 г. и Российского кардиологического общества от 2020 г. Хотя медицинская кардиоверсия является альтернативой электрической кардиоверсии, контролируемых исследований, посвященных изучению и сравнению эффективности этих методов, не проводилось [4, 33].
Santangeli P. et al. исследовали роль изоляции легочных вен у пациентов с ФП и ГКМП. Вероятность успеха была низкой, и больным потребовались дополнительные процедуры. После медианы наблюдения 42 мес только у 49% пациентов не было ФП/предсердной тахикардии. У всех больных возникла необходимость в дополнительной процедуре, при которой антральный отдел и задняя стенка легочной вены оставались изолированными в 82% случаев, но при этом опять же у всех пациентов были зарегистрированы триггеры аритмии вне легочных вен [31].
ЗАКЛЮЧЕНИЕ
Настоящий обзор выполнен с целью анализа результатов доступных исследований, посвященных ГКМП, осложненной ФП, методов диагностики и наблюдения, таких как ЭКГ, ЭхоКГ, МРТ, а также исследований по выбору оптимальной терапии для контроля ритма у таких больных.
Проспективные исследования выявили предикторы развития пароксизмов ФП у пациентов с ГКМП, наиболее значимыми среди которых оказались пожилой возраст, симптомы сердечной недостаточности, высокая концентрация натрийуретического пептида N-концевого типа B, обструкция ЛЖ при физической нагрузке и повышении ЧСС. Необходимо выполнение новых исследований по изучению механизмов ФП при ГКМП, влияния фиброза на прогрессирование аритмии и эффективность и безопасность антиаритмической терапии или/и инвазивных методов лечения.
ФП является частым осложнением и причиной более тяжелого течения ГКМП, при этом в связи с гипертрофией ЛЖ у соответствующих пациентов антиаритмическая терапия представляет собой значительную проблему в клинической практике. Исходя из последних рекомендательных документов, мы можем использовать для стратегии контроля ритма только амиодарон, однако доказательная база применения этого препарата очень слабая. В то же время исследования, в которых осуществлялось наблюдение за пациентами после кардиоверсии на разных классах ААП, показали низкую выживаемость и свободу от аритмии при приеме амиодарона и, наоборот, отсутствие значимых осложнений и убедительную эффективность препаратов IC класса.
Пока амиодарон считается единственным фармакологическим вариантом для контроля ритма у пациентов с ГКМП, но для определения его эффективности и безопасности необходимы дополнительные исследования и контролируемые исследования.



