ВВЕДЕНИЕ
Бронхиальная астма (БА) остается серьезной медицинской проблемой мирового уровня, требующей внимания врачей и исследователей в связи с растущим экономическим ущербом для здравоохранения и общества. В мире насчитывается около 350 млн больных БА, при этом она ежегодно становится причиной преждевременной смерти 250 тыс пациентов [1, 2]. Известно, что в последние несколько десятилетий во всем мире возрастает распространенность как БА, так и ожирения. По опубликованным сведениям Всемирной организации здравоохранения (ВОЗ), более 1,9 млрд взрослых старше 18 лет имеют избыточный вес, из них свыше 650 млн страдают ожирением. В России, по данным на конец 2016 г., было зарегистрировано 23,5 млн лиц с ожирением [3–5]. Как хроническое мультифакторное заболевание, оно ассоциировано с развитием и прогрессированием многочисленных метаболических нарушений и болезней, в первую очередь кардиоваскулярной патологии и сахарного диабета 2-го типа. Это определяет ожирение как одну из ключевых проблем общественного здравоохранения, вносящей существенный вклад в преждевременную смертность, увеличивающей расходы на медицинскую помощь и ухудшающей качество жизни пациентов [6].
Метаболические нарушения гомеостаза, ассоциированные с ожирением, также играют немаловажную роль в развитии и течении БА. В связи с определенными патологическими признаками, обусловленными влиянием факторов внешней среды на генотип человека, БА и ожирение рассматривают не только как коморбидную патологию, но и как самостоятельный фенотип астмы. Для фенотипа «БА и ожирение» характерны низкий уровень контроля астмы и неудовлетворительный ответ пациентов на базисную противоастматическую терапию [7]. При этом в ряде зарубежных эпидемиологических исследований было выделено два основных фенотипа БА с ожирением [8–12]: один (Asthma complicated by obesity) – с более поздним началом астмы, более низкими маркерами аллергического воспаления и реактивностью дыхательных путей, которая улучшается при потере веса; другой (Asthma consequent to obesity) – с более ранним началом заболевания и более высокими маркерами аллергического воспаления.
Также следует отметить, что наибольшее влияние на риск развития ассоциированной патологии оказывает характер распределения жировой ткани, преобладание висцерального жира. Показано, что в процессе верификации дисфункции жировой ткани с формированием воспаления следует не только оценивать индекс массы тела (ИМТ), но и определять соотношение окружности талии (ОТ) к окружности бедер (ОБ), а также «тканевые» биомаркеры, такие как адипокины, цитокины и ряд других биологически активных веществ [13].
В настоящее время во всем мире наблюдается рост заболеваемости и смертности от сердечно-сосудистых заболеваний (ССЗ), при этом немалый вклад в развитие кардиоваскулярных событий вносят как ожирение, так и БА [14–17].
Определение различных особенностей взаимного влияния ожирения и астмы на развитие сердечно-сосудистых катастроф обусловлено необходимостью верификации пациентов с высокими кардиоваскулярными и кардиометаболическими рисками для своевременного начала комплекса лечебно-профилактических мероприятий, направленных на предупреждение развития или прогрессирования ассоциированных состояний и заболеваний, а также на редукцию и восстановление физиологических функций организма.
Цель исследования – оценка клинических, патофизиологических и молекулярных особенностей различных фенотипов ожирения у больных БА для оптимизации противоастматической терапии и ранней диагностики сердечно-сосудистых осложнений.
МАТЕРИАЛ И МЕТОДЫ
Обследовано 180 человек, в том числе 150 больных БА (66 мужчин и 84 женщины) различной степени тяжести. Группу контроля образовали 30 человек (12 мужчин и 18 женщин), сопоставимых по среднему возрасту с основной когортой исследования (табл. 1).
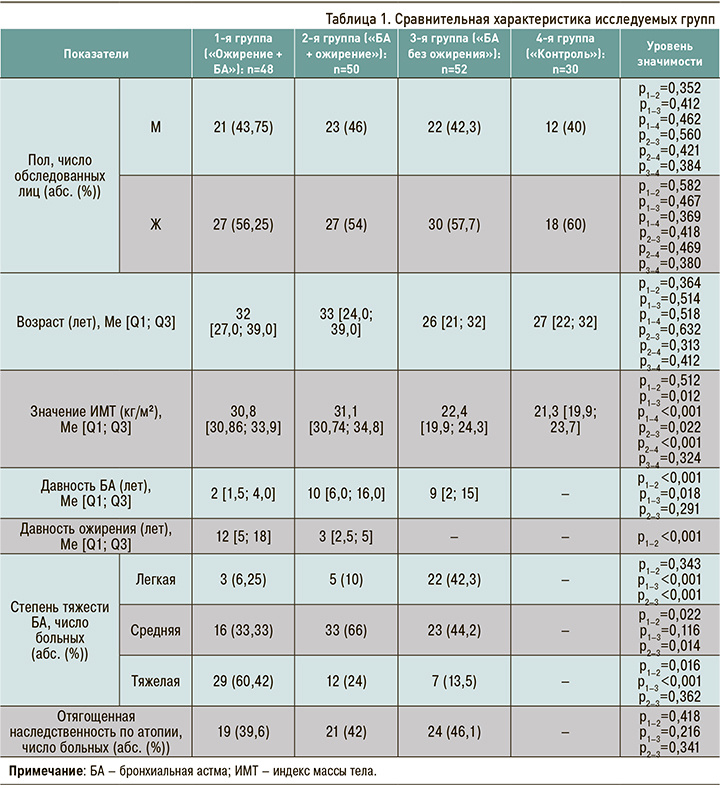
Среди 150 пациентов с БА 98 имели индекс массы тела (ИМТ) от 30 до 35 кг/м2 (ожирение). В дальнейшем в зависимости от времени дебюта астмы они были разделены две группы:
- 1-я группа («Ожирение + БА» – астма вследствие ожирения) – пациенты с давностью астмы на момент включения в среднем 2 года (48 человек: 21 мужчина + 27 женщин). У этих больных с детского возраста наблюдались нарушения питания, проблемы с массой тела, и БА развилась в возрасте старше 18 лет на фоне ожирения;
- 2-я группа («БА + ожирение» – астма, осложненная ожирением) – пациенты с давностью астмы около 10 лет (50 человек: 23 мужчины + 27 женщин).
Оставшиеся 52 пациента с БА (22 мужчины + 30 женщин), но без ожирения (от 18,5 до 25 кг/ м2), сформировали 3-ю группу исследования. Исследуемые группы были сопоставимы по возрасту, полу (см. табл. 1).
Критерии включения в исследование: диагноз БА согласно определениям GINA (2019), по крайней мере за 1 год до визита 1 планируемого исследования; аллергическая БА легкого, среднетяжелого и тяжелого течения; обратимый характер бронхиальной обструкции по данным спирографии, по крайней мере, в течение последних 12 мес до визита 1 планируемого исследования; отсутствие обострения, по крайней мере за 3 мес до планируемого момента 1 визита; возможность правильного использования базисных препаратов; адекватная оценка пациентом своего состояния (по мнению исследователя); отсутствие острых респираторных заболеваний в течение предшествующих 4 нед; наличие письменного информированного согласия. Больные, независимо от тяжести течения астмы, при включении в исследование находились в стабильном состоянии, вне обострения заболевания в течение последних 2 мес, и получали базисную терапию.
Всем пациентам проводилась оценка наличия избыточного веса и оценка степени ожирения в соответствии с рекомендациями ВОЗ на основании определения ИМТ и характера распределения жировой ткани – отношение окружность талии/окружность бедер (ОТ/ОБ). У всех пациентов с ИМТ >30 кг/м2 отмечалось абдоминально-висцеральное ожирение – ОТ/ОБ >0,85 у женщин и >1,0 у мужчин согласно критериям Stern J.S. et al. (1995) [18]. Отметим, что абдоминальное ожирение вызывает нарушение функции респираторной системы, что связано с избыточным объемом мягких тканей, жировой инфильтрацией грудной клетки, увеличением легочного объема крови. Данные, полученные Shore S.A. (2013), указывают, что фактором риска БА выступает не само избыточное накопление жира, а именно расположение его в абдоминальной области. Так, абдоминальное ожирение при ОТ >88 см у женщин и >102 см у мужчин связано с более высоким риском развития БА, чем общее ожирение (ИМТ ≥30 кг/м2).
В процессе исследования у пациентов оценивались клинико-функциональные параметры по результатам спирометрии и бодиплетизмографии. Степень контроля определялась по критериям GINA и с помощью стандартизированных тестов – АСТ и ACQ-5. Выполнялся забор венозной крови из кубитальной вены для измерения показателей липидного спектра, инсулинового обмена, инсулинорезистентности (ИР) и уровней адипокинов (лептина, адипонектина) в периферической крови. Также изучалось содержание NO в выдыхаемом воздухе и клеточный состав индуцированной мокроты, выполнялись эхокардиография и ультразвуковое исследование с цветным допплеровским картированием общей сонной артерии (ОСА) для определения толщины комплекса интима-медиа (ТИМ).
Статистическая обработка полученных результатов проводилась с помощью программы StаtPlus Professional, сборка 5.9.8.5/Core v.5.9.33, методами непараметрической статистики. Данные представлены в виде Me [Q1; Q3], где Ме – медиана, [Q1; Q3] – межквартильный размах. Анализ зависимостей между изученными признаками выполнялся с использованием рангового коэффициента корреляции Спирмена. Для сравнения показателей в независимых выборках применялся критерий Манна–Уитни. Значимость различий качественных признаков оценивалась при помощи непараметрического критерия χ2 с поправкой на непрерывность. При частоте встречаемости признака 5 и менее для сравнения данных использовался точный критерий Фишера. Различия во всех случаях оценивались как статистически значимые при р <0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Пациенты с ожирением были сопоставимы по показателям ОТ и ОБ. Вероятно, это связано с тем, что ОТ указывает на общее количество жировой ткани в зоне измерения и в полной мере не является критерием висцерального ожирения.
Среди пациентов, имеющих фенотип БА в сочетании с ожирением, чаще встречалась среднетяжелая и тяжелая степень заболевания; наиболее часто (33%) тяжелое течение астмы регистрировалось в 1-й группе («Ожирение + БА»). Уровень контроля у пациентов в этой группе был значимо ниже, чем у других больных БА по данным АСТ- и АСQ-тестов.
По результатам спирометрии во всех группах пациентов с БА регистрировались нарушения бронхиальной проходимости, при этом более тяжелые изменения были зафиксированы опять же в 1-й группе («Ожирение + БА»). При анализе показателей бодиплетизмографии было отмечено увеличение общей емкости легких (ОЕЛ), остаточного объема легких (ООЛ) и отношения ООЛ/ОЕЛ во всех группах пациентов с БА по сравнению с референсными значениями. Наиболее значимые отклонения прослеживались все в той в группе «Ожирение + БА» (табл. 2).

При анализе липидного спектра (табл. 3) были выявлены отклонения от целевых значений в обеих группах пациентов с БА и ожирением, однако наиболее значимые отклонения наблюдались в группе «Ожирение + БА»: так, уровень общего холестерина (ОХС) в ней составил 5,3 [4,9; 6,1] ммоль/л, липопротеинов низкой плотности (ЛПНП) – 3,6 [3,2; 4,4] ммоль/л, липопротеинов высокой плотности (ЛПВП) – 1,1 [0,8; 1,3] ммоль/л.
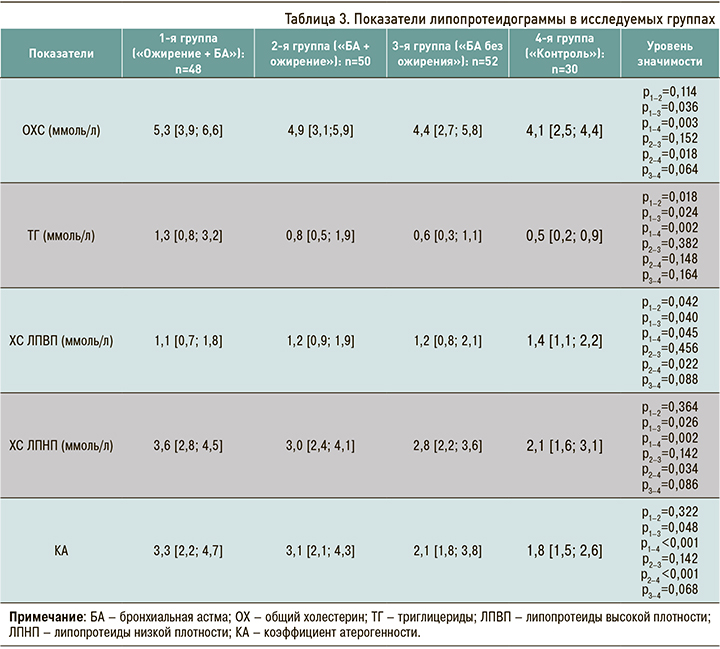
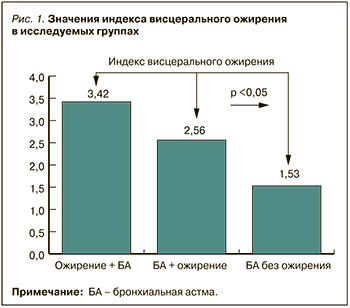
При изучении уровня адипокинов в периферической крови в обеих группах пациентов с БА и ожирением был обнаружен дисбаланс этого показателя (табл. 4). В группе «Ожирение + БА» было выявлено значимое увеличение уровня лептина (28 [26; 32] нг/мл) при одновременном снижении кардиопротективного адипонектина (22 [16; 25] нг/ мл). Анализ индекса свободного лептина и растворимых рецепторов к лептину показал высокий уровень лептинорезистентности в группе «Ожирение + БА». Имеются сведения, что лептин стимулирует развитие нейтрофильного воспаления [19], что подтверждается положительной корреляционной взаимосвязью между уровнем лептина и содержанием нейтрофилов в индуцированной мокроте (r=0,45, р=0,014). Следует добавить, что дисбаланс адипокинов негативно влияет на функциональные показатели при астме, что подтверждается отрицательной корреляционной взаимосвязью между показателями объема форсированного выдоха за 1-ю секунду (ОФВ1) и уровнем лептина (r=-0,49, р=0,025), а также отрицательной корреляционной взаимосвязью между показателями ООЛ, ООЛ/ОЕЛ и уровнем противовоспалительного адипонектина (r=-0,77, р <0,001; r=-0,54, р=0,034 соответственно).
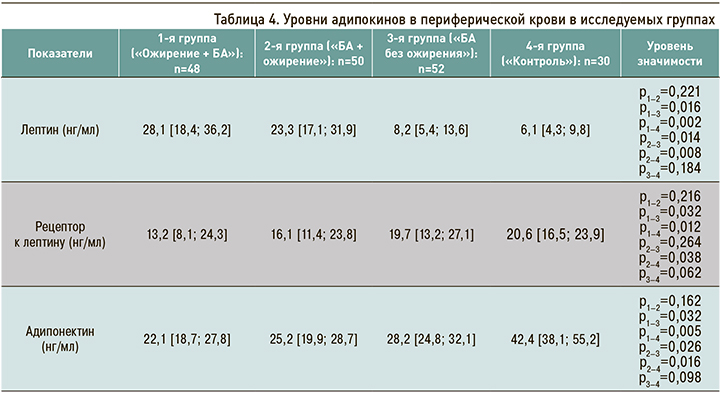
Индекс висцерального ожирения (ИВО) – показатель функции висцеральной жировой ткани и чувствительности к инсулину. Для расчета ИВО использовались формулы: ИВО муж = (ОТ/39,68 + (1,88 × ИМТ)) × ТГ/1,03 × 1,31/ЛПВП и ИВО жен = (ОТ/36,58 + (1,89 × ИМТ)) × ТГ/0,81 × 1,52/ЛПВП. В литературе приводятся следующие повозрастные показатели ИВО, при превышении которых доказано, что сердечно-сосудистый риск возрастает: <35 лет – 2,52; 35–42 лет – 2,23; 42–52 лет – 1,92; 52–66 лет – 1,93; 66 лет — 2,00 [20]. В нашем исследовании наиболее высокое значение ИВО наблюдался у пациентов в группе «Ожирение + БА» – 3,42 [2,84; 4,02] (рис. 1).
При изучении показателей ИР и функциональной активности β-клеток поджелудочной железы в представленных группах было отмечено, что у пациентов группы «Ожирение + БА» уровень свободного инсулина составил 33,8 мкМЕ/мл, что было значимо больше, чем в группе «БА + ожирение» (28,6 мкМЕ/мл), а также у пациентов с нормальной массой тела (12,3 мкМЕ/мл) и лиц из группы контроля (5,1 мкМЕ/мл). Индекс ИР (HOMA-IR) в группе «Ожирение + БА» составил 4,2, что было значимо выше, чем в группе «БА + ожирение» (3,7), а также у пациентов с нормальной массой тела (1,6). Были выявлены положительные корреляционные взаимосвязи между уровнем инсулина и количеством госпитализаций (r=0,56, р=0,028), а также показателем ОТ/ОБ (r=0,52, р=0,044), характеризующим абдоминальное ожирение.
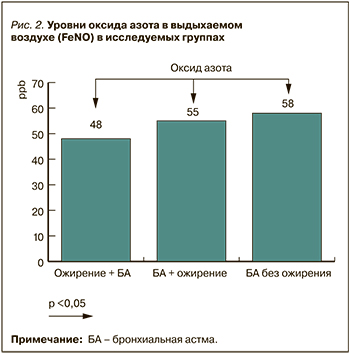
В настоящий период в клинической практике применяются такие неинвазивные информативные методики, как исследование клеточного состава индуцированной мокроты (ИМ) и уровней NO в выдыхаемом воздухе [21, 22]. Уровень NO в выдыхаемом воздухе как маркер эозинофильного воспаления в дыхательных путях у пациентов группы «Ожирение + БА» был ниже относительно больных БА с нормальной массой тела, а также пациентов из группы «БА + ожирение» (рис. 2).
При оценке клеточного состава индуцированной мокроты у пациентов с БА и ожирением чаще встречался малогранулоцитарный биотип астмы. В группе «Ожирение + БА» в 39% случаев регистрировался нейтрофильный тип БА и в 43% – малогранулоцитарный (табл. 5).
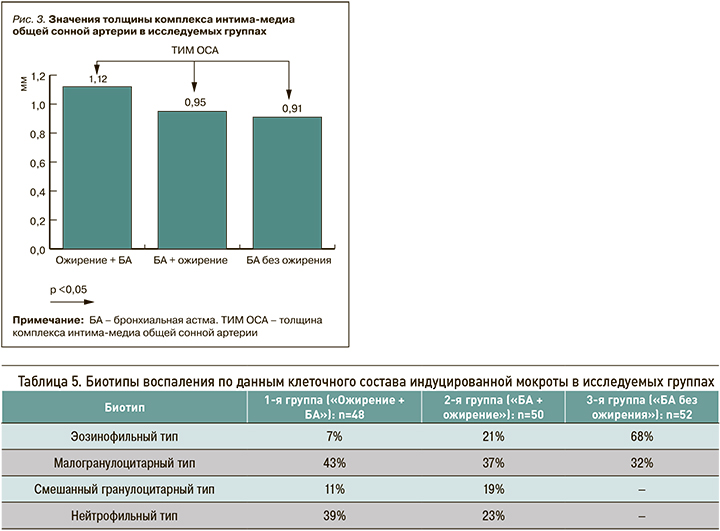
ТИМ ОСА служит неинвазивным маркером изменения артериальной стенки. Определение значения ТИМ имеет высокую прогностическую значимость в отношении диагностики коронарного атеросклероза, а повышение ТИМ ОСА является важным критерием высокого сердечно-сосудистого риска [23]. У пациентов с БА и ожирением значение ТИМ ОСА было выше, чем у пациентов с нормальной массой тела, при этом у больных в группе «Ожирение + БА» отмечалось наибольшее повышение этого параметра (рис. 3).
Увеличение риска сердечно-сосудистых катастроф у пациентов с гипертрофией левого желудочка (ГЛЖ) остается высоко актуальной проблемой в настоящее время. Результаты ранее проведенных исследований свидетельствуют о наличии закономерности между значением ГЛЖ и уровнями смертности от сердечно-сосудистых и всех причин [24]. В группе пациентов с ожирением уровень ГЛЖ был выше по сравнению с пациентами с нормальной массой тела. В группе больных «Ожирение + БА» регистрировались наиболее высокие значения массы миокарда левого желудочка (178 [160; 192] г) и индекса массы миокарда левого желудочка (88,2 [74,1; 96,6]).
ЗАКЛЮЧЕНИЕ
Таким образом, пациентов с ожирением и астмой можно разделить на две основные категории – «Ожирение + БА» (астма вследствие ожирения) и «БА + ожирение» (астма, осложненная ожирением); дополнительные фенотипы внутри этих групп еще описываются. Ранее в литературе был описан ряд особенностей воспалительных процессов, определяющих фенотип астмы и ожирения (рис. 4). При фенотипе «БА + ожирение» индукторами воспаления 2-го типа выступают интерлейкин 33 (ИЛ-33), ИЛ-25, тимический стромальный лимфопоэтин. В дальнейшем он реализуется через цитокины врожденных лимфоидных клеток 2-го типа и Th2 типа – ИЛ-13, ИЛ-4, ИЛ-9, ИЛ-5, с активацией синтеза В-клетками IgE, при этом эффекторной клеткой выступает эозинофил. При фенотипе «Ожирение + БА» нейтрофилы присутствуют в просвете дыхательных путей, под влиянием амилоида А, ИЛ-8, гранулоцитарно-макрофагального колониестимулирующего фактора формируется воспаление 1-го типа с выработкой цитокинов Th1 и Th17 – ИЛ-6, 8, 17A, интерферона-γ, фактора некроза опухоли-альфа.
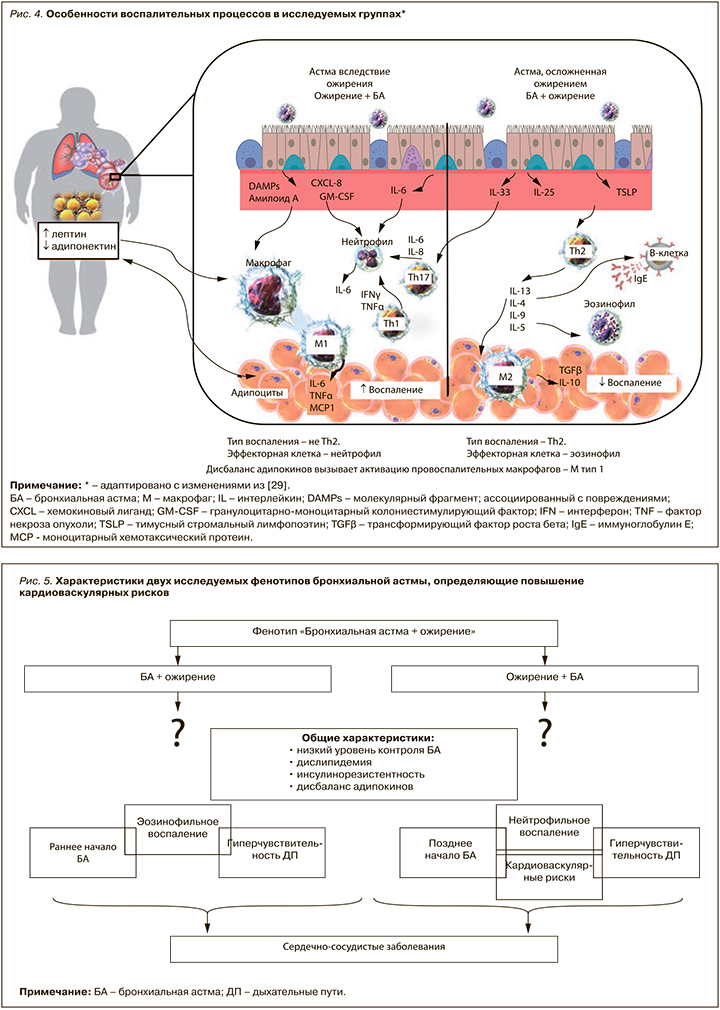
Доказано, что ключевым звеном стимуляции воспаления при ожирении выступает дисбаланс адипокинов. Лептин стимулирует адипоциты к высвобождению медиаторов воспаления и активирует внутриклеточный мультипротеиновый комплекс макрофагов 1-го типа и нуклеотид-связывающий домен олигомеризации 3. Их активация приводит к усилению выработки ИЛ-1β, последующей активации врожденных лимфоидных клеток 3-го типа и секреции ИЛ-17, что, в свою очередь, способствует гиперчувствительности дыхательных путей, а также прогрессированию как местного, так и системного воспаления [25–28].
В заключение можно выделить общие черты двух фенотипов БА (рис. 5), такие как низкий уровень контроля астмы, дислипидемия, инсулинорезистентность, дисбаланс адипокинов. Результаты исследований, характеризующих вероятность развития ССЗ и их осложнений у пациентов с астмой и ожирением, продемонстрировали, что лица с ИМТ ≥30 кг/м2 имеют повышенный риск развития сахарного диабета 2-го типа, артериальной гипертензии, дислипидемии, коронарной болезни сердца и сердечной недостаточности.
При этом пациенты с фенотипом «Ожирение + БА» имеют более позднее начало заболевания, нейтрофильное воспаление дыхательных путей, более неблагоприятный метаболический профиль, характеризующийся низким уровнем чувствительности к инсулину, неблагоприятным липидным профилем, высоким уровнем системных воспалительных реакций, что ухудшает ответ на стандартную базисную противовоспалительную терапию, а также увеличивает риск развития кардиоваскулярного ремоделирования и клинически значимых ССЗ.
Выделение различных фенотипов БА, ассоциированной с ожирением, обусловлено необходимостью верификации пациентов с высокими кардиоваскулярными рисками для своевременного начала проведения комплекса лечебно-профилактических мероприятий, направленных на предупреждение развития или прогрессирования ассоциированных состояний и заболеваний, а также на редукцию и восстановление физиологических функций жировой ткани.



