ВВЕДЕНИЕ
Остеоартрит (ОА) – хроническое прогрессирующее гетерогенное заболевание опорно-двигательного аппарата, характеризующееся деградацией экстрацеллюлярного матрикса суставного хряща, сопровождающееся патологическим ремоделированием тканей и проявляющееся болевым синдромом с нарушением функциональной активности и значимым снижением качества жизни пациентов [1]. В настоящее время ОА рассматривается как органное поражение, т.е. патология всего сустава, при которой, помимо хрящевой ткани, в процесс вовлекаются субхондральная кость, синовиальная оболочка, связки, капсула и околосуставные мышцы [2, 3]. Согласно последним опубликованным данным, в основе заболевания лежит так называемое субклиническое воспаление (low-grade inflammation), которое, наряду с другими патогенетическими механизмами, выступает в роли важнейшего фактора развития и прогрессирования ОА [2, 4]. В результате постоянной статической и динамической нагрузки (так называемого механического стресса) все ткани сустава, включая хондроциты, остеоциты, синовиальные фибробласты, элементы межклеточного матрикса, претерпевают определенные патологические изменения, что приводит к активации механизмов репарации и ремоделирования, сопровождающихся развитием локальной воспалительной реакции [2, 5].
Основной жалобой, предъявляемой пациентами с ОА, является боль в области суставов, которая в большинстве случаев возникает и нарастает во время или сразу после физической нагрузки и значительно снижается в состоянии покоя [2, 6]. Известно несколько этиологических факторов болевого синдрома при ОА: они не связаны с поражением хряща, а определяются воспалительными и дегенеративными изменениями в области субхондральной кости (формирование остеосклероза и очагов остеита, образование остеофитов, микротравматизация, повышение интрамедуллярного давления), синовиальной оболочки (синовит и патологический выпот), а также околосуставных тканей (мышечный спазм, энтезиты, повреждение сухожильно-связочного аппарата) [2, 7].
К лекарственным средствам, широко используемых в терапевтической практике для купирования симптомов или лечения ряда ревматологических заболеваний, относятся нестероидные противовоспалительные препараты (НПВП) [8–10]. Основное действие этого класса реализуется путем подавления активности циклооксигеназы (ЦОГ) – ключевого фермента метаболизма арахидоновой кислоты [8]. На сегодняшний день признано бесспорным следующее положение, касающееся практического применения НПВП: все средства данной группы в адекватных терапевтических дозах эквивалентны по своему противовоспалительному и обезболивающему действию, но могут существенно различаться по переносимости и риску формирования нежелательных явлений (НЯ) [8, 11]. Этот тезис лежит в основе персонифицированного подхода к выбору конкретного НПВП с учетом большого количества индивидуальных клинических параметров пациента (наличия и выраженности коморбидных состояний, объема их лекарственной терапии и многих др.) [8, 11]. Согласно многочисленным данным, НПВП являются одними из наиболее часто используемых лекарственных средств в мире [12, 13].
Отличительная черта современного фармацевтического рынка России – значительное количество дженерических лекарственных препаратов как импортного, так и отечественного производства. Эффективность применения дженериков во многом зависит от их качества и терапевтической эквивалентности оригинальному препарату. В официальных материалах Всемирной организации здравоохранения подчеркивается необходимость доказывать качество дженериков, представляя документы, подтверждающие соответствие их производства принципам Good Manufacturing Practice (GMP). Не менее важны полученные в ходе клинических исследований, в том числе в пострегистрационных (постмаркетинговых), доказательства терапевтической эквивалентности (и, следовательно, взаимозаменяемости) дженериков по показателям эффективности и безопасности оригинальным и аналогичным лекарственным препаратам, уже зарегистрированным на фармрынке. В связи с этим заметим, что среди пациентов и некоторых представителей медицинского сообщества существует мнение, что оригинальные и дженерические препараты существенно различаются между собой как по терапевтической эффективности, так и по частоте и выраженности НЯ.
Цель исследования – оценить эффективность и безопасность препарата Симкоксиб® по сравнению с оригинальным целекоксибом у пациентов, страдающих ОА коленного сустава (КС).
Материалы и методы
Проспективное рандомизированное одноцентровое сравнительное исследование было выполнено на базе ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России (СЗГМУ им. И.И. Мечникова) в период с февраля по апрель 2022 г. Проведение исследования было одобрено комитетом по этике СЗГМУ им. И.И. Мечникова, все участники были включены в него после подписания форм информированного согласия. Первичной конечной точкой исследования служила оценка эффективности и безопасности терапии ОА КС препаратом Симкоксиб® по сравнению с оригинальным целекоксибом.
Подход к оценке активности ОА у участников был современным и комплексным и основывался на определении комбинированных индексов, включающих альго-функциональные параметры суставного синдрома. Для оценки выраженности боли использовалась 100-миллиметровая визуально-аналоговая шкала (ВАШ), где за 0 мм принималось отсутствие болевого синдрома, а 100 мм соответствовали наибольшей его интенсивности. Функциональное состояние суставов определялось по индексу WOMAC (The Western Ontario and McMaster Universities Osteoarthritis Index, N. Bellamy, 1988 г.).
Критериями включения в исследование служили диагноз «первичный ОА КС», верифицированный в соответствии с критериями Американской коллегии ревматологов (ACR) и подтвержденный рентгенологическим исследованием; I–III стадия заболевания по классификации Kellgren–Lawrence; возраст пациентов от 40 до 60 лет на момент включения в исследование.
Критериями исключения были возраст младше 40 и старше 60 лет; беременность или период лактации; патология сердечно-сосудистой системы в стадии декомпенсации и/или со значимой степенью недостаточности кровообращения: хроническая сердечная недостаточность III и IV функциональных классов по NYHA; нестабильная стенокардия, стенокардия напряжения III и IV функциональных классов; хроническая патология печени и органов желудочно-кишечного тракта (ЖКТ) в стадии обострения; хроническая болезнь почек 3–5 стадий; сахарный диабет (СД) 2-го типа в стадии декомпенсации. Из исследования также были исключены больные ОА КС, имеющие вторичный генез заболевания и/или перенесшие эндопротезирование суставов любой локализации, и пациенты, получавшие в качестве терапии внутрисуставное введение глюкокортикоидов и/или препаратов гиалуроновой кислоты менее чем за 3 мес до даты включения в исследование. Наряду с этим в исследование не включались пациенты с известной непереносимостью компонентов, входящих в состав препарата Симкоксиб® и оригинального целекоксиба.
Всего в исследование вошли 59 больных ОА КС: 42 (71,2%) женщины и 17 (28,8%) мужчин (табл. 1). Средний возраст участников составил 50,2±5,3 (от 42 до 59) лет (Me=50). Исследуемые были рандомизированны в две группы, сопоставимые по полу, возрасту, длительности и рентгенологической стадии заболевания: пациенты 1-й группы (n=30) в качестве симптоматического лечения ОА КС получали препарат Симкоксиб® (производитель – ООО «ПанБио Фарм»); у пациентов 2-й группы (n=29) для снижения выраженности симптомов основного заболевания использовался оригинальный целекоксиб. Курс лечения в обеих группах составлял 14 сут, препараты применялись в суточной дозе 400 мг/сут (по 200 мг 2 раза/ сут). В дальнейшие 14 сут допускался симптоматический прием препаратов в дозировке 200–400 мг/сут в режиме «по требованию», исходя из индивидуальной клинической ситуации и показаний.
Наблюдение за пациентами осуществлялось в четырех временны'х точках: 1-й визит – включение в исследование; 2-й визит – на 7±2-е сутки; 3-й визит – на 14±2-е сутки; 4-й визит – на 28±2-е сутки. На каждом из визитов выполнялись объективный осмотр по органам и системам органов, сбор жалоб и анамнеза, регистрация НЯ в случае их возникновения. В каждой временной точке проводилась и оценивалась выраженность симптомов ОА по ВАШ боли и индексу WOMAC. Наряду с этим, проводились оценка динамики течения хронических заболеваний, имеющихся у пациентов на момент включения в исследование, и регистрация вновь возникших патологий, определялись уровень среднего артериального давления (1/3 × систолическое артериальное давление + 2/3 × диастолическое артериальное давление), а также лабораторных данных – показатели кроветворения (тромбоциты, лейкоциты, эритроциты, гемоглобин), С-реактивный белок (СРБ), печеночные ферменты (аланинаминотрансфереза и аспартатаминотрансфераза), креатинин сыворотки крови с расчетом скорости клубочковой фильтрации (рСКФ) по формуле CKD-EPI 2021 г.
Частота встречаемости некоторых сопутствующих заболеваний в исследуемой когорте пациентов на момент включения в исследование представлена в таблице 2.
Статистический анализ данных проводился с использованием пакета программного обеспечения STATISTICA 8.0 (StatSoft Inc, США), включая общепринятые методы параметрического и непараметрического анализа. Характер распределения данных оценивался графическим методом и с использованием критерия Шапиро–Уилка. В случае нормального распределения признака он описывался в виде среднего (M) ± стандартного отклонения (SD). При распределении данных, отличном от нормального, применялся критерий χ2. Критерием статистической достоверности получаемых выводов считали общепринятую в интерпретации медико-биологических исследований величину p <0,05.
РЕЗУЛЬТАТЫ
На момент включения в исследование выраженность симптомов ОА по ВАШ боли и WOMAC, а также уровень системного воспалительного процесса были сопоставимы в обеих группах, при этом средний уровень СРБ не превышал референсных значений лаборатории (табл. 3).
Исходно пациенты обеих групп имели схожие показатели среднего артериального давления (АД) и рСКФ (табл. 4). Ни у одного из наблюдаемых больных не было выявлено увеличение показателей уровней печеночных трансаминаз в сыворотке крови относительно референсных значений лаборатории перед началом терапии.
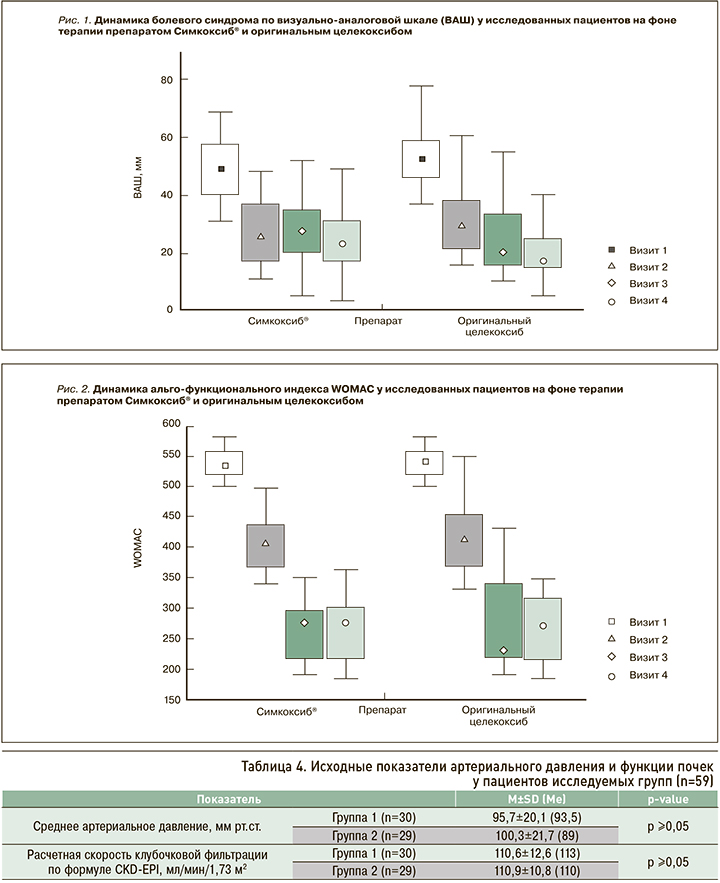
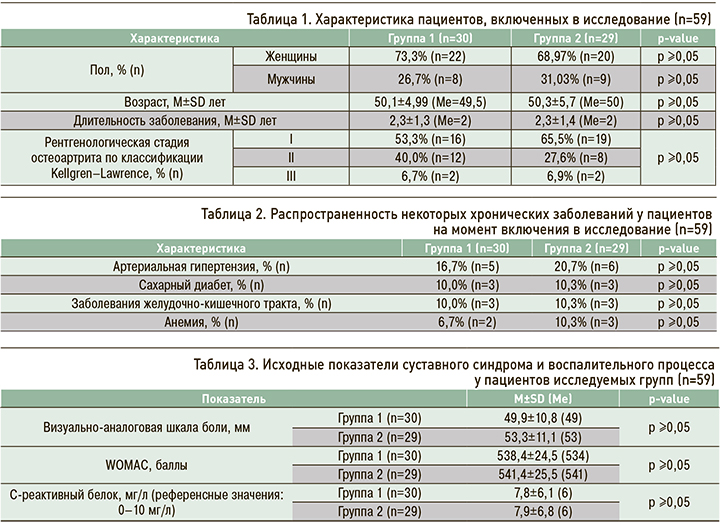
У пациентов обеих групп на фоне проведения терапии отмечалась значимая положительная динамика течения ОА в виде снижения ВАШ боли (p <0,001) и индекса WOMAC (p <0,001; табл. 5, рис. 1 и 2). При этом эффективность изучаемых препаратов была схожей (p ≥0,05 при межгрупповом сравнении показателей ВАШ боли и WOMAC на каждом из визитов).
На протяжении всего периода наблюдения у пациентов обеих групп наблюдалась положительная динамика заболевания в виде снижения средних уровней СРБ в сыворотке крови (табл. 6).
Важной задачей исследования была оценка безопасности терапии препаратом Симкоксиб®. В ходе наблюдения у пациентов обеих групп регистировались схожие показатели среднего АД и рСКФ, не выходящие за пределы нормальных значений в популяции. Стоит отметить, что в группе участников, получавших препарат Симкоксиб®, имело место более интенсивное снижение рСКФ, однако полученные данные не достигали статистической значимости (табл. 7).
В течение всего периода наблюдения количество НЯ со стороны органов ЖКТ было сопоставимым в группах пациентов, получавших каждый из препаратов. При этом в группе препарата Симкоксиб® патология ЖКТ возникла у 3,3% (n=1) пациентов, тогда как среди лиц, принимавших оригинальный целекоксиб, аналогичное значение составило 10,3% (n=3; p ≥0,05).
Параметры безопасности применения препаратов со стороны печени оценивались по уровням печеночных трансаминаз. Нарастание этих показателей отмечалось у схожего количества пациентов в обеих группах (p ≥0,05; табл. 8). Вместе с тем среди пациентов, получавших Симкоксиб®, уровень повышения печеночных трансаминаз не превышал значения двух норм, в то время как в группе оригинального целекоксиба у 3,3% (n=1) пациентов на последнем визите регистрировалось нарастание аспартатаминотрансферазы (АСТ) и аланинаминотрансферазы (АЛТ) более трех норм по референсным значениям лаборатории (p ≥0,05).
По частоте развития НЯ со стороны кроветворения исследуемые группы статистически не различались (p ≥0,05). Обращает на себя внимание, что при терапии препаратом Симкоксиб® у пациентов отсутствовала тромбоцитопения и наблюдалась меньшая частота анемии (табл. 9).
Комплаентность участников, включенных в исследование, была удовлетворительной и сопоставимой в обеих группах (p<0,001), что подтверждалось результатами подсчета врачом-исследователем оставшихся таблеток в блистере на каждом из визитов (p ≥0,05).
Таким образом, данные, полученные в ходе исследования, позволяют утверждать следующее.
1. Симкоксиб® у больных ОА КС достоверно сопоставим с оригинальным целекоксибом по эффекту снижения выраженности клинических проявлений основного заболевания (ВАШ боли и WOMAС).
2. Симкоксиб® достоверно не отличается от оригинального целекоксиба по частоте развития НЯ.
ОБСУЖДЕНИЕ
Одна из ключевых проблем в медикаментозной терапии больных ОА – высокий коморбидный потенциал этой патологии. В свою очередь, снижение функциональной активности, обусловленное наличием хронических заболеваний, приводит к прогрессированию болевого синдрома. Крупные исследования демонстрируют сильную ассоциацию ОА с наличием или развитием сердечно-сосудистых заболеваний, метаболических нарушений (дислипидемии, СД), депрессии, а также с увеличением смертности, прежде всего вследствие кардиоваскулярных событий. По данным крупного метаанализа 42 исследований, наличие любого сопутствующего хронического заболевания у лиц с ОА встречалось в 66% случаев, причем у 24% больных наблюдалось не менее трех сопутствующих состояний [14].
В основе сердечно-сосудистой коморбидности при ОА лежат общие факторы риска, такие как возраст и ожирение. Другими возможными этиологическими факторами такой коморбидности могут выступать генетическая предрасположенность и ограничение уровня физической активности [15]. В свою очередь, длительный бесконтрольный прием НПВП, связанный со стойким болевым синдромом, может приводить к развитию большого количества НЯ, таких как поражение почек, печени, органов кроветворения, ЖКТ и сердечно-сосудистой системы [15–19]. Таким образом, важнейшим критерием выбора препарата из группы НПВП является баланс его эффективности и безопасности.
Разработка класса селективных ингибиторов ЦОГ-2 позволила в значительной степени снизить риск развития НЯ, в первую очередь НПВП-индуцированного поражения ЖКТ. При этом по своему противовоспалительному и обезболивающему эффекту эти препараты не уступают лекарственным средствам из группы неселективных ЦОГ-ингибиторов [20]. Главные преимущества селективных ингибиторов ЦОГ-2 – возможность их применения у пациентов с факторами риска НПВП-гастропатии (в первую очередь имеющих в анамнезе язвенную болезнь желудка и/или двенадцатиперстной кишки), доказанная меньшая частота развития НПВП-ассоциированной патологии ЖКТ на фоне их приема. Это особенно важно при длительном использовании препарата, что нередко является необходимостью для пациентов с ОА. Так, в метаанализе 52 исследований (51 048 пациентов) применение целекоксиба было связано со значительно более низким риском всех клинически значимых НЯ на всем протяжении ЖКТ, по сравнению с другими НПВП [21].
Обсуждая аспекты безопасности применения НПВП, следует учитывать, что в научной литературе имеются сообщения о возможной повышенной токсичности этого класса лекарств в отношении сердечно-сосудистой системы [22, 23]. Фермент ЦОГ-1 постоянно экспрессируется в большинстве тканей, выполняя важную роль в поддержании нормального физиологического состояния систем организма, включая защиту слизистой оболочки ЖКТ, регуляции функции почек и органов сердечно-сосудистой системы. Синтез ЦОГ-2 индуцируется при наличии активного воспалительного процесса, но его продукция происходит и в нормальных клетках эндотелия, выделяющих простациклин (ПЦ) [24]. Простагландин (ПГ) I2 обеспечивает релаксацию гладкой мускулатуры сосудов, вазодилатацию и антитромбоцитарный эффект. Селективное ингибирование ЦОГ-2 может вызывать снижение экспрессии ПЦ эндотелиоцитами, при этом синтез тромбоксана A2 в тромбоцитах не изменяется. Итоговый дисбаланс этих веществ становится предпосылкой к тромбообразованию и возникновению сердечно-сосудистых событий [25–28]. Наряду с этим в литературе описан непосредственный кардиопротективный эффект ПГ I2 и Е2 [29, 30].
В связи с этим нельзя не сказать, что, согласно данным большого количества исследований, применение целекоксиба может иметь меньший сердечно-сосудистый риск по сравнению с другими НПВП [31–37]. В метаанализе 12 исследований (65 341 участник), в котором целекоксиб сравнивался с другими НПВП, и в том числе отдельно с другими селективными ингибиторами ЦОГ-2, на фоне его приема было выявлено снижение вероятности возникновения инфаркта миокарда относительно иных «коксибов» (отношение шансов (ОШ)=0,583; 95% доверительный интервал (ДИ): 0,396–0,857; р=0,006). Кроме того, использование целекоксиба было сопряжено со снижением частоты острого нарушения мозгового кровообращения по сравнению со всеми другими исследовавшимися НПВП (ОШ=0,603; 95% ДИ: 0,410–0,887; р=0,010), неселективными НПВП (ОШ=0,517; 95% ДИ: 0,287–0,929; р=0,027) и другими «коксибами» (ОШ=0,509; 95% ДИ: 0,280–0,925; р=0,027). При этом не наблюдалось различий по этому показателю между целекоксибом и плацебо. Таким образом, целекоксиб продемонстрировал в целом более низкую частоту комбинированного сердечно-сосудистого исхода по сравнению со всеми НПВП (ОШ=0,805; 95% ДИ: 0,658–0,986; р=0,036) и другими «коксибами» (ОШ=0,557; 95% ДИ: 0,404–0,767; р <0,001) [37]. Представленные выше данные позволяют утверждать, что целекоксиб, относящийся к семейству «коксибов», может вызывать меньшее количество осложнений со стороны сердечно-сосудистой системы относительно других НПВП. По данным нашего исследования, применение препарата Симкоксиб® не приводило к значимому увеличению среднего АД и снижению функции почек, и в этом плане было статистически сопоставимо с терапией оригинальным целекоксибом.
Таким образом, в настоящее время, благодаря выраженному противовоспалительному и анальгетическому эффекту, хорошему профилю гастродуоденальной переносимости и сердечно-сосудистой безопасности, целекоксиб является одним из наиболее широко используемых препаратов из группы селективных ингибиторов ЦОГ-2. Для него характерна высокая степень связывания с белками плазмы (99%), он быстро проникает в синовиальную жидкость, создавая там адекватные терапевтические концентрации активного вещества.
Интересными представляются и сообщения о возможном модифицирующем эффекте целекоксиба у пациентов с ОА. Так, в исследовании пациентов с ОА КС, которым проводилась терапия целекоксибом или ацеклофенаком, а в дальнейшем выполнялось оперативное пособие по эндопротезированию КС, в исследуемых группах был выявлен различный клеточно-молекулярный состав тканей сустава. Оба препарата приводили к уменьшению боли и улучшению функции КС по сравнению с контрольной группой, снижали концентрацию ПГ E2 в синовиальной жидкости, подавляли экспрессию мРНК и белка ЦОГ-2 в синовиальной оболочке. При этом инфильтрация макрофагами, а также экспрессия интерлейкина 1β и фактора некроза опухолей-альфа снижались только при использовании целекоксиба [38].
В другом экспериментальном исследовании целекоксиб способствовал увеличению синтеза и высвобождению вновь образованных протеогликанов в пораженном ОА суставном хряще [39]. Также имеются экспериментальные данные, демонстрирующие снижение уровня матриксных металлопротеиназ и увеличения синтеза протеогликанов и гиалуронатов в хондроцитах на фоне применения целекоксиба [40–42]. Более того, в некоторых работах высказывается гипотеза о положительном влиянии препарата на метаболизм костной ткани в виде снижения дифференцировки и активации остеокластов [43], синтеза RANKL [44] и остеодеструкции [45].
ЗАКЛЮЧЕНИЕ
Селективный ингибитор ЦОГ-2 целекоксиб является лекарственным средством с доказано высокой эффективностью при лечении болевого синдрома различного генеза. Кроме того, данный препарат обладает хорошим профилем безопасности в отношении органов ЖКТ и сердечно-сосудистой системы. В ходе проведенного нами исследования было выявлено, что терапия препаратом Симкоксиб® является эффективной и сопоставимой с оригинальным целекоксибом по снижению выраженности клинических проявлений ОА КС. Это, в частности, проявлялось достоверно эффективным уменьшением показателей ВАШ боли и индекса WOMAC, которое оказалось сравнимым в обеих группах исследования. При этом частота НЯ на фоне приема препарата Симкоксиб® не превышала аналогичные показатели при использовании оригинального целекоксиба.


