ВВЕДЕНИЕ
Неалкогольная жировая болезнь печени (НАЖБП) – хроническое заболевание печени метаболического генеза у лиц с отсутствием воздействия экзогенных факторов токсического поражения печени (например, экзогенного этанола), обусловленное накоплением липидов в составляющих печеночную дольку клеточных элементах и морфологически подтверждаемое стеатозом, стеатогепатитом, фиброзом, циррозом или аденокарциномой [1].
НАЖБП является наиболее распространенным заболеванием печени во всем мире, связанным не только с формированием неблагоприятного печеночного прогноза [2, 3], но и увеличением общей смертности [4]. Этот факт, в частности, подтвердило общенациональное когортное исследование, проведенное в Швеции и включившее всех пациентов этой страны с гистологически подтвержденной НАЖБП после исключения другой этиологии заболевания печени (с 1966 по 2017 г.; n=10 568): согласно его результатам, у пациентов с НАЖБП по сравнению с контрольной группой (лица без НАЖБП из общей популяции, сопоставимые с основной когортой по возрасту, полу, календарному году и округу; n=49 925) была значительно повышена общая смертность. В среднем за 14,2 года умерло 4338 пациентов с НАЖБП, причем со значительным увеличением общей смертности были ассоциированы все гистологические стадии заболевания. По сравнению с контролем значительный избыточный риск смертности наблюдался даже при простом стеатозе печени, прогрессивно возрастая с ухудшением гистологических показателей [4].
НАЖБП также тесно ассоциирована с субклиническими и клиническими сердечно-сосудистыми заболеваниями (ССЗ). Пациенты с НАЖБП подвержены значительному риску развития артериальной гипертонии (АГ), ишемической болезни сердца (ИБС), кардиомиопатии и сердечных аритмий, которые приводят к увеличению сердечно-сосудистой заболеваемости и смертности [5].
Существует двунаправленная связь между НАЖБП и сахарным диабетом 2-го типа (СД 2). По данным большого метаанализа обсервационных исследований, выполненных в 20 странах, глобальная распространенность НАЖБП у людей с СД 2 составляет ~56% [6]. С одной стороны, НАЖБП может предшествовать и/или способствовать развитию СД 2, с другой – риск развития СД 2 соответствует тяжести НАЖБП. Более того, присутствие НАЖБП повышает риск осложнений СД [7].
Также НАЖБП ассоциируется с повышенным риском всех видов рака (отношение рисков (ОР) 1,22; 95% доверительный интервал (ДИ): 1,10–1,36; p=0,0001), рака щитовидной железы (ОР 2,79; 95% ДИ: 1,25–6,21; p=0,0001), рака легкого (ОР 1,23; 95% ДИ: 1,02–1,49; p=0,03), колоректального рака (ОР 1,96; 95% ДИ: 1,17–3,27), раком почки (ОР 1,57; 95% ДИ: 1,03–2,40) [8].
Следует отметить, что число пациентов с НАЖБП неуклонно растет. Согласно данным метаанализа Riazi K. et al. (2022) по оценке встречаемости НАЖБП [9], включившего 72 публикации с выборкой 1 030 160 человек из 17 стран, общая распространенность заболевания в мире равна 32,4% (95% ДИ: 29,9–34,9), увеличиваясь с течением времени. Сходные результаты были получены и в азиатской популяции (237 исследований, 13 044 518 участников), где общая частота НАЖБП (независимо от метода диагностики) составила 29,62% (95% ДИ: 28,13–31,15) [10].
В России исследование DIREG 2 (2015) показало, что НАЖБП присутствует у 37,3% жителей страны, при этом число больных с циррозом печени в ее исходе достигает 5% [11]. Следует добавить, что распространенность этой патологии продолжает увеличиваться: в многоцентровом исследовании ЭССЕ-РФ (Эпидемиология сердечно-сосудистых заболеваний и их факторов риска в регионах РФ), охватившем 5161 респондента с НАЖБП в возрасте 25–64 лет, высокий индекс стеатоза печени FLI ≥60 ед, служащий предиктором стеатоза печени, был выявлен у 38,5% мужчин и 26,6% женщин [12]. Настораживает факт роста числа пациентов с «худой» НАЖБП, верифицируемой у лиц с нормальной массой тела [13].
Таким образом, НАЖБП становится такой же неинфекционной эпидемией, как рак, ожирение, сахарный диабет и ССЗ, а мультидисциплинарный подход к лечению этого заболевания определяет не только улучшение показателей здоровья печени, но и здоровья пациента в целом [14, 15]. НАЖБП-ассоциированная коморбидность развивается параллельно основному «печеночному» процессу (рис. 1) [16].
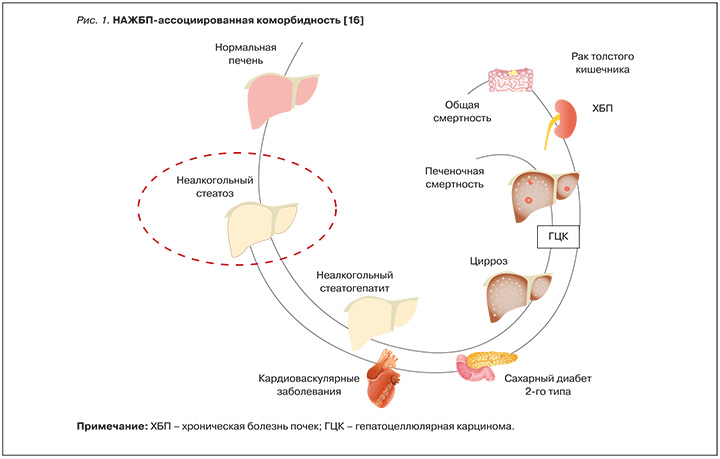
НАЖБП КАК МУЛЬТИДИСЦИПЛИНАРНАЯ ПРОБЛЕМА
К сожалению, НАЖБП в значительной степени недооценивается во всем мире, что ограничивает предоставление передовой медицинской помощи пациентов и реализацию национальных планов обеспечения готовности к выявлению и лечению этой патологии. В недавно опубликованном документе, подготовленном The Economist Intelligence Unit при поддержке Европейской ассоциации изучения печени (EASL) и Международного фонда печени (EILF), подчеркивается, что необходимо бить тревогу по поводу НАЖБП как глобальной проблемы общественного здравоохранения; при этом предлагаются пути повышения осведомленности об этом заболевании, формируются программы раннего выявления патологии с последующей стратификацией риска различных ее осложнений [17]. Являясь междисциплинарной проблемой, НАЖБП требует мультидисциплинарного подхода, и врач-терапевт, как главный специалист первичного звена медицинской помощи, должен четко понимать те задачи по диагностике этого заболевания и тактике ведения соответствующей категории больных, которые стоят перед ним [18].
Знаковым моментом в нашей стране стало появление третьей версии совместных клинических рекомендаций Российского научного общества терапевтов и Научного общества гастроэнтерологов России «Неалкогольная жировая болезнь печени» (2021), которые были одобрены научным советом Минздрава России в 2022 г. (ID 748, размещены 11.11.2022, https://cr.minzdrav.gov.ru/recomend/748_1). Этот документ позволяет выяснить, какой группе пациентов нужно проводить активный скрининг этого заболевания, кто находится в зоне риска его развития, а также определиться с методами, доступными к использованию практикующим врачом.
ГРУППЫ РИСКА И ПОДХОДЫ К ДИАГНОСТИКЕ
В зоне риска развития НАЖБП прежде всего находятся пациенты с метаболическим синдромом, предиабетом и СД 2 [6, 19]. Обычно НАЖБП характеризуется бессимптомным течением и часто диагностируется случайно, например в процессе обследования больных по поводу АГ, ИБС, заболеваний периферических сосудов, ожирения, СД 2 при проведении им ультразвукового исследования (УЗИ) печени, отражающего наличие стеатоза печени, или при выявлении повышенного уровня аланинаминотрансферазы (АЛТ), аспартатаминотрасферазы (АСТ), гамма-глутамилтранспептидазы (ГГТП).
УЗИ печени позволяет достоверно верифицировать стеатоз средней и тяжелой степени тяжести и дает дополнительную информацию о гепатобилиарной системе; кроме того, согласно клиническим рекомендациям, это исследование рекомендуется в качестве метода первой линии инструментальной диагностики [1]. При УЗИ у пациентов с НАЖБП наблюдаются дистальное затухание эхосигнала, диффузная гиперэхогенность печени («яркая белая печень»), увеличение эхогенности печени по сравнению с почками, нечеткость и обеднение сосудистого рисунка.
Каков алгоритм обследования пациента с предполагаемым диагнозом НАЖБП? Начальное обследование включает, во-первых, уточнение факта употребления алкоголя (о неалкогольном генезе поражения печени свидетельствует употребление менее 20 г этанола в сутки женщинами и менее 30 г/сут мужчинами), во-вторых, изучение семейного и личного анамнеза. При необходимости должны быть исключены другие заболевания печени (вирусные гепатиты, лекарственное поражение печени, ассоциированное с применением метотрексата, амиодарона, тамоксифена, стероидов) [20], алкогольное поражение печени [21], болезнь Вильсона, гемохроматоз, холестаз) и альтернативные диагнозы, сопровождающиеся формированием стеатоза печени и повышением уровня АСТ и АЛТ (гипотиреоз, целиакия, дефицит α- антитрипсина).
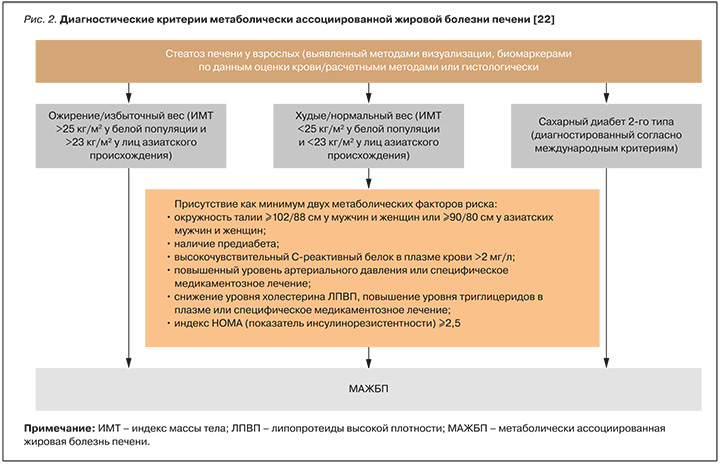
Измерение объема талии, расчет индекса массы тела (ИМТ) – следующий важный и неотъемлемый компонент обследования пациента с подозрением на НАЖБП, а оценка таких биохимических показателей, как уровень гликемии натощак, общего холестерина, холестерина липопротеинов высокой и низкой плотности, триглицеридов сыворотки крови, мочевой кислоты, С-реактивного белка, позволяет стратифицировать риск развития метаболически ассоциированной жировой болезни печени (МАЖБП) [22] даже у лиц с нормальной массой тела (рис. 2). Важно подчеркнуть, что при проведении лабораторного обследования пациента с подозрением на НАЖБП такие заболевания, как предиабет и СД 2, могут быть выявлены впервые!
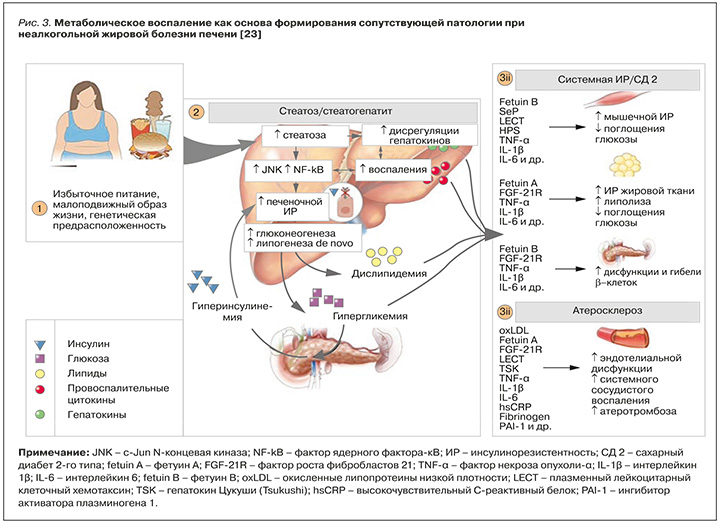
Сегодня не вызывает сомнения факт, что НАЖБП – это метаболическое заболевание, а именно печеночное проявление системного метаболического расстройства. Гепатоцит – «первая скрипка в симфоническом оркестре метаболического синдрома» уже на стадии стеатоза печени (рис. 3), а метаболическое воспаление, возникающее в этот период, является двигателем, вызывающим клеточную дисфункцию, гибель клеток и неблагоприятные последствия с формированием ремоделирования в различных тканях и органах [23].
Следующий этап обследования пациентов с НАЖБП – оценка выраженности фиброза печени. С этой целью используются методы неинвазивной диагностики, которые обсуждаются во всех рекомендациях по диагностике и лечению этого заболевания [1, 24–26]. Применение простых доступных неинвазивных маркеров фиброза позволяет уже на уровне первичной медицинской помощи определить дальнейшую тактику ведения пациента с впервые диагностированной НАЖБП, идентифицировать пациентов с худшим прогнозом. Стратификация риска включает сердечно-сосудистые и печеночные осложнения.
Простым и удобным индексом для выявления пациентов с более выраженным фиброзом служит индекс NFS, который рассчитывается по следующей формуле (NAFLD fibrosis score) [27]: NFS = -1,675 + 0,037 × возраст (годы) + 0,094 × ИМТ (кг/ м2) + 1,13 × гипергликемия натощак или СД (да = 1, нет = 0) + 0,99 × АСТ/АЛТ (ед/л) - 0,013 × количество тромбоцитов (×109/л) - 0,66 × альбумин (г/дл). При значениях NFS <-1,455 предполагается отсутствие значительного фиброза (F0–F1 fibrosis), показатели от -1,455 до 0,675 соответствую серой зоне, величина >0,675 – предиктор фиброза (F3–F4 fibrosis).
Первоначально разработанная для оценки фиброза печени у пациентов с коинфекцией хроническим вирусом гепатита С и ВИЧ шкала FIB-4 была расширена за пределы этого первоначального применения и в настоящее время активно используется у пациентов с НАЖБП. FIB-4 рассчитывается по следующей формуле: возраст (лет) × АСТ/ (тромбоциты (109/л) × √АЛТ). Если рассчитанное значение <1,45, то с достоверностью порядка 90% можно утверждать об отсутствии значимого фиброза печени, если полученный показатель >3,25, то с большой вероятностью можно говорить о наличии фиброза стадии 4–6 по шкале Ishak. Добавим, что, согласно литературным данным, для исключения (с вероятностью 90–95%) тяжелого фиброза у больных НАЖБП значение индекса FIB-4 должно составлять <1,3 [28]. В целях определения наличия выраженного фиброза при НАЖБП шкала FIB-4 может использоваться в сочетании с NFS.
Если показатели NFS и FIB-4 свидетельствуют об отсутствии фиброза печени (<-1,455 и <1,30 соответственно), лечащий врач должен рекомендовать пациенту соответствующие изменения образа жизни и диеты, включая меры по снижению веса (если это необходимо), с продолжением наблюдения. При выраженном фиброзе (NFS >0,676 и FIB-4 >2,67) пациенты должны быть немедленно направлены к гепатологу для дальнейшего тестирования и оценки. Пациенты серой зоны должны быть направлены на консультацию к гепатологу для дальнейшего тестирования с помощью транзиторной эластографии [29].
НАЖБП находится в центре внимания не только врачей-терапевтов и гастроэнтерологов, но и кардиологов [30, 31]. Риск развития сердечно-сосудистых событий у пациентов с НАЖБП коррелирует с выраженностью стеатоза печени [32], увеличиваясь по мере формирования и прогрессирования фиброза [31]. Используя данные УЗИ печени, а также показатели индекса FLI (Fatty Liver Index) [33], можно оценить выраженность стеатоза печени и определить группу дальнейшего скрининга неблагоприятного сердечно-сосудистого прогноза:
FLI = [e 0,953 × ln (триглицериды) + 0,139 × ИМТ + 0,718 × ln (GGT) + 0,053 × окружность талии − 15,745]/ [1 + e 0,953 × ln (триглицериды) + 0,139 × ИМТ + 0,718 × ln (GGT) + 0,053 × окружность талии − 15,745] × 100.
Значение FLI может варьировать от 0 до 100, при этом FLI <30 исключает НАЖБП (чувствительность 87%), тогда как FLI ≥60 указывает на ее наличие (специфичность 86%) с хорошей диагностической точностью, равной 0,84 (95% ДИ: 0,81–0,87) [34].
НАЖБП И СЕРДЕЧНО-СОСУДИСТЫЙ РИСК
В настоящее время удобным инструментом оценки сердечно-сосудистого риска на этапе первичного звена служит обновленный SCORE алгоритм – SCORE-2: он позволяет оценить 10-летний риск смерти и смертельных случаев ССЗ (инфарк-та миокарда, инсульта) у практически здоровых людей в возрасте 40–69 лет с факторами риска, которые не лечились или были стабильными в течение нескольких лет. Важно, что диаграммы SCORE-2 не распространяются на лиц с документально подтвержденным ССЗ, другими состояниями высокого риска, такими как СД, семейная гиперхолестеринемия, другими генетическими или редкими нарушениями липидов или артериального давления, хроническим заболеванием почек, а также на беременных женщин. У лиц старше 70 лет используется шкала SCORE-2-OР. Пациенты с НАЖБП и выявленным сердечно-сосудистым риском должны быть направлены на консультацию к кардиологу.
Хочется отметить, что сегодня работа врача первичного звена с больными НАЖБП значительно облегчилась в связи с появлением медицинских онлайн-калькуляторов, которые позволяют быстро и просто рассчитать все неинвазивные индексы оценки, представленные в клинических рекомендациях [1]: FLI [35]; NFS [36]; FIB-4 [37]; SCORE-2 [38]. Таким образом, сегодня врач-терапевт первичного звена является не только главной фигурой в диагностическом процессе выявления НАЖБП, но и активным участником формирования профилактического направления современной медицины.
НАПРАВЛЕНИЯ КОРРЕКЦИИ НАЖБП
На следующем этапе ведения пациента терапевт должен обсудить с ним необходимые мероприятия по изменению характера питания и физической активности, имеющих принципиальное значение для регресса стеатоза и стеатогепатита при НАЖБП [1]. Метаанализ 40 исследований с участием 35 548 участников, оценивавший семь разных диетических программ, показал, что средиземноморская диета и программа рациона с низким содержанием жиров в сочетании с физической активностью снижают смертность от всех причин и частоту нефатальных инфарктов миокарда у пациентов с повышенным риском ССЗ, а использование средиземноморской диеты позволяет еще и уменьшить вероятность инсульта [39].
Физическая активность и специально разработанные упражнения приносят пользу независимо от потери веса и представляют собой основные методы лечения пациентов с НАЖБП: как аэробные, так и силовые тренировки эффективно уменьшают стеатоз печени [40]. Кроме того, физические упражнения у пациентов с НАЖБП ассоциируются с улучшением функции эндотелия. Благодаря влиянию на мышечную массу физическая активность снижает риск саркопении и улучшает кардиореспираторную выносливость, улучшает чувствительность к инсулину в периферических тканях и печени и метаболизм глюкозы (или гликемический контроль при клинически манифестном диабете), замедляя прогрессирование НАЖБП и снижая общий сердечно-сосудистый риск. Кроме того, она уменьшает системное воспаление, снижает артериальное давление и дислипидемию [40]. При этом программа упражнений должна быть адаптирована к предпочтениям и возможностям пациента в зависимости от уровня физической подготовки, стадии заболевания печени и других сопутствующих заболеваний. Общие рекомендации включают 150 мин еженедельных аэробных упражнений средней интенсивности, сопровождаемых силовыми тренировками и тренировками на выносливость не менее 2–3 раз в неделю (с избеганием занятий несколько дней кряду): 8–10 упражнений с вовлечением основных групп мышц, с 10–15 повторениями в день от умеренной до высокой интенсивности. Кроме того, простое сокращение или разбивка времени сидячего образа жизни на несколько минут ходьбы также должно быть терапевтической целью для пациентов, которые не могут посещать структурированные программы упражнений. Поскольку большинство пациентов с НАЖБП страдают ожирением, особое внимание следует уделить программе упражнений, которая будет выполнима, а также приведет к значимой потере веса (10%) и улучшению кардиореспираторного состояния [40].
Не вызывает сомнений факт того, что как аэробные, так и анаэробные упражнения продолжительностью 20–60 мин за сеанс при умеренной интенсивности и проведении 4–7 дней в неделю в течение как минимум 6 мес (с ограничением диеты или без него) могут привести к улучшению гистологических показателей, уменьшить или даже устранить стеатоз [41] и снизить повреждения печени у пациентов с неалкогольным стеатогепатитом [42].
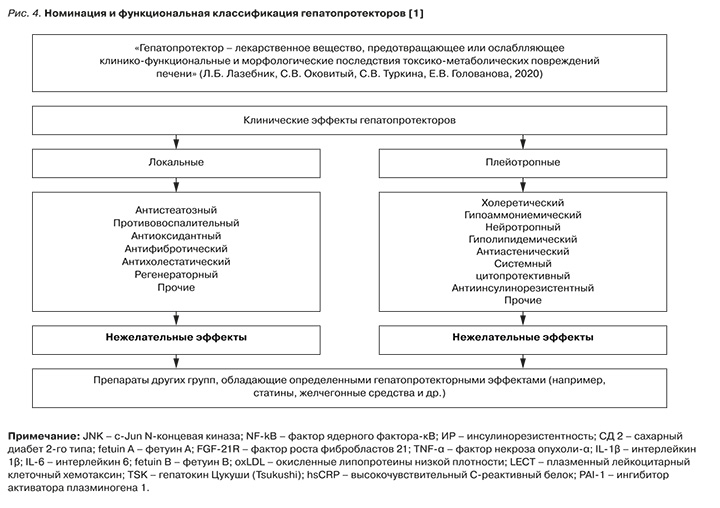
Важным аспектом новых отечественных клинических рекомендаций «Неалкогольная жировая болезнь печени у взрослых» (2022) в разделе «Лечение» стала номинация и функциональная классификация гепатопротекторов, обсуждение их доказательной базы и плейотропных эффектов (рис. 4). Как следует из представленных на рисунке 4 данных, сегодня можно говорить не только о локальных антистеатозных, противовоспалительных, антихолестатических и эффектах гепатопротективных препаратов, но и об их гиполипидемических, антиинсулинорезистентных, гипогликемизирующих, нейротропных, гипоаммониемийных, антиастенических свойствах. Применение этой группы лекарственных средств при НАЖБП, ассоциированной с коморбидностью, в составе комплексной терапии на этапе первичной медицинской помощи служит важным звеном профилактического подхода в медицине.



