Неалкогольная жировая болезнь печени (НАЖБП) характеризуется избыточной аккумуляцией жира в печени в отсутствие употребления гепатотоксичных доз алкоголя и других причин вторичной жировой инфильтрации этого органа. Гистологические проявления заболевания варьируют от стеатоза до неалкогольного стеатогепатита, цирроза и реже гепатоцеллюлярной карциномы [1].
В последние годы НАЖБП занимает лидирующее место в структуре хронических заболеваний печени и выступает наиболее частой причиной гиперферментемии и развития криптогенного цирроза [2]. Частота НАЖБП в мире составляет 6,3–33% [3], распространенность неалкогольного стеатогепатита варьирует от 1–2 до 7–9% [4]. В России встречаемость НАЖБП достигла 37,1% [5]. Рост патологии обусловлен улучшением ее диагностики, а также увеличением частоты ассоциированного с ней метаболического синдрома (МС) [6].
В настоящее время более миллиарда людей имеют избыточную массу тела, у 300 млн диагностируется ожирение, которое служит важным предиктором формирования метаболической патологии печени [1, 7].
Предполагается, что НАЖБП представляет собой печеночную манифестацию МС, который может оказывать негативное влияние на эволюцию заболевания. Так, абдоминальное ожирение, нарушение углеводного обмена, гипер- и дислипидемия как проявления МС не только являются факторами риска развития НАЖБП, но и предположительно сопряжены с выраженностью стеатоза, формированием и утяжелением воспалительных и фибротических изменений в печени [8]. Однако взаимоотношения метаболического синдрома с особенностями течения НАЖБП изучены недостаточно.
Целью нашего исследования явилось уточнение распространенности и влияния метаболического синдрома на картину неалкогольной жировой болезни печени.
МАТЕРИАЛ И МЕТОДЫ
Обследовано 208 пациентов с НАЖБП (101 женщина и 107 мужчин) в возрасте от 18 до 65 лет (средний возраст 47,94±0,80 лет). У 134 из них болезнь протекала с нормальными показателями аминотрансфераз, в 74 случаях наблюдался вариант заболевания с повышением активности ферментов печени. Критерии включения: больные в возрасте от 18 до 65 лет с диагнозом НАЖБП, подтвержденным методами визуализации и/или гистологически, согласие на участие в исследовании.
К критериям исключения относились хронические заболевания печени другой этиологии, употребление алкоголя в гепатотоксических дозах, острые и обострения хронических клинически значимых соматических заболеваний, злокачественные новообразования, трансплантация органа в анамнезе, алкогольная или наркотическая зависимость, психические заболевания, отказ пациента от дальнейшего участия в исследовании.
Большинство больных (80,8%) имели нормальные значения билирубина крови; среднее сывороточное содержание аспарагиновой (АсАТ) и аланиновой аминотрансфераз (АлАТ) составило 33,97±15,2 и 46,45±2,64 ед./л соответственно. Мезенхимально-воспалительный синдром встречался у 40,4% обследованных пациентов. Показатели скорости оседания эритроцитов (СОЭ) и С-реактивного белка достигали соответственно 12,08±0,59 мм/ч и 4,87±0,27 мг/л. Биохимические признаки холестаза отмечены в 20% случаев. Стеатоз печени, верифицированный по данным УЗИ, встречался преимущественно в виде 1 (40,8%) и 2 степеней (38,5%).
Гистологическое подтверждение диагноза было выполнено у 40 пациентов НАЖБП. Морфологические изменения оценивались в соответствии с критериями E.M. Brunt и соавт., а также усовершенствованной шкалой активности неалкогольного стеатогепатита (NAS-II). Стеатоз 1, 2 и 3 степеней наблюдался в 20; 32,5 и 47,5% случаев соответственно. Значения шкалы NAS- II 1–2 балла имели место у 7,5% пациентов, 3–4 балла – у 35%, 5 и более баллов – у 57,5% обследованных. Отсутствие фиброза или минимальный фиброз (F0-1) зарегистрированы у 30% больных, умеренный фиброз (F2) наблюдался в 47,5% случаев, у 22,5% пациентов выявлен тяжелый фиброз печени (F3).
Диагноз МС устанавливали при наличии 3 и более критериев: объем талии >94 см для мужчин или >80 см для женщин; уровень холестерина липопротеинов высокой плотности (ЛПВП) <40 мг/ дл для мужчин (1,03 ммоль/л) или <50 мг/ дл (1,29 ммоль/л) для женщин; уровень триглицеридов сыворотки ≥150 мг/дл (1,7 ммоль/л); систолическое АД ≥130 мм рт.ст. или диастолическое АД ≥85 мм рт.ст.; уровень глюкозы крови натощак ≥110 мг/дл (6,1 ммоль/л).
Обследование соответствовало требованиям Хельсинской декларации Всемирной медицинской ассоциации об этических принципах проведения медицинских исследований с участием людей в качестве субъектов. Пациенты дали информированное согласие на проведение исследования, одобренного этическим комитетом университета.
Результаты были статистически обработаны с помощью пакета адаптированных для медико-биологических исследований программ (IBM SPSS Statistics 24). Применяли двухвыборочный t-критерий Стьюдента, критерий χ2 с поправкой Йейтса. Достоверными считали результаты при уровне значимости различий p ≤0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
По нашим данным, при НАЖБП определялись увеличенные объем талии, соотношение «объем талии/объем бедер» и индекс массы тела (ИМТ) вне зависимости от пола больных. При этом соотношение «объем талии/объем бедер» у женщин было ниже (0,98±0,01 и 1,05±0,01 см соответственно; р <0,05), а объем бедер (110,72±1,29 и 105,74±1,03 см; р <0,05) и индекс массы тела (34,25±0,57 и 32,20±0,48 кг/см2; р <0,05) выше, чем у мужчин. Показатели объема талии у женщин и мужчин не были сопряжены с полом (107,79±1,41 и 110,22±1,41 см соответственно; р >0,05).
Нормальные значения ИМТ были выявлены только у 4,3% больных. Удельный вес лиц с ожирением (ИМТ >30 кг/см2) составил 75%, при этом ожирение I, II и III степени встречалось соответственно в 55,8; 30,1 и 14,1% случаев. Частота абдоминального ожирения колебалась от 82,2 до 92,3% (увеличенные объем талии и соотношение «объем талии/объем бедер» соответственно), что совпадает с данными других авторов, согласно которым абдоминальное ожирение отмечается в 51–100% случаев НАЖБП [3].
Установлено, что у пациентов с абдоминальным ожирением (увеличенным объемом талии) чаще регистрировались 2 и 3 степени стеатоза печени, а значения СОЭ, С-реактивного белка и шкалы активности неалкогольного стеатогепатита были выше, чем в случаях его отсутствия. Частота НАЖБП с цитолизом, тяжелым фиброзом, а также величины аминотрансфераз не были связаны с абдоминальным ожирением (табл.).
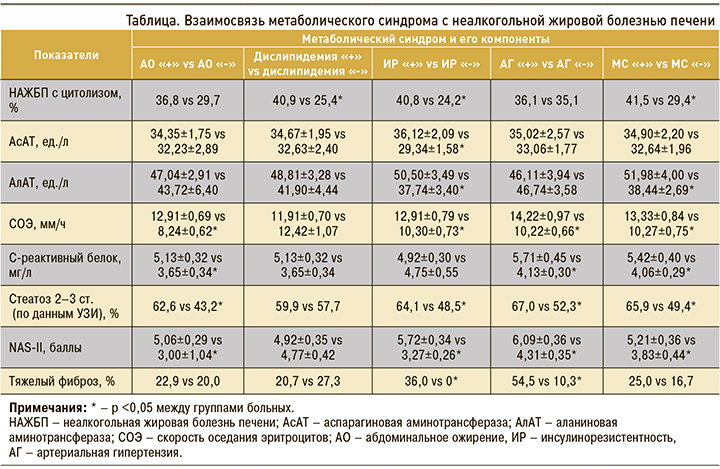
Ранее было отмечено, что высокий риск развития неалкогольного стеатогепатита может быть отчасти объяснен наличием ожирения [9]. ИМТ обладал способностью разграничивать неалкогольный стеатогепатит и стеатоз печени, коррелируя с выраженностью печеночного фиброза, а объем талии, соотношение «объем талии/объем бедер» и площадь висцерального жира были независимыми детерминантами тяжести некровоспалительных изменений в печени [10].
Дислипидемия регистрируется в 67–69% случаев НАЖБП, преимущественно в виде увеличенных сывороточных уровней триглицеридов, общего холестерина, реже сниженных значений холестерина ЛПВП [3, 5, 9]. Так, гиперхолестеринемия, гипертриглицеридемия и сниженные уровни холестерина ЛПВП встречались у 55, 66 и 39% пациентов с НАЖБП соответственно [11]. И, наоборот, проявления НАЖБП наблюдались у 20–80% больных с дислипидемией [12].
По нашим данным, дислипидемия при НАЖБП характеризовалась увеличенными уровнями общего холестерина (5,81±0,09 ммоль/л), триглицеридов (2,42±0,13 ммоль/л), холестерина липопротеинов низкой плотности (ЛПНП) (3,64±0,07 ммоль/л), тогда как холестерин ЛПВП (1,19±0,02 ммоль/л) имел близкие к нормальным величины. Гиперхолестеринемия, гипертриглицеридемия, сниженные количества ЛПВП и повышенные значения ЛПНП отмечены в 68,3; 65,9; 55,3; 60,6% случаев НАЖБП. Нормальные показатели липидного профиля зарегистрированы лишь у 8,7% пациентов.
Нами не установлено зависимости стеатоза и фиброза печени, значений СОЭ, С-реактивного белка, АлАТ, АсАТ и шкалы активности неалкогольного стеатогепатита от колебаний сывороточной концентрации триглицеридов, однако неалкогольный стеатогепатит чаще встречался в случаях гипертриглицеридемии (см. табл.). Тем не менее ранее была продемонстрирована позитивная корреляция повышенных сывороточных уровней общего холестерина и сниженных концентраций холестерина ЛПВП с тяжестью печеночного фиброза при НАЖБП, а также отмечена взаимосвязь содержания триглицеридов в крови с выраженностью стеатоза печени [10].
Гиперинсулинемия и инсулинорезистентность тесно сопряжены с НАЖБП даже в случаях нормальных массы тела и толерантности к глюкозе [9]. Обнаружение стеатоза печени в половине случаев сахарного диабета 2 типа подчеркивает роль нарушений углеводного обмена в развитии НАЖБП [9]. С другой стороны, высказывается точка зрения, что НАЖБП и особенно неалкогольный стеатогепатит могут выступать в качестве предикторов манифестации сахарного диабета [3]. Гипергликемия натощак, гиперинсулинемия или инсулинорезистентность регистрировались у 76; 58,9 и 68,6% пациентов с НАЖБП [11].
У больных наблюдались повышенные значения HOMA-индекса (4,33±0,24), нормальные уровни инсулина (17,08±0,81 мкМЕ/мл) и глюкозы (5,54±0,05 ммоль/л) в крови. Нарушения углеводного обмена (23,6% случаев) проявлялись в виде нарушенной гликемии натощак (14,5%) или толерантности к глюкозе (9,1%). Пациенты с сахарным диабетом в исследование не включались. Частота гиперинсулинемии не превышала 15,4%, однако инсулинорезистентность зарегистрирована в 2/3 случаев НАЖБП.
Ранее была отмечена корреляция глюкозы крови с тяжестью стеатоза печени, а также взаимосвязь сахарного диабета с количеством печеночного жира и показателями АлАТ и g-глютамилтранспептидазы [13]. Сахарный диабет способствовал утяжелению гистологической картины НАЖБП и росту смертности больных [14], а также увеличивал частоту формирования неалкогольного стеатогепатита [10] за счет индуцирования оксидативного стресса и фиброгенного потенциала звездчатых клеток.
По нашим данным, при сочетании НАЖБП с синдромом инсулинорезистентности чаще выявлялись цитолитический вариант болезни, тяжелый фиброз, умеренный и тяжелый стеатоз печени, а также более высокие значения СОЭ, аминотрансфераз и шкалы активности неалкогольного стеатогепатита (см. табл.).
Избыточная аккумуляция жира в печени способствует развитию артериальной гипертензии [15], встречающейся в 12–69,9% случаев НАЖБП и у 64% больных неалкогольным стеатогепатитом [3, 6, 11]. Выявлена ассоциация НАЖБП как с артериальной гипертензией [16], так и с нарушениями геометрии и диастолической функции левого желудочка [17].
Артериальная гипертензия (эссенциальная форма) обнаружена в 46,6% случаях НАЖБП. Она была сопряжена с умеренным и тяжелым стеатозом печени, тяжелым фиброзом, а также с более высокими показателями СОЭ, С-реактивного белка и шкалы активности неалкогольного стеатогепатита (см. табл.).
Считается, что артериальная гипертензия служит независимым предиктором НАЖБП, которая отмечалась у 40–49,5% лиц с этим заболеванием [16, 18]. В случаях неалкогольного стеатогепатита нарушения регуляции артериального давления коррелировали с тяжестью печеночного стеатоза [9]. Общим звеном патогенеза этих заболеваний может быть инсулинорезистентность, так как, будучи инсулинорезистентным состоянием, артериальная гипертензия характеризуется гиперинсулинемией и снижением чувствительности тканей к инсулину [18].
Факт сочетания МС с НАЖБП не вызывает сомнений. Так, у 90% больных НАЖБП определялось не менее одного критерия МС, в 35–75% случаев – три и более компонента. Коморбидность МС и НАЖБП варьировала от 41,3–42,5 до 78% [3, 6, 11].
МС наблюдался у 59,1% больных НАЖБП, в 2,4% случаев критерии синдрома отсутствовали. Наличие МС сопровождалось возрастанием частоты НАЖБП с цитолизом, случаев 2 и 3 степени стеатоза печени, значений АлАТ, СОЭ, С-реактивного белка, а также показателей шкалы активности неалкогольного стеатогепатита, но не было связано с фиброзом печени и с показателями АсАТ (см. табл.). В ряде работ установлена взаимосвязь МС с прогрессированием НАЖБП в неалкогольный стеатогепатит и цирроз печени [19].
Выявленное негативное влияние МС и его компонентов на течение НАЖБП может быть отражением увеличенной продукции медиаторов системного воспаления [20], усиливающих воспалительную миграцию лейкоцитов и процессы фиброгенеза в печени [21]. Так, активация и дисфункция эндотелия, наблюдаемые при МС, сопровождаются усиленной экспрессией цитокинов и молекул адгезии [22]. На фоне ожирения висцеральная жировая ткань способна к гиперэкспрессии мРНК и протеинов молекул адгезии [23], а их увеличенная концентрация в крови у больных с ожирением или дислипидемией выступает предиктором воспаления и эндотелиальной дисфункции [24, 25]. Повышенное содержание адгезинов в крови в случаях синдрома инсулинорезистентности связано со способностью гипергликемии и конечных продуктов гликирования усиливать транскрипцию их генов [26].
Таким образом, МС и его компоненты являются сами и ассоциированы с факторами риска прогрессирования НАЖБП. Для уточнения роли гиперпродукции медиаторов межклеточных взаимодействий во взаимосвязи МС с тяжестью НАЖБП необходимо проведение дальнейших исследований, что позволит выявить более точные диагностические инструменты и определить оптимальные терапевтические стратегии, нивелирующие негативную роль факторов риска.
ЗАКЛЮЧЕНИЕ
- МС наблюдается у 59,1% больных НАЖБП и связан с усилением дистрофических и воспалительно-некротических изменений в печени.
- Тяжесть стеатоза и воспаления при НАЖБП сопряжены с абдоминальным ожирением, инсулинорезистентностью и артериальной гипертензией, а проявления печеночного фиброза зависимы от нарушений чувствительности тканей к инсулину и регуляции артериального давления.


