Синдром обструктивного апноэ сна (СОАС) является респираторным заболеванием, характеризующимся наличием апноэ–гипопноэ во время сна, приводящим к эпизодам прерывистой гипоксии. Взаимосвязь между СОАС, факторами риска сосудистых заболеваний, метаболическим синдромом (МС) и самими сосудистыми заболеваниями была описана в крупных проспективных клинических исследованиях [1, 2]. Тем не менее основные механизмы, связывающие СОАС, сосудистую патологию и МС остаются неясными. В нескольких исследованиях было установлено, что пациенты СОАС с МС имеют эндотелиальную дисфункцию [3, 4], взаимосвязанную с прерывистой гипоксией и последующей генерацией активных форм кислорода (ROS), провоспалительных молекул, маркеров повышенного окислительного стресса, а также ряда маркеров расстройств коагуляции и нарушений липидного обмена [5]. Интересно, что терапия интермиттирующей гипоксемии постоянным положительным давлением в дыхательных путях (СРАР-терапия) приводит к улучшению функции эндотелия [6–8].
СРАР с функцией автоадаптации к вдоху и выдоху пациента (A-Flex-терапия) устраняет патофизиологические эффекты апноэ, уменьшает симпатический тонус и флуктуацию внутригрудного отрицательного давления. Такая терапия препятствует повышениям артериального давления (АД) и снижает постнагрузку левого желудочка (ЛЖ). Кроме того, A-Flex-терапия путем устранения гипоксических эпизодов увеличивает доставку кислорода тканям и снижает степень «кислородного дефицита» [9].
 Цель исследования: изучение 6-месячных эффектов СРАР с функцией автоадаптации к вдоху и выдоху пациента (A-Flex-терапия) на основные показатели углеводного, липидного обмена, уровень АД у пациентов СОАС+МС.
Цель исследования: изучение 6-месячных эффектов СРАР с функцией автоадаптации к вдоху и выдоху пациента (A-Flex-терапия) на основные показатели углеводного, липидного обмена, уровень АД у пациентов СОАС+МС.
МАТЕРИАЛЫ И МЕТОДЫ
Исследуемая группа пациентов. В одноцентровое проспективное исследование нами были включены 30 пациентов с МС и апноэ во сне (19 мужчин [63,3%] и 11 женщин [36,7%]), подписавших информированное согласие, имевших индекс апноэ–гипопноэ (AHI) более 15 соб./час, находившихся в возрастном интервале 35–75 лет (51,70±11,54 года).
Всех пациентов подвергали врачебному осмотру и комплексному медицинскому обследованию с дополнительным акцентом на историю, симптомы и маркеры расстройств дыхания во сне. Уточняли длительность и начало набора веса, количество предшествующих попыток его снижения, прием лекарственных препаратов и/или биологически активных добавок для коррекции массы тела, особенности режима питания и калорийности суточного рациона, физической активности. МС устанавливали в соответствии с критериями ATP-III Американской ассоциации сердца [10]. Критериями исключения являлись: беременность, лактация, сахарный диабет 1 и 2 типов, симптоматические (синдромальные) формы ожирения; органическое заболевание (нарушение функции щитовидной железы, почечная и печеночная недостаточность, декомпенсированная сердечная недостаточность, тяжелые нарушения ритма сердца, перенесенный инфаркта миокарда и инсульт в течение последних 3-х мес до скрининга); психическое заболевание согласно анамнезу и/или клиническому обследованию; тяжелое системное воспалительное заболевание; исключались курильщики, пациенты, имеющие днем сатурацию артериальной крови SpO2 <94% (FiO2=21%), пациенты с наркотической и алкогольной зависимостью.
При проведении A-Flex-терапии за каждым пациентом осуществляли персональный контроль с использованием специализированной программы мониторирования длительности, эффективности и толерантности к A-Flex (Encore Pro v. 2.2.4 Philips Respironics, США). Критериями исключения или прекращения A-Flex-терапии являлись: отсутствие показаний к СРАР; предыдущее лечение методом СРАР-терапии; отказ, непереносимость или использование СРАР-терапии менее 4-х ч в ночь; любые изменения в назначении лекарственных препаратов, оказывающих влияние на АД и функцию эндотелия в течение первых 3-х мес терапии. Возникновение в ходе A-Flex-терапии какого-либо острого или хронического заболевания, которое теоретически могло оказывать влияние на оцениваемые показатели, рассматривались нами как критерий исключения.
 Исследование проведено на кафедре фтизиатрии и пульмонологии лечебного факультета МГМСУ им. А.И. Евдокимова на базе Центра респираторной медицины (ЦРМ) и больницы Центросоюза РФ. Исследование было одобрено межвузовским этическим комитетом МГМСУ им. А.И. Евдокимова.
Исследование проведено на кафедре фтизиатрии и пульмонологии лечебного факультета МГМСУ им. А.И. Евдокимова на базе Центра респираторной медицины (ЦРМ) и больницы Центросоюза РФ. Исследование было одобрено межвузовским этическим комитетом МГМСУ им. А.И. Евдокимова.
Полиграфическое исследование (ПГ). Всем пациентам проводили ночное полиграфическое исследование по стандартизированному протоколу кардиореспираторного мониторирования обструктивного апноэ сна в соответствии с правилами и рекомендациями Американской академии медицины сна (AASM) [11]. Использовали полиграф «Alice PDx» (Philips Respironics, США) с программным обеспечением «Sleepware G3» (Philips Respironics, США). Исследование начиналось в 00:00 часов и оканчивалось в 07:30 утра с регистрацией основных респираторных полиграфических показателей: 1) ротоносового воздушного потока и храпа; 2) грудного и брюшного дыхательного усилия; 3) пульсоксиметрической регистрацией SpO2 и частоты сердечных сокращений (ЧСС). Данные полиграфии обрабатывались вручную квалифицированным персоналом ЦРМ.
Апноэ определялось как прерывание ротоносового воздушного потока более 10 с, гипопноэ – как снижение ротоносового воздушного потока на 50% длительностью более 10 с со снижением SpO2 более чем на 4%. Индекс апноэ–гипопноэ (AHI) определялся как количество событий апноэ и гипопноэ за 1 ч регистрации, а индекс десатураций (ODI) – как число снижений SpO2 >4% за 1 ч регистрации. Оценивалась также средняя ночная сатурация (Sp02 mean).
Титрация СРАР-терапии (A-Flex-терапии). У пациентов с диагностированным СОАС A-Flex-терапия проводилась в соответствии с рекомендациями AASM [12]. Оптимальный лечебный уровень A-Flex-терапии титровался в домашних условиях с использованием аппаратов для автоматического выбора уровня СРАР («PR System One REMstar Auto CPAP Machine with A-Flex» Philips Respironics, США) в течение 5 дней после диагностического исследования. Оценивали основные индексы эффективности СРАР-терапии: AHI, степень воздушной утечки, среднее давление СРАР, податливость терапии в соответствии с международными требованиями [13]. Оптимальный уровень терапии определялся квалифицированным персоналом ЦРМ после программного анализа данных с устройств СРАР (Encore Pro v. 2.2.4 Philips Respironics, США).
Изучение эндотелиальной функции сосудов. Оценку эндотелиальной функции сосудов проводили по качеству периферического артериального тонуса (PAT-сигнал), определяемого путем пальцевой пробы [14]. Для регистрации РАТ-сигнала использовали оборудование «EndoPAT-2000» (ItamarMedical, Caesarea, Израиль) и оригинальную методику интерпретации результатов независимым от оператора способом с помощью патентованного программного обеспечения ItamarMedical [15]. Значение коэффициента РАТ исследуемой руки соотносилось с таковым контрольной руки, корректировалось с учетом системных факторов (температура помещения), что позволяло рассчитать индекс реактивной гиперемии (RHI). Кроме того, нами рассчитывался индекс аугментации (AI) – отношение ударной волны, возникающей во время увеличения давления в аорте, к отраженной волне во время систолы. Все исследования RHI и AI проводились в стандартизованных условиях (время, помещение, температура) квалифицированным персоналом ЦРМ.
Суточное мониторирование артериального давления (СМАД). АД измеряли с помощью амбулаторного устройства для 24-часовой регистрации («SpaceLabs 90207», Редмонд, Вашингтон, США). Предусматривалось измерение АД каждые 20 мин в течение 24 ч. Оценка степени артериальной гипертензии (АГ) и диагноз гипертонической болезни, наличие или отсутствие паттерна «dipper/non dipper» проводилась в соответствии с международными рекомендациями ESC/ESH [16].
 Статистический анализ. Количественные данные были выражены как среднее значение (M) и стандартное отклонение (SD) (M±SD). Тест Шапиро–Уилка использовался для оценки нормальности распределения признака. Мы использовали t-критерия Стьюдента для сравнения парных выборок после 6-ти мес СРАР-терапии по отношению к базовым величинам в случае их нормальности. При отсутствии таковой мы использовали парный ранговый критерий Вилкоксона. Корреляции Пирсона использовали для изучения возможной линейной зависимости между переменными вначале и после 6-ти мес СРАР-терапии. Для сравнения частот в независимых выборках использовался критерий хи-квадрат (χ2). Различия исследуемых параметров считались статистически значимыми при р<0,05. При 0,05<p<0,1 выносилось суждение о наличии статистической тенденции. Вся статистическая обработка материала проводилась с использованием программного обеспечения SSPS 15.0.
Статистический анализ. Количественные данные были выражены как среднее значение (M) и стандартное отклонение (SD) (M±SD). Тест Шапиро–Уилка использовался для оценки нормальности распределения признака. Мы использовали t-критерия Стьюдента для сравнения парных выборок после 6-ти мес СРАР-терапии по отношению к базовым величинам в случае их нормальности. При отсутствии таковой мы использовали парный ранговый критерий Вилкоксона. Корреляции Пирсона использовали для изучения возможной линейной зависимости между переменными вначале и после 6-ти мес СРАР-терапии. Для сравнения частот в независимых выборках использовался критерий хи-квадрат (χ2). Различия исследуемых параметров считались статистически значимыми при р<0,05. При 0,05<p<0,1 выносилось суждение о наличии статистической тенденции. Вся статистическая обработка материала проводилась с использованием программного обеспечения SSPS 15.0.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Базовые характеристики пациентов представлены в табл. 1. Исходно исследуемая группа представлена пациентами средней возрастной группы, преимущественно мужчинами, с выраженной сонливостью, тяжелым течением обструктивного апноэ сна, выраженной ночной гипоксемией, морбидным ожирением и выраженным МС. Средний комплаенс к A-Flex-терапии составил 5,3±1,6 ч/ночь (высокая приверженность). Изменения в ходе 6-месячной A-Flex-терапии иллюстративно представлены в табл. 2.
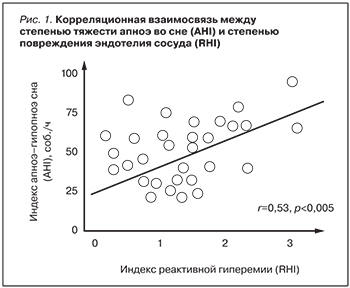
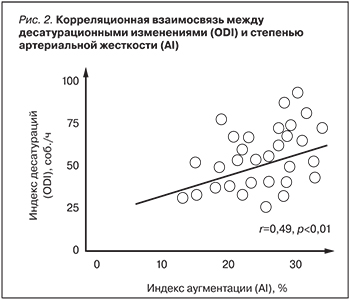
Основной задачей проводимой СРАР-терапии в режиме A-Flex являлось эффективное устранение СОАС со снижением индекса AHI <10 соб./час, что говорило о нормализации состояния, восстановлении нормального уровня потребления кислорода в ночной период времени. При этом СРАР-терапии положительно воздействовала на основной метаболизм и восстанавливала функцию эндотелия сосуда. Отражением этого является установленное нами достоверное снижение цифр САД и ДАД (p=0,004; p=0,003), нормализацию уровня гликированного гемоглобина (HbA1С) (p=0,03), нормализация индекса реактивной гиперемии (RHI) (p=0,004), нормализация индекса аугментации (AI) (p=0,003). Полученные данные хорошо согласуются с изменением клинической картины заболевания: исчезновением избыточной дневной сонливости, расширением двигательной активности, нормализацией ночного сна. При проведении корреляционного анализа нами установлено, что существует статистически значимая корреляция умеренной силы (r=0,53; p<0,01) между степенью тяжести апноэ во сне (AHI) и степенью повреждения эндотелия сосуда (RHI) (рис. 1). Сила корреляции в зависимости от коэффициента корреляции оценивалась сильной при r≥0,75, умеренной – при r=0,25-0,75, слабой – при r≤0,25. Не менее интересной представляется обнаруженная нами корреляция (r=0,49; p<0,01) между тяжестью десатурационных изменений при апноэ сна (ODI) и степенью артериальной жесткости (AI), связанной с ростом центрального АД и повышением постнагрузки на миокард ЛЖ (рис. 2).
Интересным является факт достоверного восстановления уровня тестостерона на нижней границе нормы при использовании A-Flex терапии (p=0,001). Такая находка не является случайной и, на наш взгляд, связана с устранением ночного «гипоксического удара» и восстановлением глубокого сна пациентов.
Оба заболевания, обструктивное апноэ во сне и МС, являются важными состояниями, резко повышающими риски кардиоваскулярных расстройств, особенно при синергизме действия. СРАР-терапия является терапией первой линии, особенно в случаях СОАС среднетяжелого и тяжелого течения. Однако она может быть крайне полезной терапией в случае сочетания метаболических расстройств или МС с обструктивным апноэ во сне. Нами были специально отобраны пациенты со среднетяжелым и тяжелым течением СОАС, имеющие МС или его компоненты. Мы обратили на них особое внимание, поскольку такие пациенты имеют максимальные риски смертельного исхода или кардиоваскулярных осложнений. Для устранения возможных искажений получаемых результатов нами исследовались только пациенты СОАС, ранее не получавшие СРАР-терапию или терапию любых компонентов МС.
Несмотря на простой дизайн, отсутствие «ослепления», плацебо-контроля и рандомизации пациентов, нам удалось достичь минимального воздействия на конечный результат путем правильного формирования исследуемой и сравнительной групп.
В нашем исследовании у всех пациентов СОАС+МС, которым проводилась A-Flex-терапия в течение 6-ти месяцев, удалось «компенсировать» 3–4 компонента МС, что является достоверным положительным клиническим результатом. Однако чаще удается «нормализовать» максимум один, наиболее важный компонент МС. Так, в рандомизированном перекрестном исследовании пациентов СОАС+МС, выполненном S.R Coughlin [17], не было достигнуто достоверного уменьшения проявлений МС после 6 нед терапии, в то время как в контролируемом исследовании J. Durán-Cantolla [18] устранение проявлений МС и АГ было достигнуто уже к 6-му мес терапии.
Наши данные полностью согласуются с рядом исследований влияния СРАР-терапии на нормализацию АД у пациентов с СОАС [19, 20]. Механизм устранения АГ у пациентов с СОАС вероятнее всего связан с устранением фрагментации сна, ночной гипоксемии и результирующей симпатической активности [21]. Эта гипотеза подтверждается и в нашем исследовании, когда проведение A-Flex-терапии в течение 6-ти мес достоверно стабилизировало АД на целевых уровнях, устранило избыточную дневную сонливость и нормализовало индекс реактивной гиперемии (RHI). При проведении A-Flex-терапии в течение 6-ти мес нами отмечена тенденция к снижению уровней «биомаркеров» МС, таких как триглицериды, холестерин ЛПВП (HDL), холестерин ЛПНП (LDL), гомоцистеина и высокочувствительного С-реактивного белка. Наши данные полностью согласуются с данными контролируемых рандомизированных исследований последних лет [22, 23].
ЗАКЛЮЧЕНИЕ
Следует отметить, что только 6-месячная СРАР-терапия в режиме A-Flex в группе пациентов с СОАС среднетяжелого и тяжелого течения с выраженными проявлениями МС и его компонентов имеет достоверное терапевтическое действие по снижению цифр САД и ДАД, уровня липидов крови, гликированного гемоглобина, маркеров эндотелиальной дисфункции, способна уменьшить риски кардиоваскулярных событий. СРАР-терапия в режиме A-Flex приводит к улучшению контроля АГ и уменьшает метаболические нарушения пациентов с СОАС.



