ВВЕДЕНИЕ
Язвенный колит (ЯК) и болезнь Крона (БК) относятся к хроническим иммуновоспалительным заболеваниям кишечника неизвестной этиологии. Распространенность и заболеваемость воспалительными заболеваниями кишечника (ВЗК) отмечаются преимущественно среди пациентов молодого репродуктивного возраста. Согласно данным многочисленных эпидемиологических исследований, первый пик заболеваемости фиксируется в молодом возрасте между 20 и 30 годами жизни, второй – в 60–70 лет.
Вопрос о деторождении для пациенток, страдающих ВЗК, до настоящего времени решался неоднозначно. При этом отказ от рождения ребенка часто становится причиной психосоциальных и эмоциональных проблем для женщины. В современной медицине накоплено достаточно опыта, позволяющего предоставить больным ВЗК возможность нормального течения беременности и рождения здоровых детей. Тем не менее ведение таких пациенток в период беременности представляет собой сложную медицинскую, социальную и отчасти законодательную проблему.
Достигнутые успехи в изучении механизмов развития ВЗК дали возможность разработать программы патогенетической терапии и совершенствовать методы лечения. У беременных пациенток может использоваться почти весь спектр лекарственных средств, назначаемых для лечения этой группы заболеваний, – от препаратов 5-аминосалициловой кислоты и до генно-инженерных биологических препаратов (ГИБП).
ЭПИДЕМИОЛОГИЯ И ФАКТОРЫ РИСКА ГОСПИТАЛИЗАЦИИ БЕРЕМЕННЫХ ПАЦИЕНТОК С ВЗК
У большинства женщин с ВЗК беременность протекает нормально и заканчивается рождением здорового ребенка. Исследования показали, что примерно у 80% пациенток зачатие происходит в период ремиссии заболевания. В таких случаях ремиссия, как правило, сохраняется на протяжении всей беременности и в послеродовом периоде. Однако обострение заболевания представляет риск для нормального протекания беременности и иногда может привести к госпитализации пациентки. Кроме того, у небольшого числа женщин во время беременности может произойти манифестация ВЗК, что также требует госпитализации [1].
ОБОСТРЕНИЕ РАНЕЕ УСТАНОВЛЕННОГО ДИАГНОЗА ВЗК ВО ВРЕМЯ БЕРЕМЕННОСТИ
Среди женщин с ВЗК, которые зачали ребенка в период обострения, у 66% сохранялся активный воспалительный процесс или наблюдалась отрицательная динамика симптомов. Отрицательная динамика течения болезни отмечается у 45% пациенток с ЯК и у 33% пациенток с БК, зачавших ребенка в период обострения заболевания, что достоверно повышает риск госпитализации [2].
В проведенном de Lima-Karagiannis A. et al. (2016) исследовании 298 беременностей у 229 пациенток с ВЗК (157 – БК, 66 – ЯК и 6 – неклассифицированное ВЗК), в результате которых родилось 226 живых детей, признаки активного воспалительного процесса на момент зачатия тесно коррелировали с рецидивом заболевания во время беременности (скорректированное отношение шансов (ОШ) 7,66; 95% ДИ: 3,77–15,54) [3]. В этом исследовании также было установлено, что у беременных с ЯК рецидивы заболевания возникали чаще, чем у женщин с БК, независимо от возраста матери, статуса курения, активности заболевания до зачатия, предшествующих операций по поводу ВЗК и применения иммуносупрессивных препаратов или анти-ФНО-α препаратов (ОШ 3,71; 95% ДИ: 1,86–7,40).
Обострения ЯК в период беременности регистрируются не только у пациенток со среднетяжелой и тяжелой формой заболевания. В недавнем японском исследовании, включившем с 2013 по 2019 г. 68 женщин с ЯК, было зафиксировано 15 неблагоприятных исходов беременности у 13 пациенток [4]. Значимым независимым фактором риска, ассоциированным с рецидивом ЯК, была низкая приверженность к медикаментозному лечению, причем среди женщин, получавших монотерапию месалазином, обострение возникло из-за низкой комплаентности уже в I триместре (p = 0,002).
Степень активности ЯК признана одним из основных предикторов исхода у беременных пациенток, причем у больных с тотальным ЯК риск акушерских осложнений этого заболевания может быть выше, чем у пациенток с левосторонним поражением толстой кишки [5]. Пациентки с часто рецидивирующим ЯК также подвержены повышенному риску неблагоприятных исходов для плода. Крупное популяционное исследование, проведенное в США, показало, что беременность, сопряженная с ЯК, ассоциируется с увеличением частоты рождения детей, имеющих малый для своего гестационного возраста вес (ОШ 1,46, 95% ДИ: 1,14–1,88), спонтанными преждевременными родами (ОШ 1,32, 95% ДИ: 1,00–1,76) и преждевременным излитием околоплодных вод (ОШ 1,95, 95% ДИ: 1,26–3,02). При дальнейшей стратификации пациенток ЯК, но не БК, достоверно коррелировал с повышенной вероятностью ишемии плаценты, спонтанных преждевременных родов и преждевременным излитием околоплодных вод (ПИОВ) [6]. Недавнее исследование методом «случай – контроль» продемонстрировало, что у пациенток с ЯК в стадии ремиссии вероятность обострения заболевания во время беременности ниже, чем у тех, кто не имеет стойкой клинико-эндоскопической ремиссии на момент зачатия [7]. Следует отметить, что сама беременность не влияет ни на течение ЯК, ни на общую частоту его обострений во время гестации (по разным оценкам, от 14 до 34%) [8, 9]. При БК осложнения заболевания в период беременности встречаются реже, чем при ЯК [9].
МАНИФЕСТАЦИЯ ВЗК ВО ВРЕМЯ БЕРЕМЕННОСТИ
Манифестация ВЗК при беременности наблюдается редко. Доказательством этому могут служить результаты ряда клинических случаев и небольших исследований [7, 10–19]. Вместе с тем этот факт ассоциируется со значительными неблагоприятными исходами как беременности (включая самопроизвольное прерывание беременности, внутриутробную гибель плода, кесарево сечение, преждевременные роды, ретинопатию плода), так и ВЗК (токсический мегаколон). Однако можно предположить, что в настоящее время исходы беременности в этом случае более благоприятные в связи с улучшением терапии ВЗК и своевременной координацией работы мультидисциплинарной команды врачей.
По мнению Brunelli R. et al., профилактика осложнений ВЗК в период беременности может осуществляться проведением ранней сигмоскопии у пациенток с жалобами на кровянистую диарею для принятия своевременного решения о коррекции терапии, а также интенсивным наблюдением за плодом [19, 20]; кроме того, важно понимание того факта, что лихорадки при беременности может не быть [21] из-за повышенного уровня противовоспалительных факторов, продуцируемых плацентой, и нарушения восприятия головным мозгом температуры тела, индуцированной избыточной выработкой простагландинов [22]. Необходимость в операции чаще всего возникает при развитии ВЗК de novo. В недавнем систематическом обзоре 32 публикаций, включавшем 86 пациенток, которым потребовалось хирургическое вмешательство по поводу ВЗК во время беременности, 18% случаев были представлены именно ВЗК de novo [23].
ТЕЧЕНИЕ ВЗК И ОСЛОЖНЕНИЯ БЕРЕМЕННОСТИ
В многочисленных исследованиях показано, что женщины, находящиеся в ремиссии заболевания, должны продолжать противорецидивную терапию ВЗК во время беременности, но при этом все же существует риск развития других осложнений, связанных с гестацией, которые могут привести к госпитализации в стационар [24]. Женщины с ВЗК часто страдают от потери веса и дефицита питания, связанных как с токсикозом беременности, так и рвотой, вызванной ВЗК [25]. Необходимо тщательно следить за массой тела пациентки во время регулярных дородовых гинекологических и гастроэнтерологических визитов, и если есть опасения, что вес не набирается или уменьшается, то рекомендуется коррекция терапии, желательно с участием диетолога. Иногда потеря веса сама по себе может потребовать госпитализации, но более вероятно, что основной причиной направления в стационар может быть осложнение беременности, сопровождающееся сильной тошнотой, рвотой, потерей веса и, возможно, дегидратацией.
БК часто сопряжена с рождением ребенка с низкой массой тела и недоношенностью [26]. В метаанализе, выполненном Cornish J. et al., были выявлены увеличение в 1,87 раза частоты недоношенности (менее 37 нед. гестации) и вдвое превышающая норму частота низкой массы тела ребенка при рождении (менее 2500 г) по сравнению с контрольной группой [27].
Беременные женщины с целью купирования симптомов обострения ВЗК часто нуждаются в терапии глюкокортикоидами (ГК), также они более подвержены развитию гестационного диабета [28]. Это может послужить основанием для госпитализации или, наоборот, быть следствием недавней госпитализации в связи с обострением ВЗК. Поэтому осведомленность гастроэнтерологов об этом осложнении, особенно у пациенток, получающих высокодозную глюкокортикоидную терапию, очень важна.
Гестационный сахарный диабет связан со значительными краткосрочными и долгосрочными негативными последствиями для ребенка. В регистре PIANO применение ГК коррелировало с гестационным диабетом (ОШ 2,8, 95% ДИ: 1,3–6,0) [29]. Следует отметить, что в ретроспективном исследовании при использовании будесонида повышенный риск развития гестационного сахарного диабета не наблюдался, поэтому этот ГК можно использовать у женщин с легким обострением ВЗК [30]. Однако важно подчеркнуть, что неадекватный контроль за обострением заболевания может привести к таким серьезным осложнениям, как дистресс-синдром плода, преждевременные роды и самопроизвольное прерывание беременности. Поэтому при выборе оптимальной дозы ГК нужно руководствоваться клинической ситуацией и мнением акушера-гинеколога. Это зависит от тяжести заболевания, триместра беременности и сопутствующих заболеваний. Оптимальным при беременности является применение преднизолона в дозе менее 20 мг/сут., но в случае агрессивного течения ВЗК допустимо использование и более высоких доз этого препарата [31].
Следует также учитывать риск венозных тромбоэмболических осложнений (ВТЭ) у беременных. Женщины с ВЗК, особенно с ЯК, подвержены повышенному риску ВТЭ в период гестации [32]. Поэтому у всех госпитализированных женщин с ВЗК необходимо рассмотреть возможность профилактического применения низкомолекулярного гепарина.
Женщины с БК также подвержены повышенному риску дородовых кровотечений. В исследовании Broms G. et al. женщины с этим заболеванием характеризовались более высокой вероятностью возникновения предродового кровотечения (ОШ 1,66; 95% ДИ: 1,12–2,45) [32]. Согласно рекомендациям Американского общества гематологов (American Society of Hematology, ASH), у беременных с подозрением на тромбоэмболию ветвей легочной артерии вместо легочной КТ-ангиографии рекомендуется вентиляционно-перфузионная (В/К) сцинтиграфия легких (условная рекомендация, низкая степень достоверности доказательств эффективности) [33]. Как при установленном диагнозе, так и при ВЗК de novo обострение болезни повышает риск тромбоэмболических событий и экстренного кесарева сечения, что требует более интенсивной противовоспалительной терапии [34].
Таким образом, при стационарном ведении беременной пациентки требуется участие мультидисциплинарной команды, состоящей из акушеров, гастроэнтерологов, врача первичной медицинской помощи, диетологов и, если необходимо, хирурга-колопроктолога. Такой командный подход необходим для дородового наблюдения, родов и послеродового ухода.
Кроме того, лечащие врачи-гастроэнтерологи должны знать, что пациентки с ВЗК подвержены риску развития ишемической болезни сердца [35]. При ведении беременных пациенток может потребоваться участие кардиолога, поскольку гестация сама по себе является приобретенным фактором риска тромбоэмболических осложнений. Точная оценка активности заболевания у беременных пациенток с ВЗК представляет определенную сложность, поскольку общие симптомы беременности, такие как изменение стула, утомляемость, ректальные кровотечения по причине геморроя, зачастую схожи с симптомами, ассоциированными с усилением активности ВЗК. Как и при обследовании небеременных пациенток, врачи могут использовать различные инструменты для оценки активности заболевания у беременных, хотя следует помнить, что некоторые тесты, например определение концентрации маркеров воспаления (включая С-реактивный белок), порой повышаются в период гестации [36]. Эндоскопические процедуры могут выполняться при необходимости, но должны проводиться с особой осторожностью после 24-недельного срока беременности.
Фекальный кальпротектин служит надежным маркером активности ВЗК, поскольку беременность не влияет на его уровень [37–39]. В ряде исследований было показано, что уровень этого маркера при беременности достоверно коррелирует с активностью заболевания во всех триместрах беременности [37, 39]. При этом гемоглобин и альбумин не являются надежными маркерами активности ВЗК в период беременности, а эндоскопические индексы и индекс Харви – Брэдшоу не валидированы для беременных пациенток и могут быть сложны для интерпретации, так как этот параметр включает описание объемного образования в брюшной полости, которое трудно оценить во время гестации.
Эндоскопическое исследование безопасно во время беременности при наличии соответствующих показаний, например при обострении ВЗК. Для оценки активности ЯК сигмоскопию можно выполнять без седации. Седация должна проводиться с мониторингом состояния плода после I триместра. В общенациональном шведском популяционном когортном исследовании эндоскопическое исследование в период беременности было ассоциировано с повышением риска преждевременных родов (скорректированный относительный риск (ОР) 1,54; 95% ДИ: 1,36–1,75) или низкой массы тела у новорожденного (ОР 1,30; 95% ДИ: 1,07–1,57), но не врожденных пороков развития (ОР 1,00; 95% ДИ: 0,83–1,20) или мертворождения (ОР 1,45; 95% ДИ: 0,87–2,40) [40]. Авторы отметили, что этот риск был минимальным и обусловленным «наследственными факторами или активностью заболевания».
Некоторые исследователи высказывают обеспокоенность по поводу безопасности МРТ-облучения в I триместре беременности из-за воздействия на ткани радиочастотных полей. Применение гадолиния при беременности не рекомендуется из-за возможной его тератогенности в I триместре во время органогенеза. Кроме того, во II или III триместрах гадолиний может проникать через плаценту, поступать в амниотическую жидкость и затем рециркулировать в организме плода. Теоретически персистенция недиссоциированного гадолиния способна привести к развитию нефрогенного системного фиброза у ребенка. В крупном исследовании базы данных провинции Онтарио (Канада), предметом изучения которого стали 1 424 105 родов, общая частота проведения магнитно-резонансной томографии (МРТ) составила 3,97 на 1000 беременностей. При сравнении МРТ с гадолинием (n = 397) с отсутствием МРТ (n = 1 418 451) применение этого метода исследования в течение I триместра беременности не было связано с повышенным риском развития неблагоприятного события для плода или новорожденного. В то же время выполнение МРТ с гадолинием в любой триместр беременности было сопряжено с увеличением риска развития ревматологических, воспалительных и инфильтративных заболеваний кожи (скорректированная разница рисков 45,3 на 1000 человеко-лет; 95% ДИ: 11,3–86,8) мертворождения или неонатальной смерти (скорректированная разница рисков 47,5 на 1000 беременностей; 95% ДИ: 9,7–138,2) [41].
ЛЕКАРСТВЕННАЯ ТЕРАПИЯ ОСЛОЖНЕННЫХ ФОРМ ВЗК ВО ВРЕМЯ БЕРЕМЕННОСТИ
Исследований, которые описывают частоту развития случаев острого тяжелого ЯК у пациенток в период беременности, потребовавших госпитализации, очень мало. К основным медицинским показаниям для госпитализации с учетом тяжести состояния относят необходимость внутривенной ГК-терапии, начало биологической терапии, оптимизацию питания и коррекцию анемии, связанной с кровопотерей.
Исследование с дизайном «случай – контроль» с участием 18 госпитализированных беременных пациенток с обострениями ВЗК (11 – ЯК, 6 – БК, 1 – неопределенный колит) в двух крупных лечебных центрах с 1989 по 2001 г. показало, что большинство госпитализаций приходилось на начало II триместра (средний срок – 15,9 нед., диапазон 8–35) [42]. Как правило, пациенткам требовалось пребывание в стационаре более 7 дней (в среднем 10,4 дня, диапазон 3–31). Все пациентки с ВЗК получали гидрокортизон внутривенно (средняя доза 199 мг/сут.). В этом исследовании, проведенном до появления ГИБП, у 5 пациенток была выполнена индукция циклоспорином. В настоящее время больным с тяжелым обострением ВЗК во время беременности может потребоваться назначение ГИБП. Если пациентки уже принимают препараты этого класса, то, как уже говорилось выше, следует продолжать биологическую терапию. Кроме того, при наличии клинических показаний допустимо начать вторую линию биологической терапии во время беременности. Опубликованные Европейским агентством по лекарственным средствам (European Medicines Agency, EMA) данные о применении анти-ФНО-α препаратов в период беременности не продемонстрировали повышения риска появления пороков развития у новорожденного, однако введение инфликсимаба коррелировало с возрастанием риска вторичных неблагоприятных исходов беременности, таких как необходимость кесарева сечения, преждевременные роды, низкая масса для данного гестационного возраста и низкая масса тела при рождении [43], хотя эти результаты могут быть обусловлены высокой активностью ВЗК.
В большинстве исследований отмечается, что после лечения пациентки по поводу тяжелого обострения ВЗК во время беременности повышается угроза преждевременных родов и низкой массы тела новорожденного. Более вероятно, что эти неблагоприятные исходы в большей степени связаны с самим процессом заболевания, а не с проводимым лечением. В датском исследовании 219 женщин с ВЗК, получавших в III триместре беременности терапию анти-ФНО-α препаратами, не было выявлено повышенного риска низкой массы тела новорожденного или преждевременных родов, связанного с применением этих ГИБП [44].
Данные об исходах беременностей при применении ведолизумаба немногочисленны. Обзор беременностей, наступивших в ходе регистрационных исследований этого лекарственного средства, установил 27 незапланированных беременностей у участниц, при этом не было зафиксировано существенных проблем с безопасностью [45]. В недавнем исследовании CONCEIVE авторы, изучив 79 беременностей пациенток с ВЗК на терапии ведолизумабом, не обнаружили увеличенного риска самопроизвольного прерывания беременности, недоношенности новорожденных или низкой массы тела ребенка при рождении [46].
Сведения о применении устекинумаба при беременности у пациенток с ВЗК также ограниченны. Анализ данных ревматологической практики свидетельствует о том, что применение этого ингибитора интерлейкинов 12/23 не ассоциировано с повышенным риском самопроизвольного прерывания беременности или врожденных пороков развития плода [47]. Данные об исходах беременности у женщин с ВЗК, получавших устекинумаб, представлены единичными наблюдениями, в которых сообщалось как о рождении здоровых детей, так и самопроизвольном прерывании беременности [48, 49].
Довольно скудной является и информация о применении при беременности тофацитиниба. Есть сведения об 11 случаях его использования у женщин, которые забеременели, и о 14 случаях лечения этим препаратом мужчин, ставших отцами. Исходы включали рождение 15 здоровых младенцев в отсутствие неонатальной и фетальной смертности, врожденных пороков развития, а также два самопроизвольных прерывания беременности и два прерывания по медицинским показаниям [50].
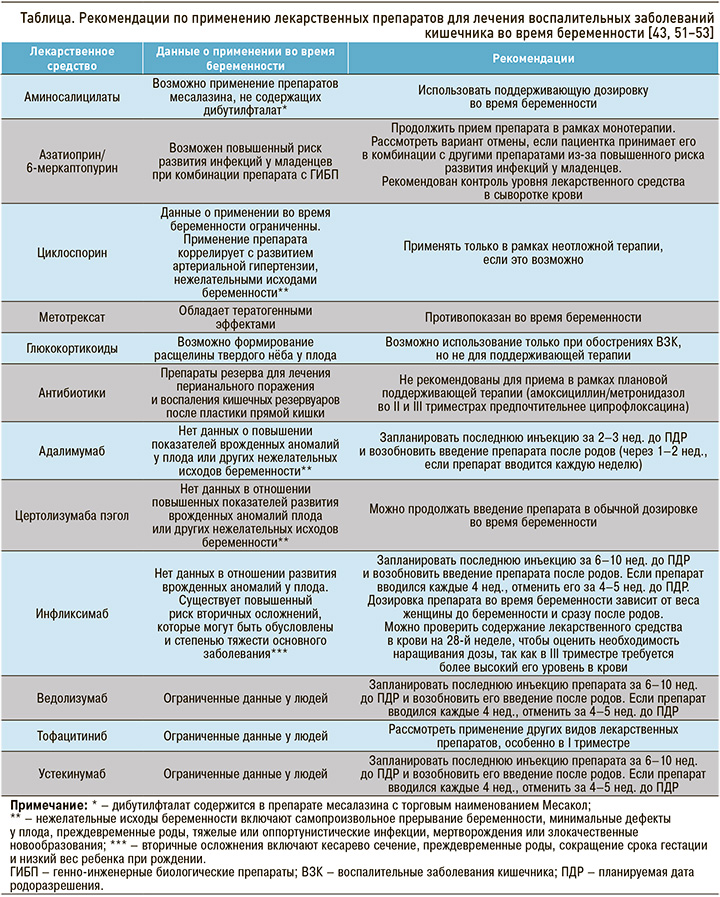
С учетом того что терапия ВЗК является обязательным условием ведения беременных женщин, необходима хорошая осведомленность врачей в отношении профиля безопасности применяемых лекарственных средств в период беременности (табл.) [43, 51–53].
ЗАКЛЮЧЕНИЕ
Несмотря на достижения в области медикаментозной терапии ВЗК, беременные пациентки по-прежнему имеют повышенный риск неблагоприятных исходов беременности, включая кесарево сечение, гестационный диабет, ПИОВ, преждевременные роды, мертворождение и низкую массу новорожденного для данного гестационного возраста. Однако многие неблагоприятные исходы, по-видимому, связаны с активностью ВЗК, а не с применением ГИБП или терапией тиопуринами, использование которых считается безопасным во время беременности. С целью выявления специфических для ВЗК предикторов осложнений беременности необходимы дополнительные крупные проспективные исследования. Валидированные прогностические модели, позволяющие стратифицировать отдельных пациенток с ВЗК по риску обострения ВЗК и неблагоприятного исхода беременности до зачатия, значительно облегчат пренатальное консультирование в этой популяции.
Чтобы свести к минимуму риск госпитализации при ВЗК, гастроэнтерологи обязательно должны консультировать пациенток, планирующих беременность: обсуждать с ними потенциальные риски обострения ВЗК в период беременности, объяснять необходимость систематического посещения врача и соблюдения установленного плана лечения, а также важность регулярного проведения не только акушерского, но и гастроэнтерологического мониторинга (обычно в каждом триместре).



