ВВЕДЕНИЕ
Медицинская статистика признает заболевания дыхательной системы наиболее распространенными в структуре заболеваемости в России, причем лидируют они и по числу связанных с ними случаев нетрудоспособности. Большую часть среди этих болезней занимают острые респираторные вирусные инфекции (ОРВИ) и бронхиты [1]. По данным Всемирной организации здравоохранения (2018), на грипп и ОРВИ приходится до 90–95% в структуре всей инфекционной заболеваемости в мировом масштабе [2]. В нашей стране данные заболевания ежегодно поражают более 30 млн человек, а еще примерно столько же больных переносят ОРВИ без обращения к врачу, не попадая, таким образом, в статистические базы. Финансовые потери, сопряженные с респираторными вирусными инфекциями, составляют порядка 60 млрд руб. в год (более 80% потерь от всех инфекционных заболеваний) [1, 3].
Ярким примером уязвимости систем здравоохранения перед этой группой заболеваний стала новая коронавирусная инфекция COVID-19, пандемия которой нанесла едва ли не всем странам колоссальный медицинский и экономический урон [4]. Она обострила сразу несколько ключевых проблем современной медицины:
- слабость существующих либеральных систем здравоохранения при развитии глобальных эпидемических процессов;
- роль оперативного информирования и санитарно-гигиенических мероприятий как в целом, так и на уровне первичного звена здравоохранения в ограничении распространения инфекционного агента;
- наличие относительно небольшого числа доказанных этиотропных противовирусных средств, подчеркнувшее необходимость ускорения разработок новых противовирусных средств и вакцин, а также значимость неотложной патогенетической терапии.
Эти проблемы были актуализированы и отчасти решены, что привело к снижению роли гриппа и сезонных ОРВИ на фоне ограничительных мероприятий 2020–2021 гг. Однако в 2022–2023 гг. заболеваемость гриппом и ОРВИ продемонстрировала рост, и в этот же период в общественной и медицинской прессе появился термин «тридемия», обобщающий одновременную циркуляцию и риск заражения различными штаммами гриппа, респираторно-синцитиального вируса и коронавируса SARS-CoV-2 [5].
Очевидно, что первичное амбулаторное звено, терапевты и врачи общей практики, находятся на переднем крае борьбы с респираторными вирусными инфекциями и в плане их диагностики, и в плане лечения [6]. Ведение пациентов с патологией дыхательной системы, в том числе вирусного происхождения (ОРВИ, грипп, COVID-19 и т. д.), предъявляет к терапевтам и врачам общей практики высокие требования в виде эпидемиологической настороженности, разносторонних знаний о нюансах течения инфекционных заболеваний (не только респираторных), быстрой и грамотной оценки состояния пациента, в том числе выявления симптомов тревоги («красных флагов»), требующих дополнительных обследований, консультаций, экстренной госпитализации и/или перевода в отделение реанимации, и, конечно, навыков междисциплинарного взаимодействия [6, 7].
Наконец, при заболеваниях дыхательной системы в плане лечебно-реабилитационных мероприятий важно понимание многофакторности этиопатогенеза, что объясняет широкую палитру подходов к ведению пациентов: она включает проведение этиотропной (антимикробной и противовирусной), патогенетической и симптоматической терапии, подразумевает важность учета коморбидной патологии, используемого лечения, возраста пациентов и др. [7–9].
В структуре ведущих жалоб и симптомов при патологии органов дыхания пальму первенства удерживает кашель как ключевой синдромом, отражающий уровень, масштаб поражения респираторного тракта и напряженность систем защиты [10, 11]. Являясь по сути своей защитным механизмом, кашель под воздействием инфекционного агента, ирритантов и т. п. быстро трансформируется в патологический: продукты воспаления повышают чувствительность кашлевых рецепторов на бронхах, приводят к расширению сосудов и отеку слизистой, явлениям бронхоспазма, гиперсекреции желез и т. п. [11]. Драматическим и практически неизбежным продолжением становится извращение процессов мукоцилиарного клиренса (МК), что вместе с изменением объема и вязкости мокроты утяжеляет выраженность кашля и состояние пациента [10–12]. Именно поэтому применение средств, которые посредством разнообразных механизмов действия (объединяемых понятием «мукоактивность») влияют на количество, качество и скорость выведения секрета, вязко-эластические свойства слизи дыхательных путей и активность ресничек мерцательного эпителия, представляется патогенетически обоснованным и хорошо обоснованным с точки зрения доказательной медицины [11–14].
МУКОАКТИВНЫЕ ПРЕПАРАТЫ
Мукоактивные препараты включают разнородную группу веществ, общим свойством которых признается влияние на свойства бронхиального секрета, скорость эвакуации слизи и активность мерцательного эпителия [12–15]. Признавая относительную условность четкого и однонаправленного фармакологического действия каждого конкретного лекарственного средства, фармакологические эффекты этой группы препаратов можно разделить на мукорегуляторные, муколитические, мукокинетические и отхаркивающие [16]. В ряду классификаций противокашлевых средств правомочным представляется разделение мукоактивных средств по преимущественному механизму влияния на активность желез, состав бронхиального секрета и МК (рис. 1) [17].
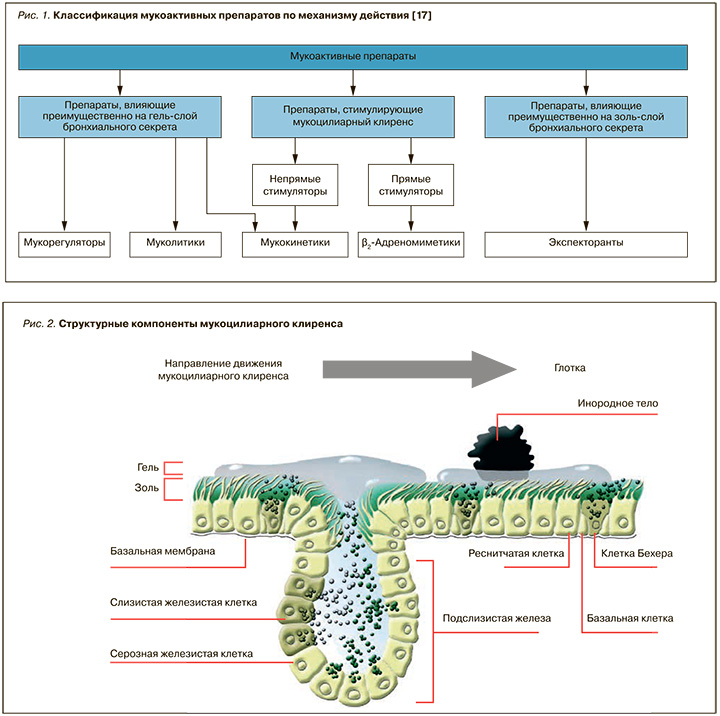
Ключевые эффекты этой группы веществ ориентированы на восстановление важнейшего защитного механизма – МК, обеспечивающего как барьерную, так и очистительную функцию респираторного тракта, местную защиту органов дыхания [11, 13, 14]. Важнейшими структурными составляющими МК признаются слой слизи на поверхности слизистой дыхательных путей и расположенные в нем реснички клеток мерцательного эпителия (рис. 2).
Непрерывное образование и движение секрета (слизи) способствуют нормальному функционированию бронхиального дерева и обеспечивают его непрерывное очищение. Секрет бронхов формируется активностью специализированных бронхиальных желез, бокаловидных клеток, а также клеток эпителия терминальных бронхиол и альвеол. Патофизиология различает две фракции бронхиального секрета – жидкую (золь) и гелеобразную, густую (гель), весьма непохожие по своим химико-физическим параметрам (см. рис. 2) [10, 18].
Гель бронхиальной слизи образован растворимыми сиаломуцинами (муцинами) бокаловидных клеток и трансмембранными муцинами эпителиальных клеток, которые за счет сцепления дисульфидными мостиками образуют фибриллярную структуру. Расположенный ниже более жидкий золь в основном содержит ионы, биологически активные вещества, пептиды, ферменты и их ингибиторы, покрывающие апикальные окончания мукоцилиарных клеток. Различия в составе определяют и функциональность слоев: задача геля состоит в захвате и удержании пыли, микроорганизмов, иных частиц, тогда как золь призван «смазывать» реснички, облегчая/ускоряя их движение [10, 18]. Исследования последних лет в части изучения тонких механизмов регуляции МК позволили понять причины нарушений этих функций при патологии, а также разработать новые или обосновать старые инструменты точечного воздействия на них [18, 19]. Как отмечено выше, все мукоактивные средства в той или степени влияют на МК, что и определяет их применение как при заболеваниях нижних дыхательных путей, так и лор-патологии.
Нарушение движения слизи может возникать под воздействием различных факторов; например, для респираторных вирусов эта способность является фактором инвазии. Так, Streptococcus pneumoniae, Haemophilus influenzae, Pseudomonas aeruginosa и многие респираторные вирусы нарушают работу мукоцилиарного транспорта за счет гибели эпителиальных клеток с разрушением клеточных мембран, что располагает к повреждению и десквамации эпителия и ухудшению санации бронхов, обеспечивая в то же время благоприятные условия для инвазии патогена [9, 14]. Неизбежно возникающие при этом воспалительные явления (бронхит) изменяют активность бронхиальных желез, нарушают соотношение и объем фракций бронхиальной слизи, ухудшая защитную и элиминационную функции МК (рис. 3) [9, 14].
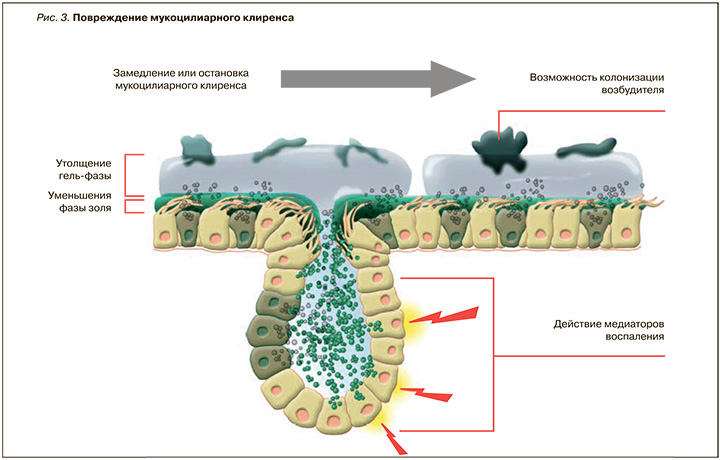
Соотношение отдельных фракций муцинов в норме и при различных заболеваниях называется муциновым интерфейсом [18]. Эти изменения носят как приспособительный характер (со стороны организма), так и повреждающий (вследствие воздействия патогенов). Модификация муцинового интерфейса при респираторной патологии требует понимания его причин и знания принципов применения мукоактивных средств с учетом патогенетических механизмов [19, 20].
Один из хорошо испытанных временем и обширной клинической практикой мукоактивных препаратов – карбоцистеин, обладающий достаточно широким спектром доказанных в исследованиях положительных эффектов на уровне бронхиального тракта, а также рядом дополнительных достоинств [15, 20].
КАРБОЦИСТЕИН: КЛЮЧЕВЫЕ СВОЙСТВА
В течение многих лет крупные и доказательные исследования продемонстрировали способность карбоцистеина восстанавливать вязкость и текучесть слизи за счет нормализации количественного соотношения кислых/нейтральных муцинов и фукомуцина бронхиального секрета, облегчающего ее отхождение [9, 13–15, 21, 22]. Препарат воздействует на патологическую активность бокаловидных клеток и уменьшает выработку секрета, разжижая его и тем самым улучшая реологические свойства слизи, что вкупе с активизацией деятельности реснитчатого эпителия дает интересный эффект: под слоем густой патологической слизи формируется прослойка слизи с нормальными свойствами, вследствие этого происходят «всплытие» и ускоренное движение дефектной слизи, реснички мерцательного эпителия в условиях секрета с нормальной вязкостью ускоряют свою активность, и в результате обеспечивается удаление патогенного содержимого [23]. Все это создает условия для возобновления нормальной деятельности МК. В последние годы наряду с мукорегуляторной активностью карбоцистеина показано и его мукокинетическое действие, выражающееся в увеличении частоты и амплитуды движений ресничек, что также улучшает МК [19, 24]. Также это лекарственное средство способствует регенерации слизистой оболочки, восстанавливая ее структуру [18, 19].
Дополнительные и отчасти неожиданные эффекты карбоцистеина, выявленные в ходе исследований, заключаются в стимуляции выработки иммунологически активного IgА (обеспечивающего специфическую защиту), нормализации показателей местного иммунитета (sIgA) и увеличении количества сульфгидрильных групп в слизи (неспецифическая защита) [9, 20].
Многолетние доклинические и клинические исследования позволили также установить наличие у карбоцистеина противовоспалительных и антиоксидантных свойств [22]. Например, на фоне его приема отмечено ингибирование продукции медиаторов воспаления (цитокины интерлейкинов 1β, 6, 8, фактора некроза опухоли-альфа), что подтверждает противовоспалительную активность препарата на разных уровнях респираторного дерева [25]. Любопытно, что карбоцистеин демонстрирует неспецифический противовоспалительный механизм (сходный с таковым у кортикостероидов и дезлоратадина): он блокирует передачу внутриклеточного активационного сигнала ядерного фактора NFκB, снижая экспрессию генов, ответственных за продукцию провоспалительных цитокинов [26].
Антиоксидантное действие карбоцистеина выявлено и в клинической практике. У пациентов с хронической обструктивной болезнью легких (ХОБЛ) оно выражалось в уменьшении выраженности перекисного окисления липидов (снижении концентрации продуктов липидной пероксидации), также в повышении активности ферментов антиоксидантной защиты [27]. Антиоксидантные и цитопротективные свойства данной молекулы проявляются в виде снижения продукции активных форм кислорода (ROS), активности гистондеацетилазы (2HDAC-2) [28].
Не менее неожиданным, но крайне важным при лечении респираторной инфекционной патологии оказалось ингибирующее действие карбоцистеина на адгезию, инвазию и размножение некоторых респираторных бактериальных и вирусных агентов:
- при его применении было обнаружено уменьшение адгезии вируса гриппа А за счет снижения плотности рецепторов, ответственных за взаимодействие с эпителием, а повышение рН эндосом, содержащих вирус, препятствовало выходу возбудителя в цитоплазму [29];
- in vitro показано, что препарат подавляет проникновение и размножение риновирусов [30];
- использование лекарственного средства предотвращало адгезию Streptococcus pneumonia на поверхности альвеолоцитов или уменьшало ее прочность за счет снижения числа рецепторов [31, 32];
- при заражении in vitro культуры эпителиальных клеток человеческой трахеи респираторно-синцитиальным вирусом карбоцистеин ингибировал размножение вируса, а при профилактическом использовании предотвращал проникновение вирионов, снижая экспрессию рецепторов [33].
Добавим, что карбоцистеин обладает синергическим действием при совместном использовании с кортикостероидами, а также способствует повышению эффективности антибактериальной терапии воспалительных заболеваний верхних и нижних дыхательных путей [19].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ФАКТОРЫ КОМПЛАЕНТНОСТИ
Экспериментальными и клиническими исследованиями доказано мукорегуляторное действие карбоцистеина на всем протяжении дыхательных путей. Показаниями для применения служат острые и хронические бронхолегочные заболевания (трахеит, бронхит, трахеобронхит, ХОБЛ, бронхоэктатическая болезнь, бронхиальная астма) и воспалительные заболевания лор-органов (ринит, аденоидит, синусит, средний отит), сопровождающиеся образованием вязкого, трудно отделяемого секрета.
В рандомизированных исследованиях, в том числе с использованием плацебо-контроля, продемонстрирована эффективность карбоцистеина при ринитах и ринофарингитах [34], риносинуситах [35]: описаны достоверная положительная динамика клинических проявлений и рентгенологической картины риносинусита, улучшение носового дыхания, сокращение времени назального дренажа, восстановление обоняния [34]. Похожие результаты получены в нескольких слепых плацебо-контролируемых исследованиях при катаральном отите: слух улучшался лишь у больных, получавших карбоцистеин, но не плацебо; на фоне его применения происходило быстрое уменьшение всех симптомов, связанных с застоем патологической слизи [35].
К улучшению результатов лечения приводило и добавление карбоцистеина к антибактериальной терапии [36–38]. Так, комбинирование этого мукоактивного препарата с кларитромицином повышало эффективность лечения хронического риносинусита: достоверная положительная динамика количественных и качественных характеристик назального отделяемого, постназального затекания слизи и показателей компьютерной томографии придаточных пазух носа наблюдалась у 64% пациентов, получавших сочетание антибиотика и карбоцистеина, и лишь у 45,6% больных, принимавших только кларитромицин (p = 0,001) [39].
Комбинация антибиотики + карбоцистеин при остром или хроническом гайморите в стадии обострения вызывала достоверное уменьшение субъективной (головная боль, аносмия, ринорея, назальная обструкция) и объективной симптоматики заболевания (болезненность при пальпации передней стенки верхнечелюстных пазух, наличие патологического отделяемого, отек и гиперемия слизистой оболочки), быструю бактериологическую санацию носового секрета и статистически достоверное улучшение функции мерцательного эпителия [40].
В детской практике эффективность карбоцистеина показана при инфекционном рините в сочетании с аллергическим персистирующим ринитом [41], инфекционных ринитах с хроническим аденоидитом [42], острых риносинуситах, острых ринофарингитах, острых экссудативных средних отитах [43].
Эффективность карбоцистеина у взрослых с ХОБЛ выражается в клиническом улучшении и уменьшении частоты обострений, повышении качества жизни пациентов, улучшении иммунологических показателей [21, 26, 44–47]. Согласно результатам анализа масштабного плацебо-контролируемого исследования PEACE (Preventive Effect on ACute Exacerbation), включавшего 709 больных ХОБЛ, в группе пациентов, применявших карбоцистеин, частота обострений была на 25% ниже по сравнению с группой плацебо [47].
На сегодняшний день нет прямых исследований, где сопоставлялись бы различные муколитические средства, но существуют обзоры и метаанализы, которые позволяют сделать выводы об их сравнительной эффективности и безопасности. Так, при острых инфекциях верхних и нижних дыхательных путей у детей без хронической бронхолегочной патологии установлена равная эффективность и безопасность ацетилцистеина и карбоцистеина [48]; отмечена бóльшая безопасность карбоцистеина по сравнению с ацетилцистеином, в том числе в эксперименте [49]; продемонстрированы снижение риска обострения ХОБЛ при использовании карбоцистеина, эрдостеина и N-ацетилцистеина в дозе 1200 мг/ сут. (но не 600 мг/ сут.) относительно плацебо и сравнимая безопасность 3 оценивавшихся муколитиков (7 рандомизированных контролируемых исследования, 2753 пациента с ХОБЛ) [50, 52]; позднее эти выводы были подытожены в консенсусном исследовании Delphi [52].
Большое значение при столь распространенной патологии, как респираторная, в самых различных возрастных группах имеет приверженность пациентов к назначениям врача, на которую ощутимо влияют осязаемая эффективность и удобство использования того или иного лекарственного препарата. С этой точки зрения важно отметить, что карбоцистеин выпускается в разнообразных лекарственных формах, ориентированных на индиивидуальные предпочтения пациентов: в капсулах, в гранулах (применяются предварительного растворения в воде), в сиропе и даже в растворе в индивидуальных герметичных саше (пакетиках).
Одним из наиболее изученных препаратов карбоцистеина является Флюдитек, представленный в различных формах и дозировках: для взрослых пациентов – сироп в дозе 50 мг/мл и раствор 750 мг / 10 мл в саше, для детей (с 2 лет) – сироп 20 мг/мл.
Инновационный препарат Флюдитек в форме раствора 750 мг / 10 мл в саше удобен благодаря индивидуально пакетированной форме. Кроме того, он востребован пациентами, у которых выявлены метаболические расстройства или сахарный диабет, сторонниками низкокалорийной диеты, поскольку в составе его вспомогательных веществ отсутствует сахар.
Долгий и позитивный опыт применения карбоцистеина позволил Российскому респираторному обществу, Национальной медицинской ассоциации оториноларингологов и Союзу педиатров России признать его эффективным средством для лечения заболеваний верхних и нижних дыхательных путей и включить в действующие современные рекомендации Минздрава России по лечению бронхита у детей, хронического бронхита у взрослых, а также ХОБЛ, острого синусита у детей и взрослых [53–55].
ЗАКЛЮЧЕНИЕ
Доказанная высокая клиническая эффективность карбоцистеина позволяет рекомендовать его к применению практически во всех возрастных категориях пациентов, начиная с детей старше 2 лет, при наличии трудно отделяемой вязкой мокроты, воспалительных заболеваний верхних и нижних дыхательных путей, возникших на фоне коронавирусной инфекции и других ОРВИ, а также при бронхитах.



