Запор (лат. constipatio – спрессованные, столпившиеся вместе) – это задержка опорожнения кишечника более чем на 48–72 ч, сопровождающаяся затруднением акта дефекации, чувством неполного опорожнения с отхождением малого количества (менее 100 г) и повышенной твердости (I или II типы по Бристольской шкале) кала [5, 8]. Некоторые авторы объективным критерием запора считают массу фекалий менее 35 г/сут [1].
В развитых странах частота запора в популяции составляет от 10 до 17–19% [2–4]. Это связывают с изменением характера питания за последние 100 лет и употреблением рафинированной легкоусвояемой пищи, снижением количества потребляемых пищевых волокон в рационе современного человека, высокими темпами индустриализации и снижением физической активности. Проблема запора существует столько же, сколько и человечество. Применение в качестве слабительных средств сульфата магнезии, касторового масла, алоэ, сенны упоминается в египетских папирусах и документах древней Греции, в т.ч. и в афоризмах Гиппократа. Немецкий химик Иоганн Глаубер (Johann Rudolph Glauber, 1604–1670) навсегда оставил свое имя в науке, предложив использование сульфата натрия как эффективного слабительного. В 1972 г. Дэнис Буркитт и группа исследователей дали старт многолетнему эпидемиологическому исследованию роли пищевых волокон для профилактики запора.
Проблема запора усугубляется с возрастом, и среди людей старше 60 лет запор встречается у 50–60% [5]. Наличие запора у лиц старших возрастных групп с полиморбидностью отягощает течение не только сопутствующей патологии желудочно-кишечного тракта (ЖКТ), но и других органов и систем. По данным О.Б. Яновой и соавт., запор является одним из трех основных факторов, повышающих риск развития рефлюкс-эзофагита (95% ДИ 1,05–2,6; ОР=1,65; р=0,02). Устранение запора у пациентов с гастроэзофагеальной рефлюксной болезнью приводит к снижению кратности приема ингибиторов протонной помпы (в режиме «по требованию») у 23,1 против 2,5% больных с сохраняющимся запором (р<0,05) [6]. Тяжелые запоры увеличивают риск кардиоваскулярных событий у пожилых женщин в постменопаузе на 23% (95% ДИ 1,08–1,53; ОР=1,28;), а умеренные – в 1,13 раз (95% ДИ 1,03–1,24) [7].
Другой проблемой у пожилых больных с полиморбидностью является вынужденная полипрагмазия. Многие группы препаратов являются причиной нарушения моторики кишечника. Из наиболее широко используемых препаратов примерами могут служить антипаркинсонические (антихолинергические, допаминергические) средства, антациды, содержащие гидроксид алюминия или карбонат кальция, М-холинолитики, трициклические антидепрессанты, аналгетики (кодеин, морфин и его производные), противокашлевые лекарственные препараты, в состав которых входит кодеин и его производные, диуретики (торасемид, салуретики), некоторые представители гипотензивных средств (ингибиторы ангиотензинпревращающего фермента, верапамил, клонидин), антибиотики (цефалоспорины и др.), препараты двух- и трехвалентного железа. При невозможности отмены лекарственного препарата, являющегося причиной запора, дальнейшее лечение больного соответствует алгоритму ведения больных с хроническим функциональным запором (ХФЗ).
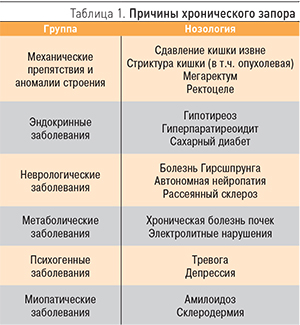 Уже при опросе больного можно установить, является ли запор симптомом органического поражения ЖКТ, экстрагастроинтестинальной патологии, или запор относится к первичным заболеваниям, когда морфологические изменения толстой кишки не обнаружены [8]. Заболевания, которые могут быть причиной запора, представлены в табл. 1.
Уже при опросе больного можно установить, является ли запор симптомом органического поражения ЖКТ, экстрагастроинтестинальной патологии, или запор относится к первичным заболеваниям, когда морфологические изменения толстой кишки не обнаружены [8]. Заболевания, которые могут быть причиной запора, представлены в табл. 1.
При сборе анамнеза необходимо установить давность возникновения жалоб, выяснить характер стула в детстве, попытаться проследить возможную связь запора с изменениями в пищевых пристрастиях (например, в связи с переменой места жительства). Короткий анамнез с быстро меняющейся клинической картиной и наличие «флажков тревоги», таких как начало заболевания после 50 лет, похудание без видимой причины, эпизоды повышения температуры, отягощенный по наличию злокачественных опухолей семейный анамнез, кишечное кровотечение или положительный анализ кала на скрытую кровь, анемия, лейкоцитоз, ускорение СОЭ, являются показанием к углубленному обследованию ЖКТ, прежде всего к эзофагогастродуоденоскопии и колоноскопии. Поскольку риск колоректального рака увеличивается после 50 лет, у этой категории больных также требуется детальное обследование кишечника.
К первичным хроническим запорам относят:
- функциональный запор;
- синдром раздраженного кишечника с преобладанием запоров.
В дополнение к приведенной классификации А.И. Парфенов предлагает выделять запор вследствие нарушения координации мышечного аппарата, обеспечивающего дефекацию (диссинергическая дефекация), на долю которой приходится до 25% от общего числа функциональных запоров [8].
Критерии диагноза ХФЗ, имеющего шифр МКБ-10 – К59.0, сформулированы в Римских критериях (Rome III) функциональных расстройств ЖКТ в 2006 г. [9, 10]. Необходимо наличие хотя бы 2 из следующих критериев, присутствующих в течение не менее 3 мес с дебютом за 6 мес до постановки диагноза:
- натуживание в течение по крайней мере 25% дефекации;
- шероховатый или твердый стул по крайней мере в 25% дефекаций;
- ощущение неполной эвакуации по крайней мере в 25% дефекаций;
- ощущение аноректальной обструкции/блокады по крайней мере для 25% дефекаций;
- необходимость мануальных приемов для облегчения по крайней мере в 25% дефекаций (например, пальцевая эвакуация, поддержка тазового дна);
- меньше 3 дефекаций в нед;
- невозможность самостоятельного стула без использования слабительных средств;
- недостаточность критериев для синдрома раздраженного кишечника.
Основным критерием диагноза синдрома раздраженного кишечника (К58), принципиально отличающим его от ХФЗ, является абдоминальная боль или абдоминальный дискомфорт, ассоциированный с дефекацией и/или изменением частоты и/или формы стула.
Наиболее часто слабительные средства классифицируются по механизму действия [22]:
- вызывающие химическое раздражение рецепторов: антрахиноны (производные сены, крушины), дифенолы (бисакодил, пикосульфат натрия), касторовое масло;
- обладающие осмотическими свойствами: солевые (магния сульфат), слабоабсорбируемые ди- и олигосахара (лактулоза), многоатомные спирты (сорбитол), полиэтиленгликоль;
- увеличивающие объем содержимого кишечника: балластные вещества (метилцеллюлоза, отруби, семя льна и др.);
- способствующие размягчению кала и улучшающие его скольжение (жидкий парафин, вазелиновое масло).
При изучении рынка терапии запора, проведенном в России в 2011 г. компаниями IPSOS и «Бизнес-Аналитика», было выявлено, что 67% лиц, страдающих запором, лечатся самостоятельно, по рекомендациям «интернета», соседей и научно-популярных публикаций, 13% обращаются за советом к провизору, 11% не лечатся совсем и только 13% обращаются за помощью к врачу. На момент обращения к врачу 70% больных уже перепробовали перед этим различные способы терапии [11]. При этом уровень неудовлетворенности эффектами слабительных препаратов в нашей стране, как и в других странах составляет около 47% [3]. Проблема обусловлена отсутствием комплексного подхода к лечению запора, непониманием больного необходимости регулярного соблюдения подобранного режима и желанием получить незамедлительный эффект.
В любом случае лечение запора должно начинаться с рекомендаций по изменению образа жизни. Это, в частности, предполагает увеличение в рационе больного количества пищевых волокон: рекомендуемая норма 25–32 г/ сут, что соответствует приблизительно 400–450 г овощей и фруктов [20, 21]. Для предотвращения избыточного газообразования в кишечнике и снижения комплаенса нужно акцентировать внимание пациента на постепенном увеличении ежедневного приема овощей и фруктов (в течение нескольких недель). Способствует снижению газообразования тепловая обработка, прием достаточного количества жидкости (в среднем не менее 1,5 л/сут).
Еще одним необходимым условием является достаточная физическая активность: во многих руководствах она определяется как ежедневная 30-минутная ходьба быстрым темпом [23]. Значимым фактором является формирование привычки к ежедневному опорожнению кишки в одно и то же время, физиологичнее в утренние часы, после завтрака, что запускает гастро-илеальный симптом Поргеса (быстрое перемещение содержимого подвздошной кишки в слепую при раздражении слизистой оболочки желудка пищей) в привычных для больного условиях.
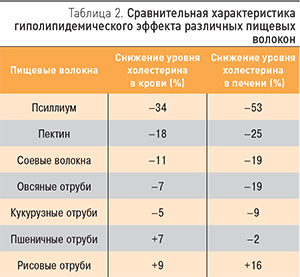
Уже на этапе диетических рекомендаций больному можно назначить отруби или псиллиум, который является одним из лекарственных препаратов пищевых волокон на отечественном рынке. Количество отрубей увеличивается с 1–2 чайных ложек до 6–8 столовых в течение 2–4 нед [12]. Кроме того, отруби и псиллиум могут служить примером применения принципа многоцелевой монотерапии, т.е. возможности использовать системные эффекты одного лекарства для одновременной коррекции нарушенных функций нескольких органов или систем [24]. Большинство пищевых волокон способствуют снижению общего холестерина в сыворотке крови, максимально этот эффект выражен у псиллиума [13, 14] (табл. 2).
 Подтверждение гиполипидемического действия псиллиума мы получили и в нашей работе [15]. Псиллиум способствует снижению массы тела и является пребиотиком, обеспечивающим рост собственной микробиоты макроорганизма. В результате микробного метаболизма образуются короткоцепочечные жирные кислоты, являющиеся основным энергетическим субстратом для однослойного цилиндрического эпителия толстой кишки. [16] Среднее количество псиллиума для достижения слабительного эффекта 2–3 пакетика в день (обязательное условие эффективности – достаточное количество употребленной жидкости).
Подтверждение гиполипидемического действия псиллиума мы получили и в нашей работе [15]. Псиллиум способствует снижению массы тела и является пребиотиком, обеспечивающим рост собственной микробиоты макроорганизма. В результате микробного метаболизма образуются короткоцепочечные жирные кислоты, являющиеся основным энергетическим субстратом для однослойного цилиндрического эпителия толстой кишки. [16] Среднее количество псиллиума для достижения слабительного эффекта 2–3 пакетика в день (обязательное условие эффективности – достаточное количество употребленной жидкости).
Балластные вещества: метилцеллюлоза, отруби, семя льна, псиллиум и др., увеличивающие объем содержимого кишечника, по возможности должны быть назначены каждому больному с ХФЗ в качестве базисной терапии, поскольку сочетание этих веществ с другими группами слабительных препаратов обладает синергизмом действия и позволяет повысить эффективность терапии запоров.
При выборе препарата для лечения запора необходимо точно понимать цель назначения и предполагаемую длительность лечения, например, препараты раздражающего действия, которые коротким курсом (не более 7 дней) эффективны для лечения «запора путешественника», не могут быть рекомендованы в качестве монотерапии для нормализации стула у больных с ХФЗ, т.к. при длительном приеме быстро развивается привыкание. Подход к лечению запора должен носить комплексный характер, назначение нескольких слабительных средств и соблюдение режима питания позволяют достичь более высокой эффективности, чем при монотерапии. В качестве иллюстрации приводим клинический пример.
Клинический пример
Больная К., 78 лет, поступила с жалобами на упорные запоры в течение последних 16 лет, чувство неполного опорожнения кишки после дефекации, вздутие живота, периодически боли по всему животу спастического характера. Стул 1 раз в 5–7 дней после приема 40–60 капель пикосульфата натрия и очистительной клизмы. Ежедневный прием 6–8 таблеток сенны – без эффекта. При дополнительном опросе с использованием опросника анализа частоты потребления пищи [26] выяснили, что среднее ежедневное количество клетчатки в рационе больной (без учета картофеля) составляет 6,4 г/сут (около 20% от суточной нормы). При осмотре больная пониженного питания (индекс массы тела 17,9 м/кг2), пальпация живота безболезненная, пальпируется выполненная каловыми массами сигмовидная кишка. Per rectum – без особенностей. При лабораторно-инструментальном обследовании: гиперхолестеринемия 7,3 ммоль/л, при проведении ректороманоскопии выявлены единичные спавшиеся внутренние геморроидальные узлы, колоноскопия – до купола слепой кишки – органических изменений не выявлено, ирригоскопия (для исключения мегадолихоколон) – органических изменений не выявлено, гипомоторная дискинезия ободочной кишки.
С больной была проведена беседа о необходимости увеличения в рационе количества сезонных овощей и фруктов с предварительной тепловой обработкой, включения в диету супов. Определено количество жидкости в день (не менее 1100 мл). Рекомендован прием отрубей (начиная с 1 чайной ложки с постепенным увеличением до 5–6 чайных ложек в день в течение 2–3 нед). Назначен псиллиум 1 саше в день с постепенным увеличением до 3 саше в течение 3 нед. Одобрен прием пикосульфата натрия 1 раз в 5 дней по 30 капель. При повторном осмотре через 4 нед жалоб на вздутие живота и/или абдоминальный болевой синдром нет. Стул 1 раз в 2–3 дня, мягкой консистенции. Чувства неполного опорожнения кишки нет. Необходимость в очистительных клизмах отпала. Таким образом, соблюдение пищевого рациона, питьевого режима и многокомпонентная терапия позволили достичь высокой эффективности у пациентки с хроническим запором.
Осмотические слабительные: полиэтиленгликоль, многоатомные спирты (сорбитол), солевые лекарственные средства (магния сульфат) действуют только в просвете кишечника, не оказывая системных побочных эффектов. Они высоко эффективны и могут быть назначены на сроки от нескольких недель до нескольких месяцев, т.к. за счет связывания воды в просвете кишки они увеличивают объем кишечного содержимого и тем самым стимулируют перистальтику. Слабоабсорбируемые ди- и олигосахара (лактулоза) обладают пребиотическими свойствами и за счет роста сахаролитических бактерий в кишке изменяют внутрипросветный рН, повышая осмотическое давление в просвете кишки. Это вызывает увеличение объема содержимого кишечника и стимулирование пропульсивной моторики кишечника. Общим недостатком этих препаратов является частая жалоба на вздутие живота, урчание. Нежелательные побочные эффекты преодолевают индивидуальным подбором дозы с постепенным ее увеличением.
Вазелиновое масло (Oleum vaselini seu Parafinum liquidum, «жидкий парафин») представляет собой очищенную фракцию нефти, способствующую размягчению каловых масс, облегчению их скольжения по кишке и оказывающую слабое стимулирующее воздействие на моторику кишечника. Вазелиновое масло применяется внутрь 1 раз/сут, по 1–2 столовых ложки через 2 ч после приема пищи. Продолжительность терапии – не более 5 дней, т.к. длительное применение вазелинового масла может вызвать нарушение всасывания жирорастворимых витаминов A, E, K, а также атонию кишечника. У больных пожилого и старческого возраста при приеме вазелинового масла внутрь увеличивается риск неудержания и недержания кала из-за раздражения слизистой оболочки прямой кишки и анального канала.
При неэффективности всех ранее перечисленных слабительных средств в качестве моно- или комбинированной терапии препаратом выбора становится полный агонист серотонинергических рецепторов 4 типа (5-HT4) прукалоприд, который оказывает выраженный слабительный эффект у 73% больных в дозе 2 мг [17]. Механизм действия этого препарата заключается в активации 5-НТ4-рецепторов, расположенных в гладкой мускулатуре и нейронах нервно-мышечного сплетения в стенке кишки. Активация этих рецепторов увеличивает перистальтику путем стимулирования вторичных мессенджеров (ацетилхолин и кальцитонин), сокращения проксимальных гладких мышечных волокон и расслабления периферических гладких мышечных волокон. Фармакокинетика прукалоприда линейно зависит от дозы в широком диапазоне до 20 мг/сут. При продолжительном приеме препарата 1 раз/ сут в дозе 2 мг длительность приема не влияет на его фармакокинетику, т.е. привыкание не развивается. В отличие от своего предшественника тегазерода, прукалоприд в терапевтических дозах не оказывает побочных эффектов на сердечно-сосудистую систему в виде развития жизнеугрожающих аритмий.
С точки зрения принципа многоцелевой монотерапии для стимуляции работы толстой кишки можно рекомендовать прием препаратов, не относящихся к группе слабительных. Таким препаратом является блокатор опиоидных рецепторов тримебутин, который снижает длительность толстокишечного транзита с 105±19 до 60±11 ч против плацебо (с 103±17 до 95±10 ч), р<0,001, повышая электрофизиологическую активность кишечника у пациентов с хроническими идиопатическими запорами при дозировке по 100–200 мг 3 раза/сут [18].
Доказательств, подтверждающих эффективность использования невсасывающихся антибиотиков и пробиотиков для лечения запора, недостаточно. В единичных исследованиях показано, что Bifidobacterium animalis могут ускорять толстокишечный транзит как у здоровых людей, так и у пациентов с синдромом раздраженного кишечника, а Lactobacillus casei и Bifidobacterium lactis DN-173010 эффективны при хронических запорах [5, 19].
Подводя итог вышеизложенному, полагаем, что высокая эффективность лечения запоров обеспечивается соблюдением нескольких положений:
- раннее установление органической причины запоров, особенно у лиц старше 50 лет;
- необходимость комплексного подхода к лечению запора с обязательным разъяснением больному строгого регулярного соблюдения подобранного режима для получения длительного эффекта;
- назначение каждому больному с ХФЗ в качестве базисной терапии балластных веществ: метилцеллюлозы, отрубей, семян льна, псиллиума и др., увеличивающих объем содержимого кишечника, поскольку сочетание этих веществ с другими группами слабительных препаратов обладает синергизмом действия и позволяет повысить эффективность терапии запоров;
- соблюдение больным питьевого режима;
- длительный подбор слабительных препаратов с постепенным повышением дозировки у больных с упорным хроническим запором;
- применение принципа многоцелевой терапии (в т.ч. использование групп слабительных препаратов с пребиотическим действием).



