«Синдром обильной мочи» был известен с глубокой древности и объединял как сахарный, так и несахарный диабет. Впервые по вкусу мочи разделил диабет на сахарный (diabetes mellitus) и несахарный, безвкусный (diabetes insipidus) Томас Уиллис в 1674 г. В 1953–1954 гг. Винсент де Виньо установил структуру антидиуретического гормона (АДГ, вазопрессина), за что ему была присуждена Нобелевская премия, а в 1956 г. был осуществлен синтез вазопрессина и окситоцина.
Несахарный диабет (НСД) является относительно редким эндокринным заболеванием, его распространенность в популяции не превышает 0,004–0,01%. Вновь выявленные случаи составляют примерно 1:1000000 населения в год. В России число больных НСД достигает примерно 21,5 тыс. человек [1, 2].
НСД обусловлен поражением гипоталамо-гипофизарной области со снижением секреции АДГ или нечувствительностью к нему почечных канальцев и характеризуется полидипсией и полиурией с низкой плотностью мочи (1001–1005 г/л). Физиологическая роль АДГ заключается в регуляции водно-электролитного баланса организма, задержке воды, поддержании осмолярности жидких сред организма, объема крови и артериального давления (АД). Кроме того, он участвует в секреции кортикотропин-релизинг-гормона, механизмах памяти и реакции на стресс. Снижение секреции АДГ проявляется в виде клинического синдрома НСД.
 По химической структуре АДГ представляет собой нанопептид с молекулярной массой 1080 дальтон, содержит 9 аминокислот и состоит из шестичленного кольца, замкнутого дисульфидным мостиком, и трехчленной концевой части, в которой находится аргинин, поэтому химическое название АДГ человека – аргинин-вазопрессин. Вазопрессин является гормоном головного мозга и синтезируется в нейросекреторных ядрах переднего гипоталамуса – супраоптическом и паравентрикулярном. В составе нейросекреторных гранул АДГ продвигается по аксону в заднюю долю гипофиза со скоростью примерно 3 мм/ч. Секреция АДГ происходит в ответ на сгущение крови и изменение АД при перемене положения тела, при этом гланулы разделяются на АДГ и нейрофизин-II. При повреждении ножки гипофиза (травма, опухоль, кровоизлияние, операция, роды) нарушается секреция АДГ. Нейросекреторные гранулы начинают накапливаться выше места повреждения, и со временем здесь может произойти перестройка сосудов, восстановление секреции гормона в кровь и спонтанное излечение от НСД.
По химической структуре АДГ представляет собой нанопептид с молекулярной массой 1080 дальтон, содержит 9 аминокислот и состоит из шестичленного кольца, замкнутого дисульфидным мостиком, и трехчленной концевой части, в которой находится аргинин, поэтому химическое название АДГ человека – аргинин-вазопрессин. Вазопрессин является гормоном головного мозга и синтезируется в нейросекреторных ядрах переднего гипоталамуса – супраоптическом и паравентрикулярном. В составе нейросекреторных гранул АДГ продвигается по аксону в заднюю долю гипофиза со скоростью примерно 3 мм/ч. Секреция АДГ происходит в ответ на сгущение крови и изменение АД при перемене положения тела, при этом гланулы разделяются на АДГ и нейрофизин-II. При повреждении ножки гипофиза (травма, опухоль, кровоизлияние, операция, роды) нарушается секреция АДГ. Нейросекреторные гранулы начинают накапливаться выше места повреждения, и со временем здесь может произойти перестройка сосудов, восстановление секреции гормона в кровь и спонтанное излечение от НСД.
Основным механизмом регуляции секреции АДГ является изменение осмолярности (вязкости) плазмы крови. У каждого человека имеется свой индивидуальный осмотический порог, при котором начинается секреция АДГ. Он стабильный на протяжении жизни и контролируется с исключительной точностью. Например, он может быть равен 287,3 мОсм/кг [2]. Для физиологической стимуляции секреции АДГ важное значение имеют объем плазмы, концентрация ионов натрия в плазме и спинномозговой жидкости и уровень АД. Уменьшение объема крови, повышение концентрации ионов натрия или снижение АД стимулируют секрецию АДГ, тогда как увеличение объема плазмы, снижение концентрации ионов натрия и повышение АД тормозят освобождение гормона. Такие физиологические стимулы, как боль, стресс, сон, физическая нагрузка, повышение температуры окружающей среды, никотин стимулируют секрецию АДГ и уменьшают диурез, тогда как воздействие холода, алкоголь, избыточное потребление воды снижают секрецию АДГ и увеличивают диурез.
МЕХАНИЗМ ДЕЙСТВИЯ АНТИДИУРЕТИЧЕСКОГО ГОРМОНА
В основе механизма действия АДГ лежит стимуляция обратного всасывания воды в дистальных канальцах и собирательных трубочках почечного нефрона. Первичная моча имеет осмолярность, аналогичную плазме. Конечная концентрация мочи зависит от наличия или отсутствия АДГ. В присутствии гормона увеличивается обратное всасывание воды, и моча выделяется концентрированной. При дефиците АДГ выделяется много разбавленной мочи. При нормальной секреции АДГ осмолярность мочи всегда выше 300 мОсм/ кг и может увеличиваться до 1200 мОсм/кг и более, при его дефиците – осмолярность мочи обычно ниже 200 мОсм/ кг. При полном отсутствии секреции АДГ и удельной плотности мочи 1001 г/л осмолярность мочи составляет 33,3 мОсм/кг. Для определения осмолярности мочи необходимо две последние цифры удельной плотности мочи умножить на коэффициент, равный 33,3 [3].

Действие АДГ на клеточном уровне реализуется через осмо- и барорецепторы, причем каждая из этих систем действует самостоятельно. Осморегуляция осуществляется в очень узких пределах. Изменение осмолярности плазмы всего на 1% вызывает корригирующую секрецию АДГ, тогда как в отношении объема крови секреция АДГ возникает при уменьшении объема крови на 7–15%, однако при быстром уменьшении объема крови (например, при кровопотере) объемная реакция преобладает над осмолярной. АДГ участвует в поддержании АД при изменении положения тела, сокращая сосуды при вставании и не давая развиться ортостатическому коллапсу.
Механизм внутриклеточного действия АДГ заключается в активации комплекса кальций–кальмодулин, увеличении синтеза циклического аденозин-монофосфата в присутствии ионов кальция и магния, а также активации синтеза простагландинов (PgE-2), которые, в свою очередь, инактивируют действие АДГ. Период полужизни АДГ составляет в среднем около 7,3 мин (1,1–24,1 мин) как у здоровых лиц, так и у больных НСД. Инактивация АДГ происходит в основном в печени (50%) и в почках (40%). Около 10% АДГ выводится с мочой в неизмененном виде.
На уровне клеток почек, печени, центральной нервной системы (ЦНС), сосудов действие АДГ опосредуется через несколько видов рецепторов [4]. В клетках почечных канальцев АДГ действует через V2-барорецепторы, сохраняет воду, стимулируя ее реабсорбцию в почках. В печени АДГ действует через V1-барорецепторы, приводя к распаду гликогена и активации процессов глюконеогенеза. В ЦНС АДГ через V1-баро- и осморецепторы оказывает действие на гипоталамические структуры, влияя непосредственно на кору мозга и поведенческие реакции. Он участвует в консолидации памяти и мобилизации хранимой информации (т.е. помогает запомнить и своевременно вспомнить необходимую информацию). Через V3-барорецептор АДГ стимулирует секрецию адренокортикотропного гормона в кортикотрофах аденогипофиза. На сосуды АДГ действует через V1-баро- и осморецепторы, вызывая сокращение гладкомышечного слоя и препятствуя падению давления при кровопотере и изменении положения тела. Кроме того, V1-барорецепроры мобилизуют внутриклеточный запас кальция, стимулируют агрегацию тромбоцитов.
КЛАССИФИКАЦИЯ НЕСАХАРНОГО ДИАБЕТА
Классификация НСД включает две основные формы: центральный (гипоталамический, нейрогенный вазопрессин-чувствительный) и нефрогенный (вазопрессин-резистентный). Кроме того, выделяют психогенную полидипсию, или дипсогенный диабет [4, 5].
 Причины развития центрального НСД весьма разнообразны. В 4–10% случаев он может развиться после острых и хронических инфекций. Важная роль в развитии гипоталамического НСД принадлежит черепно-мозговой травме (сотрясение мозга, перелом основания черепа) и хирургическим вмешательствам на гипофизе и гипоталамусе. Посттравматический НСД встречается в 15–20% случаев. Симптоматический центральный НСД может быть связан с развитием опухолей головного мозга, гипоталамуса или гипофиза, таких как краниофарингеома, менингеома, глиома, тератома, аденома гипофиза, а также метастазы бронхиогенного рака легких, рака молочной, щитовидной железы и др. Первичные опухоли мозга составляют 24–29% случаев НСД, метастазы – до 2–4%.
Причины развития центрального НСД весьма разнообразны. В 4–10% случаев он может развиться после острых и хронических инфекций. Важная роль в развитии гипоталамического НСД принадлежит черепно-мозговой травме (сотрясение мозга, перелом основания черепа) и хирургическим вмешательствам на гипофизе и гипоталамусе. Посттравматический НСД встречается в 15–20% случаев. Симптоматический центральный НСД может быть связан с развитием опухолей головного мозга, гипоталамуса или гипофиза, таких как краниофарингеома, менингеома, глиома, тератома, аденома гипофиза, а также метастазы бронхиогенного рака легких, рака молочной, щитовидной железы и др. Первичные опухоли мозга составляют 24–29% случаев НСД, метастазы – до 2–4%.
НСД может развиться при пролиферативных и эндокринных заболеваниях, врожденных синдромах, при сосудистых нарушениях. При идиопатическом НСД часто причину установить не удается. При аутоиммунном НСД в крови обнаруживаются антитела к АДГ, а в головном мозге лимфоидная инфильтрация и разрушение ядер гипоталамуса, что наблюдается более чем у половины больных с идиопатической формой НСД и может сочетаться с другими аутоиммунными заболеваниями. Учитывая парность ядер гипоталамуса, поражение их может быть полным или частичным, в связи с чем клиническая картина НСД может проявиться в разной степени – от легких форм до тяжелой болезни. Чаще всего заболевание манифестирует лишь тогда, когда разрушены более 90% нейросекреторных клеток ядер гипоталамуса.
Нефрогенный НСД чаще бывает врожденным генетически обусловленным заболеванием и характеризуется частичной или полной нечувствительностью почек к АДГ, при этом содержание АДГ может быть нормальным или даже повышенным. Патологический ген обычно локализован в Х-хромосоме. В этих случаях женщины являются гетерозиготными носителями гена, а болеют мужчины. Симптоматический нефрогенный НСД может развиться при тяжелых хронических заболеваниях почек и интоксикациях.
Психогенная полидипсия развивается у больных на фоне психических заболеваний, характеризуется функциональным или органическим поражением головного мозга на уровне центра жажды, что приводит к обильному потреблению жидкости, компенсаторному снижению АДГ и развитию полиурии со сниженной плотностью мочи.
 КЛИНИКА НЕСАХАРНОГО ДИАБЕТА
КЛИНИКА НЕСАХАРНОГО ДИАБЕТА
К основным симптомам НСД относят обильное мочеиспускание, нестерпимую жажду и связанное с этим нарушение сна. Заболевание одинаково часто встречается у мужчин и женщин, наблюдается в любом возрасте, но чаще возникает в 20–40 лет. Врожденные формы болезни могут проявиться у детей уже с первых месяцев жизни. НСД обычно возникает остро, реже симптомы нарастают постепенно. Течение болезни хроническое. Количество выпитой и соответственно выделенной жидкости достигает 3–5 л при легкой форме, 5–8 л при средней тяжести и более 10 л при тяжелой форме заболевания. При полном дефиците АДГ полиурия может достигать 20–30 л в сутки. Мучительная жажда не прекращается ни днем, ни ночью. Больной не может обходиться без воды 20–30 мин, он буквально не отходит от водопроводного крана, предпочитает пить холодную воду, т.к. она лучше утоляет жажду. У детей первым признаком болезни может быть никтурия. Моча, как правило, обесцвечена, относительная плотность всех порций очень низкая – 1001–1003 г/л. Компенсаторно блокируются все системы, выводящие жидкость: мало слез, мало слюны, нет потоотделения, отсюда сухость кожи и слизистых, сухость в носу, назофарингиты, стоматиты, атрофические гастриты.
При полидипсии угнетается аппетит, резко снижается желудочная секреция, желчеобразование, моторика желудочно-кишечного тракта. Вследствие этого развивается анацидный гастрит, колит, склонность к запорам. Из-за постоянного переполнения водой развивается растяжение и опущение желудка, появляются боли в эпигастрии. Со стороны сердечно-сосудистой системы обычно не возникает нарушений, но при тяжелом течении заболевания может развиться тахикардия, лабильный пульс, пониженное или неустойчивое АД. Отклонений со стороны функции легких и печени обычно нет.
Для НСД характерны психические и эмоциональные нарушения: головные боли, бессонница, раздражительность, эмоциональная неуравновешенность, снижение умственной активности, ухудшение памяти. Нефрогенной форме НСД свойственно раннее начало заболевания (в первые 3 мес жизни) и наличие тяжелой умственной отсталости в связи с частыми эпизодами дегидратации мозга с раннего детства.
Некомпенсированная полиурия может привести к резкому обезвоживанию, электролитным и обменным нарушениям. При этом сначала чувство жажды становится нестерпимым, а затем может угаснуть вследствие тяжелых обменных нарушений в гипоталамусе. Появляется и быстро усиливается головная боль, головокружение, тошнота. Больные становятся крайне раздражительными, беспокойными, часто отмечаются галлюцинации, бред, резкое психомоторное возбуждение, бессонница, расстройство зрения, судороги и другие симптомы церебральных нарушений; развивается лихорадка, сгущение крови, коллапс. При лишении жидкости может наступить некроз канальцев почек. Нарушений половой функции у женщин и мужчин с легкой формой НСД обычно нет, они фертильны, но при тяжелой форме заболевания у женщин могут наблюдаться нарушения менструального цикла, бесплодие, выкидыши, у мужчин – снижение либидо и потенции. При развитии заболевания в детском возрасте дети обычно отстают в росте, физическом и половом развитии, страдают энурезом, раздражительны, плаксивы, капризны, плохо занимаются в школе.
 Если причиной НСД послужил рост опухоли мозга или последствия ее лечения (хирургического, рентгено- или телегамматерапии), то тяжесть проявления НСД и прогноз полностью зависят от течения опухолевого процесса. При поражении гипоталамуса наряду с НСД могут наблюдаться и другие эндокринные нарушения: ожирение, патология роста, галакторея, гипотиреоз. Неполноценность гипоталамических структур может быть врожденной. Впервые семейную форму гипоталамического НСД у 5 мужчин и 3 женщин в двух поколениях описал Lacombe в 1841 г. Два поколения врачей Weil с 1884 г. по 1908 г. наблюдали семью, в которой доминантное наследование болезни наблюдалось в 7 поколениях у 45 больных и 45 здоровых родственников обоего пола. В эндокринологических отделениях ЦКБ № 3 МПС (ныне НКЦ ОАО «РЖД») в течение 10 лет наблюдали 100 больных гипоталамическим НСД, у 5 из которых, т.е. в 5% случаев, была обнаружена наследственная форма болезни [6]. Ниже приводим наблюдения и родословные двух больных.
Если причиной НСД послужил рост опухоли мозга или последствия ее лечения (хирургического, рентгено- или телегамматерапии), то тяжесть проявления НСД и прогноз полностью зависят от течения опухолевого процесса. При поражении гипоталамуса наряду с НСД могут наблюдаться и другие эндокринные нарушения: ожирение, патология роста, галакторея, гипотиреоз. Неполноценность гипоталамических структур может быть врожденной. Впервые семейную форму гипоталамического НСД у 5 мужчин и 3 женщин в двух поколениях описал Lacombe в 1841 г. Два поколения врачей Weil с 1884 г. по 1908 г. наблюдали семью, в которой доминантное наследование болезни наблюдалось в 7 поколениях у 45 больных и 45 здоровых родственников обоего пола. В эндокринологических отделениях ЦКБ № 3 МПС (ныне НКЦ ОАО «РЖД») в течение 10 лет наблюдали 100 больных гипоталамическим НСД, у 5 из которых, т.е. в 5% случаев, была обнаружена наследственная форма болезни [6]. Ниже приводим наблюдения и родословные двух больных.
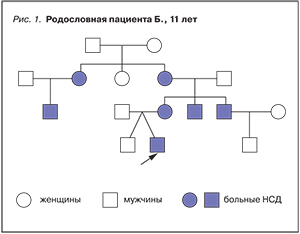
Наблюдение 1. Пациент Б., 11 лет (рис. 1). С 2-летнего возраста выпивал в день 3–4 л холодной воды, диурез достигал 4–7 л/сут при относительной плотности мочи 1003–1005 г/л. У многих родственников по линии матери с раннего детства наблюдались жажда и увеличение количества мочи до 10–15 л/сут, однако это их не беспокоило. Во время обследования одного из членов семьи случайно был обнаружен НСД. Впоследствии этот диагноз был установлен и у всех остальных родственников пациента. Назначение заместительной терапии позволило устранить проявления НСД у всех родных в семье Б. В этой семье НСД наблюдался в 3 поколениях, у 3 женщин и 4 мужчин с наследованием по доминантному типу.
Наблюдение 2. Больной Ф., 40 лет (рис. 2). Диагноз НСД установлен в 39 лет, однако полидипсия и полиурия до 10 л/сут наблюдались уже в 30 лет. Относительная плотность мочи 1001–1003 г/л. Под влиянием лечения хлорпропамидом по 0,25 г 2 раза в день в сочетании с адиурекрином по 0,05 г 1 раз в день количество суточной мочи уменьшалось до 1,5–2 л, а относительная плотность мочи увеличивалась до 1015–1020 г/л.
У деда больного наблюдалась полидипсия и полиурия до 8 л/сут, однако он больным себя не считал и ничем не лечился. У сводной сестры больного случайно при обследовании был обнаружен НСД с полиурией до 4–6 л/ сут при удельном весе мочи 1003–1004 г/л. Применение хлорпропамида по 0,25 г в день привело к нормализации диуреза и повышению удельного веса мочи до 1015–1020 г/л. В данной семье НСД проявился в 1-м и 3-м поколениях у 2 мужчин и 1 женщины с наследованием по аутосомно-доминантному пути, не сцепленному с Х-хромосомой. Мать больного Ф. явилась носительницей мутантного гена без клинических проявлений болезни.
Примером аутосомно-рецессивного пути наследования является DIDMOAD-синдром. Аббревиатура включает первые буквы названий входящих в него заболеваний: Diabetes Insipidus, Diabetes Mellitus, Optic Atrophy, Deafness – несахарный и сахарный диабет, атрофия зрительных нервов и нейросенсорная глухота. Этот синдром известен в литературе и как синдром Вольфрама (Wolfram, 1938). Как DIDMOAD-синдром был описан Рихардсоном и Гамильтоном в 1977 г. Симптомы несахарного и сахарного диабета проявляются у таких пациентов уже в детстве. Атрофия зрительных нервов быстро приводит к полной слепоте. Может наблюдаться катаракта, анемия, нарушение походки, глухота, дилатация мочевых путей. Приводим одно из наших наблюдений.
Наблюдение 3. У двоих сибсов К. (сестра 17 лет и брат 15 лет; рис. 3) DIDMOAD-синдром начался с сахарного диабета 1 типа, на фоне которого развилась жажда и полиурия до 8 л/сут, не корригирующаяся инсулином. Удельная плотность мочи имела тенденцию к снижению. Был диагностирован НСД. Полиурия и жажда быстро компенсировались 2–3 вдыханиями адиурекрина. У обоих больных выявлена атрофия зрительных нервов, причем у сестры с резким снижением остроты зрения и концентрическим сужением полей зрения. Как у сестры, так и у брата были выявлены признаки гипогонадизма.
ДИАГНОСТИКА НЕСАХАРНОГО ДИАБЕТА
В типичных случаях диагностика НСД не представляет трудностей и основывается на характерных жалобах больных на жажду, избыточное потребление воды и частое обильное мочеиспускание и днем и ночью. Подтверждает диагноз исследование мочи по Зимницкому при диурезе 3–20 л/сут с низкой относительной плотностью мочи – 1001–1005 г/л во всех порциях. В крови выявляется гиперосмолярность плазмы больше 300 мОсм/кг и гипернатриемия – более 155 мэкв/л. Осмоляльность мочи при НСД составляет 100–200 мОсм/кг [2, 7, 8].
Для выражения осмолярности биологических жидкостей организма существуют два термина: осмолярность и осмоляльность. Осмоляльность меньше осмолярности на 12–16 мОсм/кг – величину онкотического давления плазмы, которое обусловлено растворенными в ней белками и липидами. Осмоляльность можно рассчитать по формуле: 2х(K+Na)+глюкоза+мочевина, где осмоляльность выражается в мОсм/кг, K, Na, глюкоза, мочевина – в ммоль/л. При осмолярности плазмы 310 мОсм/л и онкотическом давлении 12–16 мОсм/л осмоляльность составляет 275–290 мОсм/кг.
Определение АДГ в сыворотке крови не имеет смысла, т.к. для диагностики НСД важнее знать не абсолютные показатели концентрации гормона в плазме крови, а соотношение осмоляльности крови и мочи. На следующем этапе проводят дифференциально-диагностические пробы [6]: пробу с ограничением жидкости для исключения психогенной полидипсии и пробу с десмопрессином для исключения нефрогенного НСД. При подтверждении диагноза центрального НСД для выяснения этиологии заболевания проводят магнитно-резонансную томографию головного мозга и изучают семейный анамнез.
ЛЕЧЕНИЕ НЕСАХАРНОГО ДИАБЕТА
Лечение НСД прежде всего должно быть этиологическим. При симптоматических формах в первую очередь необходимо проводить терапию основного заболевания (опухоли, воспаления). Однако вне зависимости от причины, приведшей к развитию НСД, при наличии недостаточности АДГ необходима адекватная заместительная терапия.
Основным препаратом для лечения НСД в настоящее время является десмопрессин, который применяется в двух формах: в виде таблеток [9] и в виде назального спрея [10, 11]. Десмопрессин представляет собой синтетический аналог вазопрессина, обладает высокой антидиуретической активностью при отсутствии вазопрессорных свойств. Его прессорная активность составляет всего 1/4000 вазопрессорной активности нативного АДГ. Препарат применяется в виде таблеток по 0,1 и 0,2 мг, действует в течение 7–12 ч, хорошо переносится, высоко эффективен, редко дает аллергические реакции. Синтетические аналоги вазопрессина с успехом применяются у беременных женщин, т.к. не требуют большой дозировки и не содержат окситоцина, повышающего тонус матки. Десмопрессин может быть эффективен и у больных с нефрогенным НСД, у которых сохранена остаточная чувствительность к АДГ.
При использовании высоких доз препарата могут возникнуть симптомы, характерные для задержки жидкости в организме: преходящие сильные головные боли, тошнота, умеренное повышение АД. При передозировке наблюдается гипоосмолярность плазмы, вплоть до водной интоксикации: боли в животе, рвота, понос, эпилептиформные судороги. Эти явления носят преходящий характер и исчезают при снижении дозы или отмене препарата. Начальная доза десмопрессина для взрослых и детей 0,1 мг 3 раза/ сут. Затем необходимо подбирать дозу с учетом самочувствия больного, а также нормализации удельной плотности мочи и диуреза.
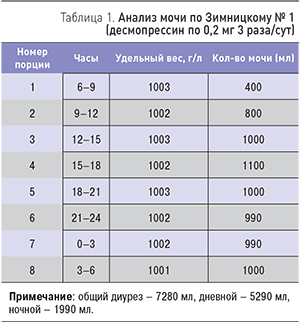
Приводим пример подбора дозы десмопрессина. Пациентка с НСД центрального генеза получала десмопрессин по 0,2 мг 3 раза/сут, однако отмечала плохое самочувствие, повышение температуры до 37,5–38 0С без катаральных явлений, объем суточного диуреза составлял до 7–8 л/сут. В исследовании мочи по Зимницкому наблюдался высокий дневной и ночной диурез и низкий удельный вес (1001–1003 г/л) во всех порциях мочи (табл. 1).
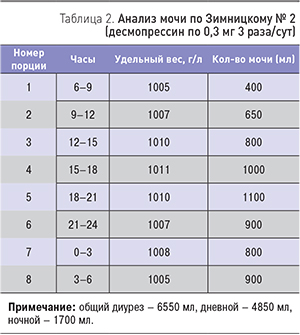
Доза десмопрессина была увеличена до 0,3 мг 3 раза/сут. Самочувствие пациентки фактически не изменилось, сохранялся субфебрилитет. Диурез уменьшился незначительно: с 7,280 до 6,550 л/сут (табл. 2).
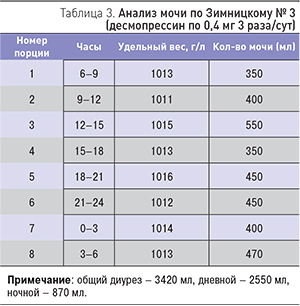
Увеличение дозы десмопрессина до 0,4 мг 3 раза/сут привело к нормализации удельного веса мочи (табл. 3). Несмотря на то что диурез оставался высоким – 3,420 л, пациентку это не беспокоило. При этом она отмечала хорошее самочувствие и нормализацию температуры тела.
Таким образом, более точный подбор дозировки препарата позволил значительно улучшить качество жизни пациентки и объективизировать оценку адекватности терапии.
Десмопрессин отечественного производства в таблетках по 0,1 и 0,2 мг аналогичен зарубежному препарату. В РФ зарегистрирован десмопрессин в форме назального дозированного спрея. 1 доза препарата содержит 10 мкг активного вещества, суточная доза для интраназального применения у взрослых составляет 10–40 мкг/сут в 1 или 2 приема. При отеке слизистой оболочки носа или выраженном рините рекомендуется сублингвальное применение десмопрессина. При переходе с сублингвальной формы на назальный спрей требуется увеличение дозы в 1,5 раза [10].
Лечение нефрогенного НСД значительно труднее. Применяют препараты, которые направлены на уменьшение диуреза и жажды. Некоторые препараты вызывают у больных НСД парадоксальный эффект. Например, тиазидные мочегонные, которые у больных НСД снижают клубочковую фильтрацию и экскрецию натрия с уменьшением диуреза на 50–60%. Следует помнить о необходимости восполнения калия. Комбинированная терапия тиазидными мочегонными с препаратами калия эффективна при лечении НСД, связанного с внутричерепной гипертензией.
Сахароснижающий препарат хлорпропамид обладает выраженным антидиуретическим действием и может применяться при сочетании сахарного и несахарного диабета. Могут стимулировать секрецию АДГ противоопухолевые средства, нейродепрессанты, никотин. Этиловый спирт при НСД оказывает парадоксальный эффект и уменьшает диурез. Нестероидные противовоспалительные препараты могут усилить эффект АДГ, т.к. блокируют PgE2 и препятствуют его инактивации в почках.
ЗАКЛЮЧЕНИЕ
Таким образом, лучше поддаются лечению гипоталамические формы НСД. При нефрогенной форме заболевания все перечисленные препараты, как правило, малоэффективны или неэффективны. При психогенной полидипсии больные обычно наблюдаются у психиатра; иногда улучшает течение седативная терапия.



