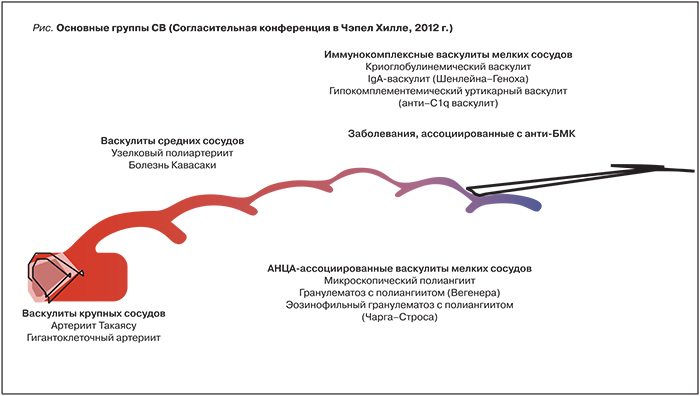
Системные васкулиты (СВ) – гетерогенная группа заболеваний, основным морфологическим признаком которых является воспаление сосудистой стенки, а клинические проявления определяются типом, калибром, локализацией пораженных сосудов и тяжестью иммуновоспалительных изменений [1]. Современная классификация СВ, принятая в 2012 г. на Согласительной конференции в Чэпел Хилл (Chapel Hill, USA), выделяет основные группы СВ в зависимости от калибра пораженных сосудов (крупные, средние, мелкие) и учитывает особенности иммунных механизмов (табл. 1, рисунок) [2].
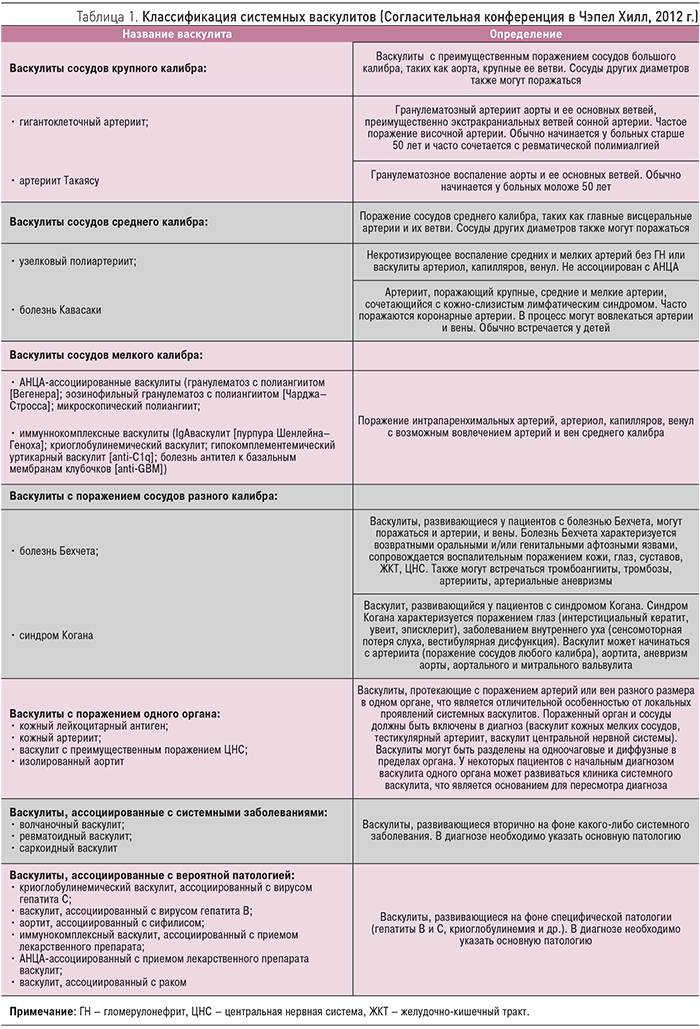
AНЦА-ассоциированные СВ (АНЦА-СВ) характеризуются наличием циркулирующих аутоантител к цитоплазме нейтрофилов (АНЦА) и хроническим мало(пауци)иммунным воспалением стенки мелких сосудов с разнообразной клинической картиной с частым вовлечением легких и почек [1–4]. AНЦА представляют собой гетеpогенную группу аутоантител, реагирующих с антигенами, находящимися в цитоплазме нейтрофилов и лизосомах моноцитов. При непрямой иммунофлюоресцентной микроскопии или с помощью иммуноферментного анализа определяют антитела нейтрофилов к протеиназе-3 (цитоплазматические с-АНЦА) и к миелопероксидазе (перинуклеарные p-АНЦА) [4]. АНЦА напрямую воздействуют на клетки-мишени (нейтрофилы, моноциты) за счет связывания с антигенами (протеиназы-3, миелопероксидазы) на поверхности клеточной мембраны и вызывают активацию нейтрофилов в пределах сосудистого эндотелия. Активация нейтрофилов, их дегрануляция с высвобождением кислородных радикалов и протеолитических ферментов имеет центральное значение в повреждении сосудистой стенки с развитием некротизирующего васкулита [2, 4, 5]. Некротизирующее воспаление с формированием гранулем, развивающееся в сосудах мелкого калибра различных органов, обусловливает тяжесть поражения при АНЦА-СВ. Отсутствие иммунных депозитов и потребления комплемента при АНЦА-СВ породило термин «пауцииммунные, или малоиммунные», хотя это не означает отсутствие иммунологических расстройств в патогенезе [6].
В течение последних лет в лечении АНЦА-СВ наметился значительный прогресс. Это связано не только с расширением возможностей лабораторной диагностики АНЦА-СВ, что позволяет начать активную терапию в ранней стадии заболевания, но и с разработкой новых генно-инженерных биологических препаратов [4, 7]. Вместе с тем, несмотря на внедрение современных лабораторных и инструментальных методов, диагностика АНЦА-СВ остается затруднительной для врачей различных специальностей, что обусловлено полиорганностью поражения и многообразием клинической картины [1, 2, 4, 5] (табл. 2).
За последние десятилетия в мире отмечена тенденция к увеличению распространенности АНЦА-СВ [2–4]. Ежегодная заболеваемость АНЦА-СВ составляет 10–20 на 1 млн в год [2, 3] и различается по регионам. В России, как и в странах Европы, ГПА встречается значительно чаще, чем МПА и ЭГПА, в то время как в Японии, наоборот, выше распространенность МПА [4]. Пик заболеваемости приходится на 45–55 лет, мужчины болеют чаще, чем женщины.
В этиологии АНЦА-СВ, которая продолжает изучаться, вероятно, определенную роль играют носительство золотистого стафилококка (при ГПА), лекарственная терапия (при ЭГПА), полиморфизм генов, кодирующих протеиназу-3 и ее основной ингибитор α1-антитрипсин (SERPIN A1), предрасполагающий к гиперпродукции антител к протеиназе-3 [2, 4].
Поражение почек характерно для всех AНЦА-СВ, но частота вовлечения почек неодинакова: максимальна при МПА (90%) и ГПА (80%), значительно более редка при ЭГПА (20–45%). Клинические проявления поражения почек включают быстропрогрессирующий ГН – наиболее типичный вариант течения, нефротический синдром, остронефритический синдром, бессимптомную протеинурию и микрогематурию, макрогематурию (редко), артериальную гипертензию [4, 6]. ГН в рамках АНЦА-СВ характеризуется очаговым и сегментарным некротизирующим воспалением с выраженной экстракапиллярной реакцией с формированием полулуний в клубочках почек разной степени зрелости [1, 2, 4, 5, 7, 8]. Характерными внепочечными проявлениями АНЦА-СВ являются следующие [1, 2, 4, 5, 8]:
- Поражения ЛОР-органов, глаз, полости рта:
- геморрагический васкулит (ГВ) и МПА – кровянистые выделения из носа, средний отит, мастоидит, поражение придаточных пазух, эписклерит, увеит, кератит;
- ГВ – язвы полости рта, перфорации носовой перегородки, седловидная деформация носа, стеноз трахеи, протрузия глазного яблока, окклюзия сосудов глазного дна;
- МПА – атрофия слизистой (без признаков гранулематозного воспаления);
- ЭГПА – аллергический ринит, полипоз.
- Поражение легких:
- ГПА – узелки, инфильтраты, полости распада;
- МПА – диффузное альвеолярное повреждение (кровохарканье, дыхательная недостаточность), легочный фиброз, интерстициальная пневмония, плевриты;
- ЭГПА – астма (до 30 лет), эозинофильная пневмония, мигрирующие затемнения, узелки.
- Поражение ЖКТ:
- ГПА, МПА – абдоминалгии, желудочно-кишечные кровотечения;
- ЭГПА – эозинофильный гастроэнтерит, некротизирующий васкулит мезентериальных сосудов с перфорацией кишечника.
- Поражение мочеполовой системы:
- ГПА – мочепузырные кровотечения (некротизирующий васкулит сосудов мочевого пузыря);
- МПА, ЭГПА – стриктуры мочеточников (васкулит сосудов мочеточников и периуретеральной клетчатки).
- Поражение сердца:
- ГПА – пери- и миокардит (редко);
- ЭГПА: в 20% случаев – коронариит, эозинофильный миокардит, перикардит, эндокардит (в 50% – причина смерти).
- Поражение нервной системы:
- ГПА – множественные мононевриты, поражения черепно-мозговых нервов, спинного мозга, гранулематоз твердой мозговой оболочки, дистальная полинейропатия;
- МПА – полинейропатия;
- ЭГПА – множественные мононевриты, асимметричные моторные и сенсорные нарушения нижних конечностей.
- Другие симптомы:
- лихорадка, потеря веса, артралгии, анемия, лейкоцитоз, тромбоцитоз, пурпура;
- ЭГПА – эозинофилия.
ЛЕЧЕНИЕ AНЦА-СВ
Выделяют два этапа лечения AНЦА-СВ:
- Индукция ремиссии (обычно в течение 3–6 мес). Цель: быстрое купирование активности болезни.
- Поддержание ремиссии (в течение не менее 18–24 мес, нередко – пожизненно). Цель: предотвратить рецидив болезни, используя менее агрессивные режимы терапии, чем для индукции. При развитии рецидивов назначают те же препараты, что использовались для инициальной терапии.
К патогенетической терапии относится иммуносупрессивная терапия (глюкокортикостероиды [ГКС], циклофосфамид [ЦФА], метотрексат, азатиоприн, микофенолата мофетил, биологические препараты [ритуксимаб] и др.), плазмаферез и внутривенное введение донорского поливалентного иммуноглобулина [1, 2, 4, 5, 8, 9].
 Стандартная схема индукционной терапии
Стандартная схема индукционной терапии
ЦФА внутрь (2 мг/кг/сут) или внутривенно (15 мг/кг, но не >1 г, с интервалом 2 нед первые 3 инфузии, а затем каждые 3 нед) в сочетании с ГКС в высоких дозах (0,5–1 мг/кг внутрь ± пульс-терапия в дозе до 1000 мг в течение 1–3 сут). У пациентов в возрасте старше 60 лет, а также с нарушением функции почек дозу ЦФА следует снизить на 25%. Лечение ЦФА продолжают в течение 3–12 мес. У пациентов с менее тяжелыми формами заболевания или имеющих противопоказания к ЦФА следует назначать ритуксимаб и ГКС в качестве альтернативного режима индукционной терапии [2, 6–8]. Проведение плазмафереза рекомендовано пациентам с диффузными легочными кровотечениями и пациентам с перекрестным синдромом (сочетание АНЦА-СВ и анти-ГБМ ГН [ГН, обусловленный антителами к гломерулярной базальной мембране]). У пациентов, остающихся диализзависимыми и не имеющих внепочечных проявлений заболевания, терапию ЦФА следует отменить через 3 мес.
Поддерживающая терапия
После достижения ремиссии дозу ГКС постепенно снижают (по 1,25 мг) на 25% в мес до достижения дозы 20 мг/сут, затем на 10% каждые 2 нед до 10 мг/сут. В дальнейшем возможно снижение дозы ГКС (преднизолона) на 1,25 мг каждые 4 нед (в идеале до 7,5 мг или полной отмены), ЦФА – отменяют и/или назначают азатиоприн (2 мг/кг/сут), реже – метотрексат (если скорость клубочковой фильтрации [СКФ] больше 60 мл/ мин). Метотрексат противопоказан больным с почечной недостаточностью, т.к. он экскретируется почками и при снижении СКФ накапливается в организме, вызывая тяжелую цитопению и поражение слизистых оболочек.
При непереносимости азатиоприна и метотрексата возможно назначение лефлуномида или микофенолата мофетила [2, 6, 9]. Пациентам, у которых сохраняется полная ремиссия, поддерживающую терапию следует проводить не менее 18 мес. Больным, остающимся диализзависимыми и не имеющим внепочечных проявлений заболевания, поддерживающую терапию проводить не следует. У пациентов с поражением верхних дыхательных путей в качестве дополнительного препарата для поддерживающей терапии следует применять сульфаметоксазол/триметоприм.
Прогноз АНЦА-СВ всегда серьезен: в отсутствие лечения смертность в течение первого года АНЦА-СВ с поражением почек достигает 90% [4, 5, 8, 9]. Наиболее частыми причинами смерти являются почечная и дыхательная недостаточность, интеркуррентные инфекции. При ЭГПА причиной смерти в половине случаев становятся сердечно-сосудистые осложнения. 5-летняя смертность на фоне стандартной индукционной терапии ЦФА и ГКС достигает 20%, наиболее неблагоприятным прогнозом характеризуется МПА (5-летняя смертность 27,5%) в сравнении с ГПА и ЭГПА (13,2 и 13,9% соответственно).
В настоящей статье мы приводим клиническое наблюдение особенностей течения АНЦА-СВ у пациентки 63 лет.
Клинический пример
Пациентка Д. 63 лет поступила в пульмонологическое отделение НОКБ им. Н.А. Семашко в начале октября 2012 г. с жалобами на кашель, повышение температуры до субфебрильных цифр, слабость. Из анамнеза стало известно, что сухой кашель, эпизоды болей в суставах конечностей, лихорадку до 38°С, одышку при физической нагрузке, общую слабость, недомогание стала отмечать с сентября 2012 г. В течение нескольких дней тогда же наблюдала появление мелкоточечной сыпи красного цвета на коже конечностей, исчезнувшей спонтанно. Наличие какой-либо бронхолегочной патологии ранее отрицала.
При обследовании в стационаре рентгенологически были выявлены инфильтративные изменения в нижней доле левого легкого, что было расценено как внегоспитальная левосторонняя нижнедолевая пневмония, осложнившаяся плевритом. Также в ходе обследования впервые выявлена анемия (гемоглобин 85 г/л), ускорение СОЭ – 101 мм/ч, повышение мочевины – 17,6 ммоль/л, креатинина – 250 мкмоль/л, снижение СКФ до 25 мл/мин, повышение С-реактивного белка – 387 мг/л. В общем анализе мочи: умеренная протеинурия (белок – 0,96 г/л), гематурия до 20–25 в п/зр, гиалиновые цилиндры 1–2 в п/зр. Суточная протеинурия – 0,8 г/сут. На основании полученных данных был также установлен диагноз хронического ГН с изолированным мочевым синдромом, хроническая болезнь почек 4С, хроническая почечная недостаточность IIА ст. Нефробиопсия не проводилась. Кроме того, при фиброгастродуоденоскопии было установлено наличие язвенной болезни желудка в фазе обострения. Проведено лечение: антибиотики, отхаркивающие, бронхолитики, коррекция анемии, противоязвенные препараты, нефропротективные препараты. На фоне проводимого лечения состояние больной улучшилось, уменьшилась выраженность одышки, нормализовалась температура тела, рентгенологически и лабораторно достигнута положительная динамика, снизился уровень азотемии, протеинурии, повысился уровень гемоглобина до 96 г/л. Пациентка выписана на амбулаторное лечение.
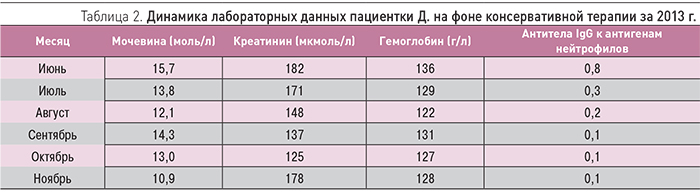
Через 2 нед у больной наступило ухудшение состояния: повышение температуры до 38°С, боли в левой половине грудной клетки при дыхании, кашель. Госпитализирована повторно. При обследовании выявлены левосторонний плеврит, пневмонит, перикардит, анемия (гемоглобин 80 г/л), нарастающая азотемия (296–372 млмоль/л), признаки ДВС-синдрома. Высказано предположение о наличии у больной АНЦА-СВ. В ходе дообследования, выявления повышенного общего титра АНЦА и р-АНЦА и клинической картины заболевания был установлен диагноз: АНЦА-СВ (МПА) с поражением кожи, легких по типу левостороннего нижнедолевого пневмонита, левостороннего экссудативного плеврита, сердца (перикардит), почек по типу быстропрогрессирующего ГН, анемия тяжелой степени, ДВС-синдром. К назначенной терапии был добавлен преднизолон (30 мг/ сут), продолжалась антибактериальная терапия, коррекция анемии (препараты железа, эритропоэтины). На фоне лечения явления экссудативного плеврита регрессировали, однако сохранялись и нарастали признаки прогрессирования почечной недостаточности (креатинин до 430 мкмоль/л, мочевина 26 ммоль/л, СКФ менее 15 мл/мин). С 02.11.12 г. была начата заместительная почечная терапия методом гемодиализа. При соблюдении показателей адекватности заместительной почечной терапии гемодиализ проводился в режиме 2 раза/нед по 3 ч. В результате проводимого лечения в течение 2 мес отмечена положительная динамика лабораторных показателей: гемоглобин – 114 г/л, СОЭ – 15 мм/ч, С-реактивный белок – 6 мг/л. Снизились показатели мочевины до 22,6 ммоль/л, креатинина – до 198 мкмоль/л. В анализах мочи: протеинурия до 0,4 г/л, эритроцитурия до 3–5 в п/зр. Пациентка находилась под наблюдением нефролога, продолжалась терапия преднизолоном в дозе 30 мг/сут. В феврале 2013 г. проведена нефробиопсия, выявлены сегментарные и циркулярные, преимущественно фиброзно-клеточные полулуния, участок фибриноидного некроза капиллярных петель. В клубочках с сегментарным склерозом имелись сращения с капсулой Боумена. Картина соответствовала экстракапиллярному пауцииммунному ГН с полулуниями. В результате был верифицирован диагноз: АНЦА-СВ (МПА) с поражением легких по типу левостороннего нижнедолевого пневмонита с исходом в фиброз, левостороннего экссудативного плеврита, поражением сердца (перикардит), почек по типу экстракапиллярного пауцииммунного ГН с полулуниями, анемия тяжелой степени, ДВС-синдром. Язвенная болезнь желудка в фазе ремиссии. К лечению подключены цитостатики (циклофосфан 200 мг 1 раз/нед), с учетом индивидуальной переносимости препарата, преднизолон с 30 мг/ сут с постепенным снижением дозы до 15 мг/сут. В апреле 2013 г. гемодиализ проводился 1 раз/нед. С учетом достигнутого снижения активности васкулита, нормализации уровней АНЦА, гемоглобина, С-реактивного белка, клинического улучшения, снижения уровня азотемии в мае 2013 г. заместительная почечная терапия была полностью отменена (табл. 2). В июне 2013 г. больная проконсультирована в ГКБ им. С.П. Боткина (Москва). Диагноз был подтвержден, ведение одобрено. Рекомендовано подключить к лечению азатиоприн 50 мг/сут, продолжить прием преднизолона 15 мг/сут. Лечение циклофосфаном завершено. Динамика лабораторных показателей пациентки Д. на фоне консервативной терапии за 2013 г. представлена в табл. 2.
В течение 2014 г. пациентка регулярно наблюдалась у нефролога, получала азатиоприн 50 мг/сут, преднизолон 15 мг/сут, показатели клинической и лабораторной активности васкулита не нарастали, самочувствие было удовлетворительным. В мае 2015 г. на фоне острой респираторной вирусной инфекции отмечено нарастание титра АНЦА без клинического ухудшения. Иммуносупрессивная терапия была продолжена препаратами микофеноловой кислоты (2000 мг/сут), преднизолоном 5 мг/сут. В 2016 г. в анализах крови: гемоглобин – 132 г/л, мочевина – 12,8 ммоль/л, креатинин – 138,5 мкмоль/л, в анализах мочи (общий анализ мочи, суточный белок в моче, анализ мочи по Нечипоренко) – белок отрицательный, осадок без патологии.
ОБСУЖДЕНИЕ
Представленный случай иллюстрирует проявления МПА в виде тяжелого легочно-почечного синдрома, встречающегося у 50% пациентов с АНЦА-СВ [4, 6]. МПА был впервые описан как особая форма узелкового полиартериита, протекающая с некротизирующим ГН, в 1948 г. В последующем детальное изучение клинических, морфологических и иммунологических признаков привело к выделению МПА в самостоятельную нозологическую единицу. Средний возраст начала заболевания составляет 50 лет и старше [3, 5, 14]. Типичным в нашем клиническом случае было поражение почек с развитием быстропрогрессирующего ГН. К моменту постановки диагноза функция почек у пациентки была нарушена, как и у большинства больных, и быстро ухудшалась в дальнейшем вплоть до потребности в гемодиализе. Такая картина специфична для МПА, т.к. согласно данным литературы до 25–50% пациентов МПА требуют диализного лечения [1, 2, 4, 9]. Поражение почек проявляется развитием некротизирующего ГН. Экстракапиллярная пролиферация ведет к образованию полулуний, поражающих более 60% клубочков почти в большинстве случаев МПА. Картина биопсии почки в нашем клиническом примере соответствовала характерному описанию. К типичным легочным проявлениям МПА, также имеющим место у нашей больной, относятся диффузное альвеолярное повреждение, интерстициальный легочный фиброз и плеврит. Кровохарканье, которое в ряде случаев наблюдается при МПА вследствие диффузного легочного капиллярита, у нее отсутствовало. Доминирующим в клинической картине МПА был легочно-почечный синдром с поражением легких, плевры и картиной быстропрогрессирующего ГН.
Таким образом, диагностика АНЦА-СВ, дифференциальная диагностика с другими васкулитами и заболеваниями неваскулитной природы (в первую очередь инфекциями) нередко представляет значительные трудности в клинической практике. AНЦА-ассоциированные васкулиты обладают значительным количеством общих черт. В нефрологической клинике важную роль в диагностике играет проведение биопсии почки, выявление «малоиммунных» изменений облегчает постановку диагноза и позволяет дифференцированно подходить к лечению. Диагноз АНЦА-СВ МПА основывается на клинической картине, данных иммунологического и морфологического исследования, подтверждается выявлением повышенного титра АНЦА (р-АНЦА). Проводимое иммуносупрессивное лечение, в том числе ГКС, циклофосфаном, азатиоприном, препаратом микофеноловой кислоты, позволило добиться у пациентки клинико-лабораторной ремиссии МПА, легочно-почечных симптомов заболевания и завершить заместительную почечную терапию в связи с улучшением функции почек.



