ВВЕДЕНИЕ
Многочисленные научно-практические исследования в лечении заболеваний сердечно-сосудистой системы, развитие клинической фармакологии, новейшая «креативная» хирургия аритмий и ишемической болезни сердца, врожденных и приобретенных пороков сердца, терминальной сердечной недостаточности, применение эндоваскулярных технологий, развиваемое направление «гибридных операций» спасает сегодня жизни взрослых пациентов и детей [1, 2, 3].
По данным международных регистров, в мире отмечается снижение смертности от кардиоваскулярных заболеваний (рис.1).
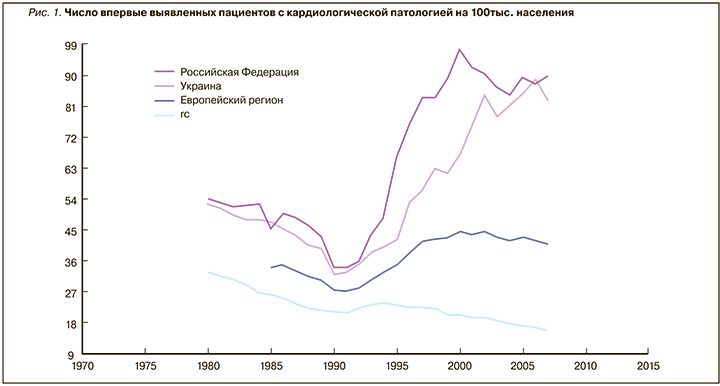
Однако данной группе пациентов показан пожизненный прием НПВП и/или АТП для профилактики нежелательных сердечно-сосудистых событий. С этой целью ежегодно в США выписывается более 35 млн рецептов для получения НПВС и/или пероральных антикоагулянтов. И это только одна сторона исследуемого вопроса.
По данным мировой статистики, отмечается рост числа пожилых людей. По данным ООН, в 1994–2014 гг. количество людей старше 60 лет удвоилось и уже в 2014 г. превысило число детей в возрасте до пяти лет в мире. В большинстве своем это люди с коморбидной патологией, которые относятся к категории «хрупкий пациент», в ведении которых показана комбинированная терапия, при этом часто имеет место сочетание приема НПВП и АТП. Имеется огромное количество пациентов, бесконтрольно принимающих НПВП в различных лекарственных формах по поводу хронической боли, обусловленной заболеваниями опорно-двигательного аппарата или иными причинами [4, 5].
Немалую роль в современной жизни имеют и средства массовой информации, представляющие площадку для неконтролируемой рекламы фармакопрепаратов, значительную долю в которой занимают НПВП. При этом основные из нежелательных побочных эффектов приема (эзофагогастроэнтероколопатии) остаются «за занавесом» [6].
Тем не менее, по данным 1-го Всероссийского Форума АнтиКоагулянтной Терапии (ФАКТ) (23–24 марта 2016 г., Россия, Москва), ежегодная частота больших кровотечений на фоне лечения НПВС и/ или антитромботическими препаратами составляет от 0,2 до 5,2%, причем частота фатальных кровотечений колеблется от 0,07 до 0,7% [7, 8, 9].
Все это требует более широко внедрения принципов медицины «Трех П» – персонифицированной, профилактической и предиктивной, что, по расчетным данным, должно позволить снизить смертность от сердечно-сосудистых заболеваний на 23–47 % (заседание Совета Федерации РФ, 17.03.2015).
В связи с этим применение алгоритма ведения пациентов, получающих НПВП и АТП, и создание классификации повреждений слизистой с целью дальнейшего перехода на клинические рекомендации как руководство к действию является крайне актуальным.
МАТЕРИАЛЫ И МЕТОДЫ
С целью разработки алгоритма ведения пациентов, получающих НПВП и АТП, а также классификации мультифокальных повреждений слизистой пищеварительного тракта на фоне проводимого лечения мы использовали имеющийся опыт зарубежных коллег и информационные ресурсы PubMed, Cochrane Library, DynaMed, Google Scholar, систему поиска TRIP Database, которая на сегодняшний день является самой полной по охвату общедоступной системой метапоиска, имеющей развитую систему сортировки документов, существующие нормативные документы, а также собственный опыт.
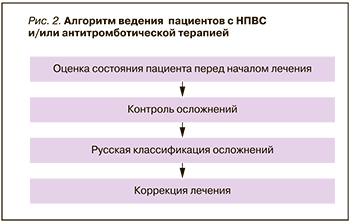 Алгоритм ведения пациентов, получающих НПВП и/или АТП, представлен на рис. 2.
Алгоритм ведения пациентов, получающих НПВП и/или АТП, представлен на рис. 2.
Оценка состояния пациента перед началом лечения НПВП и/или АТП (по назначению терапевта, кардиолога, кардиохирурга или врача другой специальности) должна включать следующие данные [10, 11]:
- Объективные данные: доза и вид предлагаемого для лечения препарата.
- Субъективные данные: обязательный сбор анамнеза (перенесенные заболевания и операции со стороны желудочно-кишечного тракта), клинико-лабораторные характеристики пациента, включающие состояние свертывающей системы крови (МНО), мочевыделительной системы (мочевина, креатинин), гепатобилиарной системы (билирубин, АЛТ, АСТ), данные эндоскопического обследования (наличие эрозивно-язвенных изменений до начала лечения в желудочно-кишечном тракте), анализ кала на скрытую кровь.
- Фармакокинетику и фармакодинамику препаратов, в том числе сочетания препаратов. Желательна консультация клинического фармаколога.
Методы контроля осложнений
- Общий анализ крови (гемоглобин).
- Анализ кала на скрытую кровь в различных модификациях.
- При наличии подозрения на наличие скрытого кровотечения показано проведение эндоскопических методов исследования. В большинстве случаев эндоскопия сочетает в себе высокотехнологичный метод диагностики с миниинвазивным лечебно-оперативным способом лечения. Приоритетность выбора диагностического метода обусловлена клиническими данными в соответствии с предполагаемым источником кровотечения, а дальнейшая тактика ведения пациента и характер проводимого лечения, в свою очередь, определяются эндоскопическими данными. При невозможности эндоскопического гемостаза и неэффективности проводимой консервативной терапии показано своевременное хирургическое лечение [12].
Собственный клинический и эндоскопический опыт, опыт отечественных и зарубежных коллег, а также данные информационных ресурсов показали необходимость создания унифицированной классификации мультифокальных эзофагогастродуоденоэнтероколопатий.
Создание подобной классификации преследует следующие цели:
- Создание формулы, которая позволит специалисту при первом взгляде оценить уровень обследования и состояние слизистой желудочно-кишечного тракта на фоне применения НПВС и/или антитромботических препаратов.
- Благодаря выходу на каскад формула позволит характеризовать наиболее тяжелое повреждение желудочно-кишечного тракта с учетом тяжести кровопотери и риска тромбоэмболических осложнений.
- Предлагаемая Московская классификация при применении шкал позволит провести стратификацию рисков рецидива кровотечения и тромбоэмболических осложнений.
- Использование Московской классификации позволит с высокой степенью эргономичности перейти к клиническим рекомендациям как руководству для определения дальнейшей тактики ведения пациентов с тяжелой коморбидной патологией.
- Такая классификация необходима для определения единого взгляда на заболевание и согласованной тактики ведения пациента эндоскопистом, хирургом и врачами других специальностей (терапевтом, кардиологом, неврологом и т.д.) [12].
РЕЗУЛЬТАТЫ
Московская классификация мультифокальных повреждений слизистой пищеварительного тракта нестероидными противовоспалительными (НПВП) и антитромботическими препаратами (АТП)
БУКВЕННО-ЦИФРОВАЯ СИМВОЛИКА
 ОБЩАЯ ШКАЛА
ОБЩАЯ ШКАЛА
Буквенная символика отдела пищеварительного канала):
- E (esophagus – пищевод).
- G (gaster – желудок).
- D (duodenum – двенадцатиперстная кишка).
- I (intestine – тонкая кишка).
- C (colon – толстая кишка).
Цифровая символика визуальной эндоскопической характеристики обнаруженного очага повреждения:
- 0 – отсутствие всяких изменений, нет признаков кровотечения (рис. 3), здоровая слизистая.
- I – неэрозивные изменения (reddned lesions).
Определяется гиперемия слизистой, очаговые и диффузные геморрагические изменения, множественные очаги ангиодисплазии в виде очагов ярко-вишневого цвета неправильно округлой и неправильно овальной формы, не возвышающиеся над окружающей слизистой размером 2–5 мм, при инструментальной пальпации бледнеют. Подтеканий свежей крови не выявляется.
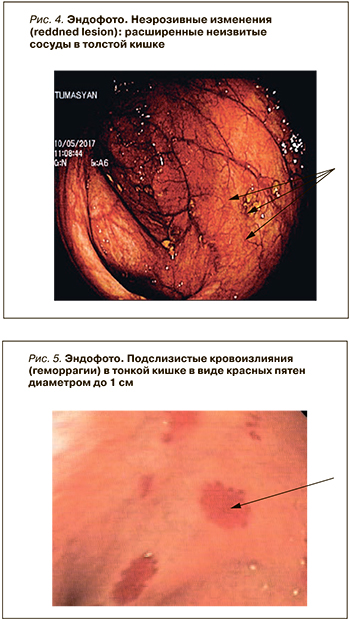 В узкоспектральном режиме (NBI-, FICE-, i-scan) определяются либо расширенные неизвитые сосуды (рис. 4), либо мелкоточечные подслизистые кровоизлияния (геморрагии) в виде мелких красных пятен диаметром до 1 см (рис. 5).
В узкоспектральном режиме (NBI-, FICE-, i-scan) определяются либо расширенные неизвитые сосуды (рис. 4), либо мелкоточечные подслизистые кровоизлияния (геморрагии) в виде мелких красных пятен диаметром до 1 см (рис. 5).
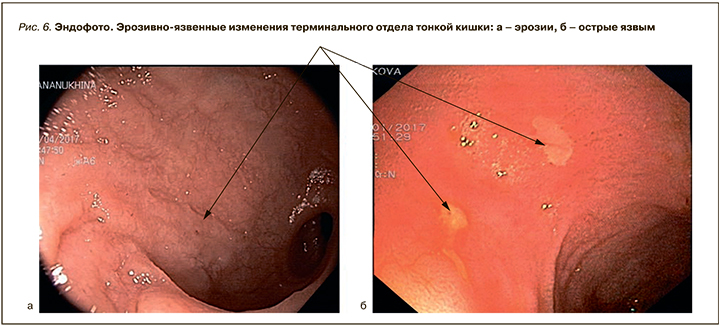
- II – выявляются эрозии, острые язвы, хронические язвы единичные и множественные (рис. 6).
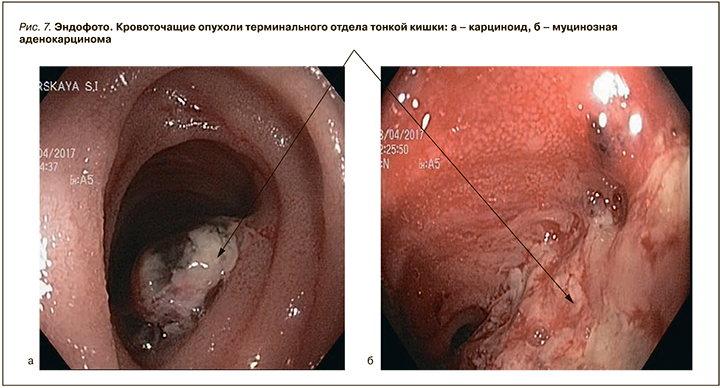
- III – видны кровоточащие опухоли и полипы: доброкачественные или злокачественные (рис. 7) [13].
- обследование данного отдела пищеварительной трубки по тем или иным причинам не проведено.
Буквенная символика эндоскопической характеристики кровотечения из обнаруженного очага повреждения:
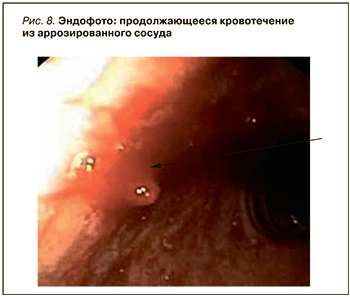
- a – продолжающееся (рис. 8);
- b – перенесенное.
Имеющая широкое распространение в международной практике классификация Forrest (1974), разработанная только для оценки язвенных кровотечений из желудка и двенадцатиперстной кишки, здесь, как нам кажется, не может быть применена, так как в данной ситуации мы должны оценить состояние всех отделов пищеварительного канала.
Формулы общей шкалы Русской классификации
Примеры:
E0G0D0I0C0 – здоровая слизистая на всем протяжении пищеварительного канала;
E0G0DIICIIIb – в пищеводе и желудке нет изменений, в двенадцатиперстной кишке обнаружены неэрозивные изменения, тонкая кишка не обследована, в толстой кишке выявлена опухоль с признаками перенесенного кровотечения;
E0GIIbDIIC0 – в пищеводе и толстой кишке нет изменений, в желудке выявлены эрозивно-язвенные изменения с признаками перенесенного кровотечения, в двенадцатиперстной кишке неэрозивные изменения (reddned lesions), тонкая кишка не обследована.
Эндоскопические методы диагностики для оценки состояния слизистой пищеварительной трубки при применении НПВП и АТП
- Эзофагогастродуоденоскопия (ЭГДС) проводится в двух модификациях: – осмотр в белом свете (желательно с высокой степенью разрешения) пищевода, желудка, двенадцатиперстной кишки и обязательно начального отдела тонкой кишки (проведение эндоскопа за связку Трейтца) для диагностики кровотечения или выявления патологии в начальном участке тонкой кишки;
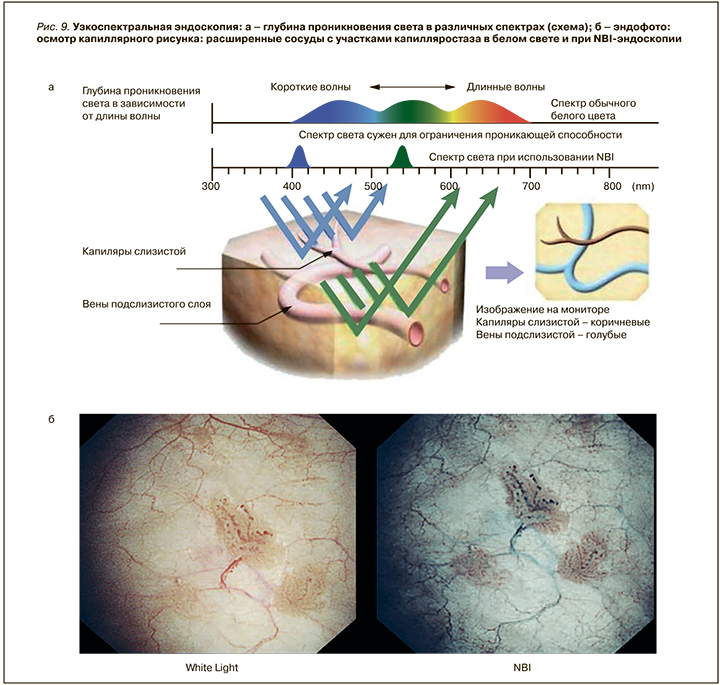
- уточняющие методики, в частности узкоспектральная эндоскопия (NBI-, FICE-, i-scan), показаны при подозрении на аррозию капилляра, не видимую в белом свете (рис. 9).
Возможно также проведение эндоскопического гемостаза.
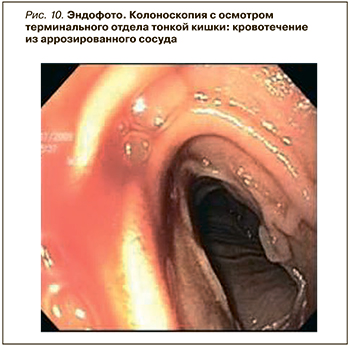
- Колоноскопия – осмотр в белом свете (желательно с высокой степенью разрешения) с обязательным осмотром терминального отдела тонкой кишки (15–20 см – участок тонкой кишки, доступный осмотру) для диагностики кровотечения или выявления патологии в терминальном участке тонкой кишки (рис. 10). Возможно также проведение эндоскопического гемостаза [14].
 Видеокапсульная энтероскопия (рис. 11 а, б, в) – метод, разработанный для диагностики кровотечения и выявления патологии в тонкой кишке.
Видеокапсульная энтероскопия (рис. 11 а, б, в) – метод, разработанный для диагностики кровотечения и выявления патологии в тонкой кишке.
Абсолютные показания:
- клинически – это немотивированная хроническая (т.е. постоянная) слабость, кровь в стуле, положительная реакция на скрытую кровь в кале (так называемый гемоккультный тест), похудание;
- анемия;
- подозрение на скрытое желудочно-кишечное кровотечение, при отсутствии явного источника в желудке или толстой кишке;
- подозрение на болезнь Крона тонкой кишки;
- наследственные полипозные синдромы (синдром Пейтца–Егерса, семейный аденоматозный полипоз, ювенильный полипоз и т.п.).
Относительные показания:
- целиакия (или глютеновая энтеропатия);
- оценка распространенности поражения и/или эффективности лечения уже существующей болезни Крона;
- длительно существующая боль в животе.
Противопоказания:
- острая кишечная непроходимость;
- декомпенсированная стриктура;
- многочисленные операции на органах брюшной полости.
 Эндоскопический гемостаз невозможен. Метод является диагностическим.
Эндоскопический гемостаз невозможен. Метод является диагностическим.
Одно- и двухбаллонная энтероскопия (рис. 12 а, б, в) проводится в специализированных учреждениях при наличии соответствующей аппаратуры. Возможно как антеградное, так и ретроградное введение энтероскопа. Метод является уточняющим и проводится после выявления патологии в тонкой кишке при видеокапсульной энтероскопии с целью уточнения диагноза и при необходимости забора биопсии. Возможно также проведение эндоскопического гемостаза [15, 16].
Итоговые уточняющие шкалы тяжести повреждений слизистой пищеварительного канала и стратификации рисков кровотечений и тромбоэмболических осложнений при лечении НПВП и АТП для Московской классификации
Оценки рисков кровотечения и развития тромбоэмболических осложнений производятся лечащим врачом или реаниматологом в зависимости от профильности отделения пребывания пациента.
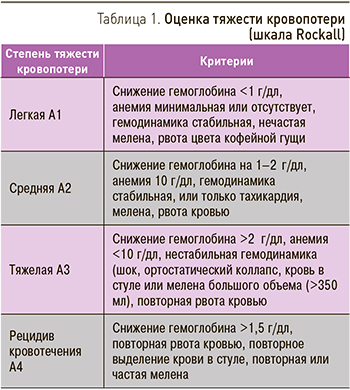
Буквенно-цифровая символика степени тяжести кровопотери
Несмотря на то что исторически шкала Rockall (табл. 1) была направлена для оценки степени кровопотери и стратификации риска смертности при кровотечениях из верхних отделов желудочно-кишечного тракта, наш опыт позволяет рекомендовать ее использование и в случаях кровопотери из тонкой и толстой кишки.

Символы степени кровопотери:
А0 – нет кровотечения;
А1 – легкая степень кровотечения;
А2 – средняя степень тяжести кровопотери;
А3 – тяжелая степень кровопотери;
А4 – рецидив кровотечения.
Буквенно-цифровая символика степени риска тромбоэмболических осложнений
 Весьма частой клинической ситуацией является синхронное развитие эрозивно-язвенных повреждений желудочно-кишечного тракта с сохраненным высоким риском тромбоэмболических осложнений.
Весьма частой клинической ситуацией является синхронное развитие эрозивно-язвенных повреждений желудочно-кишечного тракта с сохраненным высоким риском тромбоэмболических осложнений.
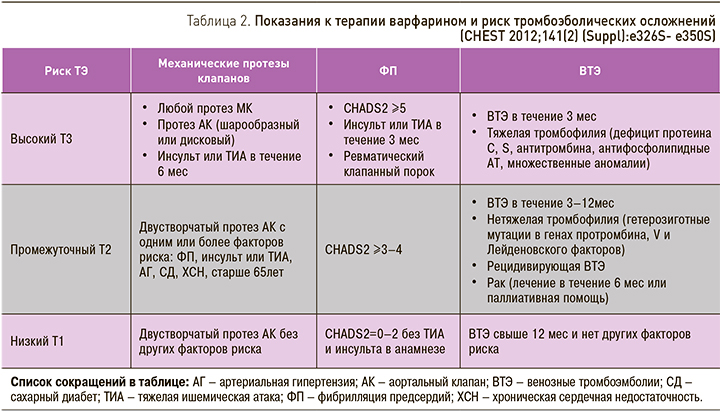
Для оценки последних следует использовать известную шкалу, предложенную в журнале CHEST (табл. 2) [17], где риск имеет обозначения:
Т1 – низкий;
Т2 – промежуточный;
Т3 – высокий.
Таким образом, расширенная (уточняющая) шкала выглядит так.
Например:
EIА0Т3 – изменения в пищеводе неэрозивные, без кровопотери, с высоким риском тромбоэмболических осложнений,
или
CIIaА3Т1 – эрозивно-язвенные изменения в толстой кишке, осложненные продолжающимся кровотечением с тяжелой степенью кровопотери и низким риском тромбоэмболических осложнений,
или
GIIaА2Т2 – эрозивно-язвенные изменения в желудке, осложненные продолжающимся кровотечением со средней степенью тяжести кровопотери и промежуточным риском тромбоэмболических осложнений [18, 19].
Особенно сложными в плане принятия решения являются случаи с кажущимся одинаковым уровнем риска развития кровотечений и тромбоэмболических осложнений, когда необходимо принято верное решение и продолжить лечение, показания к которому выше. В связи с этим необходимо проводить стратификацию рисков [20, 21].
Стратификация рисков
Для стратификации рисков наиболее удобными являются шкалы HAS-BLED риска развития кровотечения и CHA2DS2-VASc риска тромбоэмболических осложнений, которые являются расширенным вариантом шкалы CHADS2 [22].
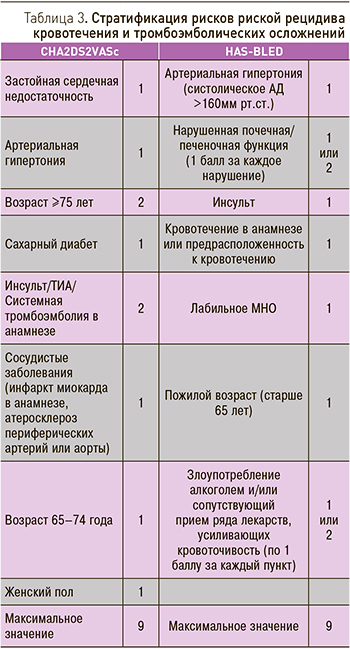 Обе шкалы подробно представленные в табл. 3, имеют максимальное значение показателей 9 баллов. Таким образом, простое сложение балльных величин, без применения сложных математических формул, позволяет определить зону наибольшего риска с целью его преимущественной коррекции [23, 24].
Обе шкалы подробно представленные в табл. 3, имеют максимальное значение показателей 9 баллов. Таким образом, простое сложение балльных величин, без применения сложных математических формул, позволяет определить зону наибольшего риска с целью его преимущественной коррекции [23, 24].
Клинический пример
В клинику поступила пациентка А., 76 лет, с жалобами на слабость, бледность кожных покровов, сердцебиения.
Из анамнеза:
Последняя госпитализация 3 мес назад в связи с учащением приступов фибриляции предсердий.
Сопутствующие заболевания:
- ИБС,
- стенокардия напряжения II ФК,
- атеросклероз коронарных артерий (стенозы ПМЖВ ЛКА 75%, ПЖА 80%, ПКА 85%),
- прямое стентирование передней межжелудочковой ветви и правой коронарной артерии (учитывая высокий риск кровотечения, необходимость принимать постоянную антикоагулянтную терапию – установлены стенты без лекарственного покрытия),
- стеноз левого атриовентрикулярного отверстия среднетяжелой степени,
- гипертоническая болезнь II стадии, степень 3, риск 4,
- нарушение ритма сердца: персистирующая форма фибрилляции предсердий. ХСН I. ФК II,
- многоузловой токсический зоб,
- тиреотоксикоз в стадии медикаментозной компенсации.
Выписана с рекомендациями приема варфарина 2,5 мг по 3 табл. в день. Дополнительно плавикс 75 мг утром и кардиомагнил 75 мг вечером (3 нед).
Настоящее ухудшение 3 дня назад, когда обратила внимание на слабость, черный оформленный стул.
Объективно: нормального телосложения, правильного питания, кожные покровы бледные, сухие, АД 120/80, пульс 92, ЧД 18 мин. Аускультативно: дыхание проводится во всех отделах, хрипов нет, тоны сердца ясные ритмичные. Живот мягкий, безболезненный во всех отделах. Мочеиспускание в норме. Стул регулярный.
 Диагноз при поступлении: состоявшееся желудочно-кишечное кровотечения на фоне тройной антитромботической терапии (варфарин с повышением; кардиомагнил 75 мг/сут, плавикс 75 мг/сут), анемии среднетяжелой степени. Проводился диагностический поиск источника кровотечения. По результатам ЭГДС выявлена острая язва с признаками перенесенного, остановившегося на момент осмотра кровотечения. При колоноскопии и видеокапсульной эндоскопии источников кровотечения не выявлено.
Диагноз при поступлении: состоявшееся желудочно-кишечное кровотечения на фоне тройной антитромботической терапии (варфарин с повышением; кардиомагнил 75 мг/сут, плавикс 75 мг/сут), анемии среднетяжелой степени. Проводился диагностический поиск источника кровотечения. По результатам ЭГДС выявлена острая язва с признаками перенесенного, остановившегося на момент осмотра кровотечения. При колоноскопии и видеокапсульной эндоскопии источников кровотечения не выявлено.
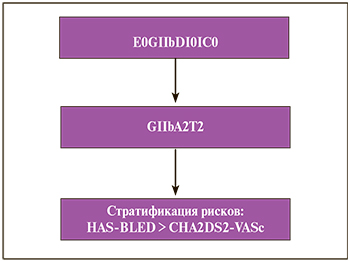
Согласно Общей шкале Русской классификации заключение представлено следующей формулой: E0GIIbDI0IC0.
Клинико-лабораторные показатели: общий анализ крови: эритроциты 106/мкл 3,16, гемоглобин, г/дл 18,1; МНО до 5,0.
Учитывая данные анамнеза и клинико-лабораторные показатели, Расширенная шкала Русской классификации представлена следующим образом: GIIbА2Т2.
Возможности антиаритмической терапии ограничены в связи с перенесенным инфарктом миокарда, наличием гипертрофии миокарда левого желудочка и перенесенным тиреотоксикозом (терапия тиреостатиками проводится по настоящее время): невозможность назначения антиаритмических препаратов IC класса, соталекса, кордарона. В настоящее время продолжена терапия бета-блокаторами.
Проведенная стратификация рисков, несмотря на эндоскопически достаточно благополучную картину, показала более высокий риск рецидива кровотечения из желудочно-кишечного тракта по сравнению с риском тромбоэмболических осложнений: HAS-BLED > CHA2DS2-VASc.
Таким образом, учитывая преимущественно более высокий риск рецидива кровотечения на фоне комбинированной антитромботической терапии, сроки после стентирования коронарных артерий и проведения процедуры с использованием голометаллических стентов от возобновления терапии плавиксом, а также варфарином было решено воздержаться, продолжена терапия кардиомагнилом в дозе 75 мг/сут.
При выписке: жалоб не предъявляет. Признаков рецидива желудочно-кишечного кровотечения нет. Кожные покровы физиологической окраски и влажности. Температура тела нормальная. Отеков нет. Над легкими дыхание везикулярное, проводится во все отделы, хрипы не выслушиваются. ЧДД 16 в мин. Тоны сердца приглушены, ритм правильный. ЧСС 56 в мин. АД 125/70 мм рт.ст. Живот мягкий, безболезненный при глубокой пальпации. Печень у края реберной дуги. ЭКГ 15.03: синусовая брадикардия, ЧСС 46 уд/мин. ЭКГ без выраженной динамики. ТЭК 1 этаж, реакция физиологическая. АД 130/70–135/60, ЧСС 64–73–61 уд. в мин. Без жалоб. ТЭК 500 м, реакция физиологическая. Без жалоб.
В удовлетворительном состоянии пациентка выписана для продолжения амбулаторного лечения.
Таким образом, общий вид каскада в представленном клиническом случае, согласно предлагаемой Московской классификации, выглядит следующим образом:
Выводы
- Разработанная формула общей шкалы позволяет специалисту оценить уровень обследования пациента, а также локализацию и степень поражения слизистой при подозрении на наличие желудочно-кишечного кровотечения на фоне применения НПВС и/или антитромботических препаратов.
- Разработанная формула расширенной (уточняющей) шкалы позволяет характеризовать наиболее тяжелое повреждение желудочно-кишечного тракта с учетом тяжести кровопотери и риска тромбоэмболических осложнений.
- Соотношение результатов оценки состояния пациента с помощью шкал HAS-BLED и CHA2DS2-VASc в рамках разработанной Русской классификации позволяет провести стратификацию рисков рецидива кровотечения и тромбоэмболических осложнений.
- Применение Московской классификации позволяет с высокой степенью эргономичности перейти к клиническим рекомендациям как руководству для определения дальнейшей тактики ведения пациентов с тяжелой коморбидной патологией.
ЗАКЛЮЧЕНИЕ
Предлагаемая Московская классификация повреждений слизистой пищеварительного тракта нестероидными противовоспалительными и препаратами для понижения свертывания крови (Л.Б. Лазебник, Г.В. Белова) является свидетельством медицины «Трех П» – персонифицированной, профилактической и предиктивной, так как за простой формулой стоит учет значительного числа гендерных, анамнестических, функциональных и клинико-лабораторных показателей.
Применение Московской классификации относится к системе поддержки принятии решения в отношении тактики ведения крайне сложной категории пациентов с тяжелой коморбидной патологией.



