ВВЕДЕНИЕ
Обострение хронических заболеваний, требующее стационарного лечения, как правило, сопровождается наличием тяжелого полигиповитаминоза. В предыдущей работе [1] были представлены результаты систематического анализа всей имеющейся научной литературы по использованию витаминов в условиях многопрофильного стационара. Показана насущная необходимость использования дотаций многих витаминов для уменьшения продолжительности пребывания в госпитале, лечения опухолевых заболеваний, профилактики и лечения сепсиса, ускорения заживления ран, снижения сердечно-сосудистого риска и др.
Важной областью использования отдельных витаминов и витаминно-минеральных комплексов (ВМК) в условиях стационара является терапия опухолевых заболеваний (ОЗ). При этом ВМК целесообразно использовать:
- для долговременной профилактики широкой группы ОЗ;
- для компенсации низкой обеспеченности витаминами пациентов с ОЗ;
- для повышения эффективности стандартной противоопухолевой терапии;
- в качестве адъювантной терапии ОЗ для снижения побочных эффектов химиотерапии.
Следует подчеркнуть особую взаимосвязь между обеспеченностью определенными витаминами и риском ОЗ. Например, по запросу «vitamin OR vitamins» в базе данных биомедицинских публикаций PUBMED было найдено 373 734 публикаций (осень 2017 г.). Из этого количества почти треть публикаций касалась в той или иной форме вопроса о взаимосвязи между обеспеченностью витаминами и профилактикой/терапией ОЗ: например, запрос «(vitamin OR vitamins) AND (chemotherapy OR cancer OR tumor OR antitumor OR anti-tumor)» в PUBMED дал 115 517 публикаций. Метаанализов по данному комплексу вопросов также немало – более 650 публикаций в PUBMED.
В настоящей работе представлены результаты систематического анализа доказательных исследований, в которых были изучены эффекты отдельных витаминов и ВМК у взрослых пациентов с ОЗ. Статистически значимое снижение смертности, уменьшение тяжести заболевания и побочных эффектов химиотерапии – вот только некоторые из позитивных эффектов регулярных дотаций витаминов, которые повышают эффективность и безопасность лечения ОЗ. Приводимые ниже результаты доказательных исследований сгруппированы в соответствии с изученными витаминами.
ВИТАМИН А
Витамин А (ретинол) относится к жирорастворимым витаминам с гормоноподобным действием. Ретиноиды, активные метаболиты витамина, связываются со специальными молекулами – рецепторами (ретиноид-рецепторами RARA, RARB, RARC и ретиноид-Х-рецепторами RXRA, RXRB, RXRC) и, активируя их, регулируют сложные взаимодействия многочисленных генов, принимающих участие в процессах роста и дифференциации клеток [2], поддержании зрения, иммунитета, метаболизма костей, кроветворения, структуры мышц и кожи, профилактике образования желчных камней, нефролитиазиса, анемии и др. [3]. Поэтому дефицит витамина А способствует нарушению процессов роста клеток и возникновению неконтролируемой их пролиферации, особенно клеток переходного эпителия (губы, шейка матки и т.д.).
Метаанализ 15 исследований (n=12 136) показал, что более высокое потребление витамина А и его уровни в крови ассоциированы со снижением риска рака шейки матки. Так, квартиль самого высокого потребления витамин А соответствовал снижению риска заболевания на 41% (отношение шансов [ОШ] 0,59, 95% доверительный интервал [ДИ] 0,49–0,72), а квартиль самых высоких уровней витамина А в крови – его снижению на 40% (ОШ 0,60, 95% ДИ 0,41–0,89). Снижение риска рака шейки матки также было подтверждено для более высокого потребления ретинола (ОШ 0,80, 95% ДИ 0,64–1,00), каротина (ОШ 0,51, 95% ДИ 0,35–0,73) и других каротиноидов (ОШ 0,60, 95% ДИ 0,43–0,84) [4].
Метаанализ 19 клинических исследований (n=10 261) показал, что более высокое диетарное потребление витамина А и α-каротина снижает риск развития рака легких в среднем на 14% (ОШ 0,86, 95% ДИ 0,74–0,99). Более высокое потребление диетарного β-каротина также способствует снижению риск рака легких (ОШ 0,77, 95% ДИ 0,68–0,87) [5].
Заметим, что в конце прошлого века был установлен так называемый β-каротиновый парадокс: физиологические дозы β-каротина оказывали защитный эффект при раке бронхов и легких у курильщиков, его высокие дозы приводили к возрастанию встречаемости заболевания. Достаточно убедительно установлено, что физиологическое потребление β-каротина значительно снижает риск первичных опухолей головы, шеи, легких и пищевода, лейко- и эритроплакий, диспластических и метапластических изменений клеток [6]. Показана роль каротина в подавлении экспрессии рецепторов к эпидермальному фактору роста, защите ДНК от повреждений, подавлении пролиферации клеток.
Четырехлетнее плацебо-контролируемое двойное слепое исследование у 18 000 человек продемонстрировало, что длительное применение β-каротина в высоких дозах (30 мг/сут) в сочетании с высокими дозами витамина А (ретинол, 25 000 МЕ) несколько увеличивает риск смерти от рака легких у злостных курильщиков (потребление сигарет ≥1 пачки в день на протяжении до 20 лет) [7]. Причинным канцерогеном в этом случае считают образующиеся сложные соединения свободной фракции β-каротина с продуктами сгорания табачного дыма, асбеста [8].
ВИТАМИНЫ ГРУППЫ В
Практически все витамины группы В проявляют противоопухолевые эффекты. Например, витамин B12, тиамин, рибофлавин, фолиевая кислота играют защитную роль против плоскоклеточного рака шейки матки [9]. При сниженных уровнях витамина B12 в сыворотке крови у женщин в постменопаузе риск развития рака молочной железы (РМЖ) достоверно повышается [10]. Адъювантная терапия витаминами группы В снижает тяжесть токсических осложнений при проведении химиотерапии у пациентов с немелкоклеточным раком легкого препаратом пеметрексед за счет уменьшения гипергомоцистеинемии и уровней метилмалоната в крови [11].
РИБОФЛАВИН
Рибофлавин необходим для биосинтеза флавинаденинмоно- и флавинадениндинуклеотида – кофакторов нескольких десятков ферментов энергетического метаболизма. Кроме того, рибофлавинзависимый фермент йодотирозиндейодиназа (ген IYD) высвобождает йодид из моно- и дийодтирозина, образующихся в процессе биосинтеза тиреоидных гормонов, что делает витамин В2 принципиально необходимым для поддержки щитовидной железы. При недостатке рибофлавина уменьшается активность ферментов, возникает окислительный стресс и нарушения процесса роста клеток [3], что способствует развитию ОЗ.
Более высокие уровни витамина В6 и рибофлавина в плазме крови соответствуют снижению риска развития РМЖ, особенно у женщин в пременопаузе. После медианного наблюдения когорты женщин (n=6071) в течение 15 лет было выявлено 276 случаев РМЖ. Более высокие уровни рибофлавина в плазме крови были ассоциированы со значительно меньшим риском рака (ОШ 0,45, 95% ДИ 0,21–0,94) при сравнении самого высокого квартиля (1,5–4,5 нг/мл) с самым низким квартилем (9–122 нг/мл, р=0,021) [12].
Метаанализ 8 клинических исследований (4 когортных, 4 «случай–контроль», n=7750) подтвердил, что более высокое потребление витамина B2 снижает риск колоректального рака (КРР) в среднем на 17% (отношение рисков [ОР] 0,83, 95% ДИ 0,75–0,91) [13]. Результаты другого метаанализа, цитируемого в конце настоящей статьи, также подтверждают эффективность рибофлавина в составе ВМК для профилактики КРР [14].

ВИТАМИН В6
Витамины В6 (пиридоксин), В9 (фолаты) и В12 (цианкобаламин) являются взаимными синергистами, необходимыми для обезвреживания гомоцистеина (что важно для снижения уровня окислительного стресса) и метилирования ДНК (что важно для поддержания процессов физиологического деления клеток).
У пациентов с гепатоцеллюлярной карциномой, которые недавно подверглись резекции опухоли (n=33), дотации витамина В6 способствовали повышению антиоксидантного ресурса плазмы посредством снижения уровней гомоцистеина. Пациентам в рандомизированном порядке назначали плацебо (n=16) либо витамин В6 в дозе 50 мг/сут (n=17) для приема в течение 12 нед. Уровни гомоцистеина плазмы при приеме витамина В6 были значительно снижены к концу исследования, в то время как уровень антиоксидантного ресурса, измеренный в тролоксовом эквиваленте (TEAC), был значительно выше [15].
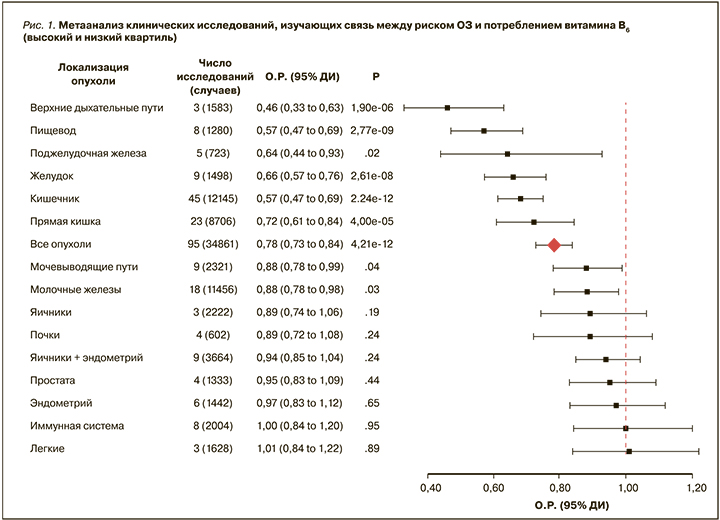
Адекватная обеспеченность витамином B6 снижает риск ОЗ. Систематический обзор и метаанализ 121 клинического исследования (n=1 924 506, из них 96 436 пациентов) включали 19 разновидностей опухолей. Более высокое диетарное потребление витамина B6 статистически значимо ассоциировалось с более низким риском всех видов ОЗ (ОР 0,78, 95% ДИ 0,73–0,84; рис. 1) [16].
Метаанализ показал статистически значимый дозозависимый профилактический эффект витамина B6 на риск развития опухолей (6% снижение риска на каждый 1 мг/сут потребления витамина В6; ОР 0,94, 95% ДИ 0,92–0,96) [16].
Также подтверждена ассоциация между более высокими уровнями пиридоксаль-5’-фосфата (ПФ) в периферической крови и сниженным риском всех видов рака (ОР 0,66, 95% ДИ 0,58–0,76, метаанализ 25 исследований, n=20 858) [16]. Данные типа «доза–отклик» для уровней ПФ в крови были доступны в 21 исследовании (n=9310). Метаанализ продемонстрировал статистически значимую взаимосвязь между уровнями ПФ в крови и всеми видами ОЗ: риск снижался на 30% на каждые 100 нмоль/л уровня ПФ в крови (ОШ 0,70, 95% ДИ 0,65–0,76). Особенно выражены были ассоциации для КРР (ОР 0,52, 95% ДИ 0,43–0,64) и рака поджелудочной железы (ОР 0,37, 95% ДИ 0,19–0,71).
Ассоциация между сниженной обеспеченностью витамином B6 и риском КРР была подтверждена в проспективном популяционном исследовании (n=1803, 613 случаев рака и 1190 контролей), в котором измерялись 3 биомаркера обеспеченности витамином B6: уровень ПФ, отношение 3-гидроксикинуренин / ксантуреновые кислоты и отношение пиридоксиновая кислота / ПФ + пиридоксаль. Последние два показателя отражают связанные с витамином B6 окислительный стресс и воспаление. Более высокие концентрации ПФ в плазме крови (достаточность ПФ по сравнению с дефицитом) были связаны с уменьшенным риском рака (ОР 0,55, 95% ДИ 0,37–0,81). Более высокие значения отношения 3-гидроксикинуренин / ксантуреновые кислоты (ОШ 1,48, 95% ДИ 1,08–2,02) и отношения пиридоксиновая кислота / ПФ + пиридоксаль (ОШ 1,50, 95% ДИ 1,10–2,04) были ассоциированы с повышенным риском рака [17].
В метаанализе 13 исследований риска КРР более высокие уровни потребления витамина B6 соответствовали снижению риска на 10% (ОР 0,90, 95% ДИ 0,75–1,07), а более высокие уровни ПФ в крови – на 48% (ОШ 0,52, 95% ДИ 0,38–0,71). Риск развития КРР снижался на 49% при повышении уровня ПФ в крови на каждые 100 пмоль/мл (ОР 0,51, 95% ДИ 0,38–0,69) [18].
Более высокие уровни витамина В6 и рибофлавина в плазме крови соответствуют снижению риска развития РМЖ, особенно у женщин до менопаузы. При наблюдении за когортой женщин (n=6071) в течение 15 лет было выявлено 276 случаев РМЖ. Увеличение уровней витамина В6 в плазме крови (в форме ПФ) на каждые 5 нг/мл было ассоциировано с уменьшением риска РМЖ на 22% (ОР 0,78, 95% ДИ 0,63–0,96) [12].
Метаанализ показал, что риск РМЖ для женщин в самом высоком квартиле уровней ПФ был на 20% ниже, чем в самом нижнем квартиле (ОР 0,80, 95% ДИ 0,66–0,98, р=0,03). Риск РМЖ снизился на 23% (ОР 0,77, 95% ДИ 0,69–0,86, р <0,001) на каждые 100 мкмоль/мл концентрации ПФ в крови, особенно среди женщин в постменопаузе [19].
ВИТАМИН В12
Дефицит витамина B12 наиболее часто встречается у пациентов в пожилом и старческом возрасте и затрагивает не менее 10–15% людей старше 60 лет [20]. Витамин В12 принципиально необходим для фолатного метаболизма и важен для обезвреживания гомоцистеина, метилирования ДНК, биосинтеза нуклеотидов, профилактики анемических состояний. Для гиповитаминоза В12 типично возникновение мегалобластной анемии, сопровождающейся появлением в крови и костном мозге ретикулоцитов, гемолизом, лейкопенией и тромбоцитопенией, дисфункцией щитовидной железы.
Последствия дефицита витамина B12 весьма разнообразны. Во-первых, при дефиците кофермента 5-дезоксиаденозилкобаламина накапливаются токсичные метилмалоновая и пропионовая кислоты, которые повреждают миелиновые оболочки, нейроны и провоцируют болевой синдром. Во-вторых, недостаток метилкобаламина нарушает синтез нуклеиновых кислот и процесс метилирования ДНК, что приводит к расстройству образования и созревания эритроцитов, нарушению функции транспорта кислорода и, следовательно, к развитию анемического синдрома. Кроме того, сниженные уровни витамина В12 в сыворотке крови связаны с дисфункцией щитовидной железы [21]. В-третьих, нарушения фолатного метаболизма, процессов обезвреживания гомоцистеина, метилирования ДНК, биосинтеза нуклеотидов, возникающие на фоне дефицита витамина В12, способствуют канцерогенезу. Результаты клинических исследований показывают, что взаимосвязь между витамином В12 и риском ОЗ опосредуется такими факторами, как потребление красного мяса, алкоголя и дефициты других витаминов группы В [22].
Одним из наиболее важных проявлений дефицита витаминов В12, В6 и фолатов считается повышение уровня гомоцистеина, которое является доказанным фактором риска цереброваскулярной патологии и коморбидно ОЗ. Например, средний уровень общего гомоцистеина у пациентов с карциномой гортани (n=25) составил 2,84±1,62 против 0,99±0,24 мг/л (p <0,001) в контрольной группе (n=80) [23].
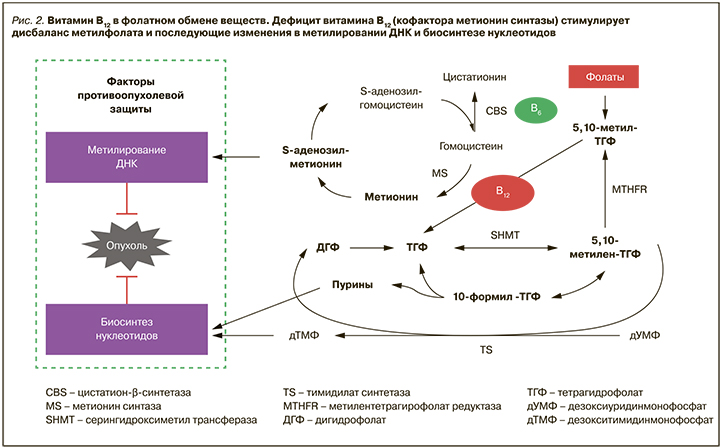
Витамин В12 является принципиально важным кофактором биосинтеза молекул – источников метильных групп (например, S-аденозилметионина) для метилирования ДНК и способствует переработке метилфолата в процессе биосинтеза нуклеотидов. Реметилирование гомоцистеина в метионин, катализируемое B12-зависимым ферментом метионинсинтазой, играет важную роль в метаболизме метильной группы и метионина. Получающийся из гомоцистеина метионин преобразуется в S-аденозилметионин, который и является источником метильной группы для реакций метилирования ДНК, РНК, липидов, белков и других молекул (рис. 2) [24].
Показано, что кобаламин потенцирует противоопухолевое действие химиотерапевтического препарата винбластин посредством снижения экспрессии гена MDR-1 в опухолевой линии клеток HepG2. P-гликопротеин, синтезируемый из гена MDR-1 (ген «множественной лекарственной устойчивости – 1»), является одним из основных факторов защиты клеток опухолей от противораковых препаратов. Добавление кобаламина в клетки привело к увеличению активности метионинсинтазы и значительному снижению экспрессии гена MDR-1. Иными словами, витамин В12 увеличил чувствительность опухолевых клеток к химиотерапии винбластином. Кроме того, кобаламин повышал чувствительность клеток к винбластину и предотвращал метотрексат-индуцированное повышение экспрессии гена MDR-1. В результате применения комбинации «винбластин + витамин В12» гибель опухолевых клеток возрастала [25].
Показано, что комбинация витаминов В1, В6, В12 (в виде тиамина дисульфида, пиридоксина гидрохлорида и цианкобаламина в составе препарата Нейробион) в дозе 110 мг/(кг×сут) способствует сдерживанию роста опухоли. При ее субхроническом внутрижелудочном введении животным-опухоленосителям (мыши CBA x C57Bl/6j) в течение 3 нед наблюдалась устойчивая тенденция к торможению роста карциномы легких Льюис (КЛЛ) в среднем на 10–20%, но без влияния на процессы метастазирования. Анализ динамики роста КЛЛ у контрольных и опытных животных показал, что умеренное торможение роста опухоли отмечалось уже через 3 дня от начала эксперимента, а к моменту его окончания различие объемов опухолей в опытной и контрольной группах становилось практически достоверным (р=0,059 по тесту критерию Данна) [26].
Метаанализ эпидемиологических исследований типа «случай–контроль» показал значимое снижение риска ОЗ при более высоких уровнях витамина B12 в сыворотке (ОР 0,74, 95% ДИ 0,56–0,98, р=0,04); для проспективных исследований такой зависимости не было установлено. В частности, метаанализ подтвердил, что более высокие уровни витамина B12 в сыворотке достоверно ассоциированы со сниженным риском РМЖ (рис. 3) [19].
Метаанализ 17 исследований (n=10 601) указал на дозозависимую ассоциацию между потреблением витамина B12 и риском развития КРР: прирост ежесуточного потребления витамина на каждые 4,5 мкг/сут соответствовал снижению риска заболевания на 4% (ОР 0,96, 95% ДИ 0,93–1,00, р <0,001) [27].

Показана перспективность использования препаратов витамина В12 в качестве адъювантной терапии у пациентов с ОЗ, получающих химиотерапию. Например, у больных, страдающих раком прямой кишки (n=37), проводилось лечение пеметрекседом (500 мг/сут) за 3 нед до операции, что существенно снижало уровни фолатов и В12 в биоптатах опухолевой ткани и прилегающей слизистой оболочки. Адъювантная терапия фолиевой кислотой и витамином B12 перорально не приводила к каким-либо нежелательным эффектам и позволяла компенсировать развивающиеся у пациентов глубокие дефициты витамина В12 и фолатов [28]. Препараты витамина В12 могут быть весьма эффективны и безопасны для компенсации его дефицита после резекции желудка. Заметим, что мальабсорбция витамина B12 происходит и после лучевой терапии гинекологических опухолей (вследствие возникающей при этом энтеропатии) [29].
ВИТАМИН С
Изучение противоопухолевых свойств витамина С было начато в 1930-х гг. Несмотря на неоднократные сообщения о селективной токсичности в отношении злокачественных опухолей, обусловленной высокодозной терапией витамином С в экспериментах in vitro и in vivo, вопрос о точном молекулярном механизме противоопухолевого действия витамина остается открытым. При некоторых типах опухолевых клеток (например, клеток с мутациями в генах KRAS и BRAF) апоптоз может быть вызван окисленной формой витамина С, дегидроаскорбатом, ингибирующим всасывание глюкозы посредством специальных белков-транспортеров внутрь опухолевых клеток [30].
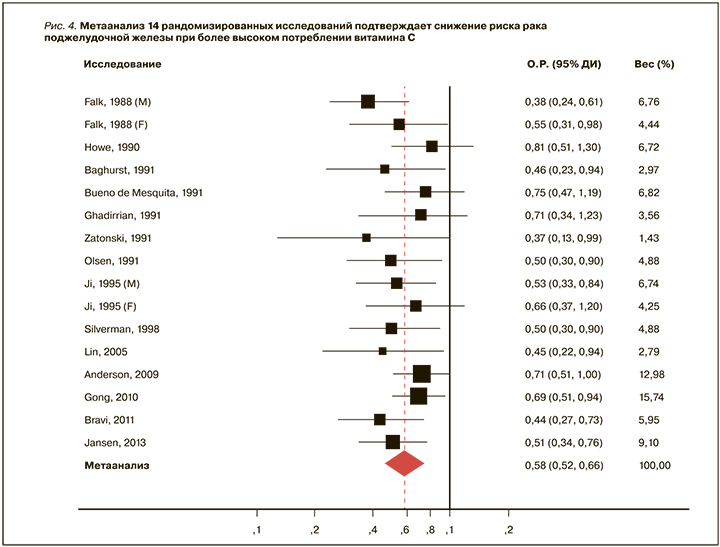
Метаанализ 20 клинических исследований (n=5000) подтвердил, что более высокое потребление витамина С снижает риск развития рака поджелудочной железы. При сравнении самого высокого квартиля потребления витамина С с самым низким квартилем риск достоверно снижался при анализе данных рандомизированных (ОШ 0,58, 95% ДИ 0,52–0,66; рис. 4) и когортных исследований (ОШ 0,93, 95% ДИ 0,78–1,11) [31].
Метаанализ 20 исследований (3955 случаев рака, контроль 7063 участников) показал, что более высокое потребление витамина С ассоциировано со сниженным риском развития рака пищевода (ОР 0,58, 95% ДИ 0,49–0,68). С увеличением потребления диетического витамина С на каждые 50 мг/сут риск развития рака пищевода снижался на 13% (ОШ 0,87, 95% ДИ 0,80–0,93, p=0,0002) [32]. Дотации витамина С внутривенно (10–30 г/сут аскорбата натрия до достижения концентрации аскорбат-аниона в плазме ≥3 мг/ дл) с последующей поддерживающей пероральной дозой (1000–5000 мг/сут) целесообразно включать в протоколы лечения ОЗ заболеваний [33].
Метаанализ 10 исследований (n=17 696) подтвердил, что применение витамина С у пациенток с РМЖ ассоциировано с уменьшением смертности на 15% (ОР 0,85, 95% ДИ 0,74–0,99). Увеличение потребления витамина С на каждые 100 мг/сут соответствовало снижению смертности на 22% (ОР 0,78, 95% ДИ 0,64–0,94) [34].
Эффективность химиотерапии весьма ограничена ее многочисленными побочными эффектами. Более высокая обеспеченность организма витамином С способствует повышению эффективности химиотерапевтических агентов, причем без повышения их токсичности для нормальных, неопухолевых клеток. В частности, витамин С в синергизме с цисплатиной индуцирует апоптоз клеток рака шейки матки посредством регуляции белка р53 в клетках линии SiHa. Поэтому при использовании витамина С возможно снижение дозы цисплатины, необходимой для индуцирования гибели раковых клеток [35].
ВИТАМИН Е
Витамин Е (α-токоферол) является антиоксидантом, сдерживающим рост опухолевых клеток. В частности, витамин Е стимулирует апоптоз линии клеток EC109 (клетки рака пищевода) посредством модуляции сигнальных путей PI3K/AKT. Добавление витамина Е (25 мкМ в течение 12–48 ч) к клеткам EC109 в культуре приводило к дозозависимому снижению уровней фосфорилированной киназы AKT, таргетного белка рапамицина и каспазы-9. Апоптоз, индуцированный витамином Е, усиливался при ингибировании AKT и mTOR посредством специфических ингибиторов этих белков [36, 37].
Метаанализ указал на дозозависимую ассоциацию между более высоким потреблением витамина Е и снижением риска развития рака мочевого пузыря (ОР 0,80, 95% ДИ 0,68–0,94, р=0,01). Также установлена дозозависимая ассоциация между риском заболевания и уровнями α-токоферола в крови: при увеличении уровня на каждый 1 мг/дл риск снижается на 18% (ОР 0,82, 95% ДИ 0,53–1,10) [38].
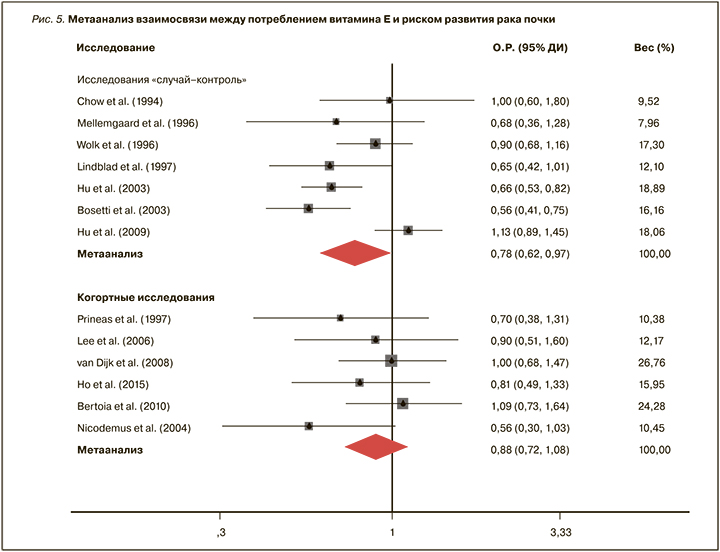
Метаанализ 13 исследований (7 рандомизированных и 6 когортных, 6944 больных и 465 275 контролей) подтвердил, что более высокое потребление витамина Е ассоциировано с меньшим риском развития рака почки. По сравнению с квартилем с самым низким уровнем витамина квартилю с самым высоким его потреблением соответствовало снижение риска на 19% (ОР 0,81, 95% ДИ 0,69–0,94; рис. 5) [39].
Метаанализ 11 исследований типа «случай–контроль» (n=6431) подтвердил, что риск КРР ассоциирован с более низкой концентрацией витамина Е в сыворотке по сравнению со здоровыми добровольцами (-2,99 мкмоль/л, 95% ДИ -4,40–1,59). Причем уровни витамина Е в сыворотке при КРР были ниже у европеоидов, чем у монголоидов [40].
Более высокое потребление витамина Е оказывает защитное действие против рака легких: данная ассоциация была подтверждена в метаанализе 11 исследований (n=435 532, 4164 больных). Риск рака легких для самого высокого квартиля ежесуточного потребления витамина по сравнению с самым низким квартилем снижался на 16% (ОР 0,84, 95% ДИ 0,76–0,93). При увеличении потребления витамина Е на каждые 2 мг/ сут риск рака снижался в среднем на 5% (ОР 0,95, 95% ДИ 0,91–0,99, р=0,0237) [41].
ВИТАМИН D
Витамин D – гормон, необходимый для нормального функционирования многих физиологических систем организма, в частности, для поддержки его противоопухолевой защиты. Противоопухолевый эффект витамина D основан на прямом его влиянии на транскрипцию более 3000 генов, вовлеченных в регуляцию роста, деления и апоптоза клеток. Поддержка витамином D процессов апоптоза чрезвычайно важна для элиминации опухолевых клеток из организма у лиц с высокой восприимчивостью к ОЗ [42] (рис. 6).
Противоопухолевый эффект витамина D3 опосредуется активацией его рецептора (VDR), который экспрессируется во многих клетках иммунной системы: моноцитах, макрофагах, Т- и В-лимфоцитах. Активация транскрипции посредством VDR в этих и других типах клеток оказывает антипролиферативный и иммуномодулирующий эффекты [43].
В литературе представлены очевидные доказательства противоопухолевых свойств витамина D [44]. Например, исследовано влияние водного раствора мицелл с витамином D3 на рост и метастазирование КЛЛ. Воздействие витамина D3 до 13 сут развития КЛЛ сопровождалось нарастающей тенденцией торможения роста опухоли на 25–30% (р=0,016); наблюдались отчетливые признаки подавления процессов метастазирования: число малых метастазов статистически значимо снижалось на 35–40% (р <0,05) [45].
Низкий уровень витамина D в сыворотке крови ассоциирован с меньшей продолжительностью жизни пациентов с миелодиспластическим синдромом и вторичной олигобластной острой миелоидной лейкемией после лечения азацитином (n=58). Еще до начала применения азацитина средние уровни 25(OH)D у больных были крайне низки (13 нг/мл, 95% ДИ 4–25 нг/мл). Оценочная вероятность выживания пациента в течение 2 лет составила 14% в подгруппе пациентов с тяжелым дефицитом витамина D (≤13 нг/мл, n=29) и 40% в подгруппе со средним его дефицитом (>13 нг/мл; n=29, р <0,05). Добавление наномолярных концентраций 25(OH)D к азацитидину приводило к потенцированию активности противоопухолевого препарата. Таким образом, терапия миелоидной лейкемии обязательно должна сопровождаться дотациями витамина D, особенно при лечении азацитидином [46].
Перспективно применение витамина D и на фоне использования других противоопухолевых препаратов для снижения тяжести вызываемых ими побочных эффектов. Например, в эксперименте были продемонстрировано, что совместное использование витамина D и блеомицина ослабляет блеомицин-индуцированный легочный фиброз и накопление воспалительных клеток [47].
Метаанализ 4 рандомизированных исследований дотаций витамина D (n=4333) показал, что продолжительный его прием (2–7 лет, 400–1100 МЕ/сут) значительно снижал общую смертность от всех видов ОЗ (ОР 0,88, 95% ДИ 0,78–0,98) [48].
Количественный метаанализ 5 исследований показал, что потребление витамина D3 по 1000–2000 МЕ/сут снижает частоту заболеваемости КРР. При этом риск КРР снижался пропорционально возрастанию уровней 25(OH)D в крови. Уровни 25(OH)D были разделены на квинтили с медианными значениями 6, 16, 22, 27 и 37 нг/мл; ОР КРР для этих квинтилей составил 1,00, 0,82, 0,66, 0,59 и 0,46 соответственно (p <0,0001). Снижение риска КРР на 50% ассоциировалось с уровнем 25(OH)D >33 нг/мл по сравнению с уровнем <12 нг/мл [49].
Метаанализ 28 наблюдательных исследований подтвердил, что увеличение уровня 25(ОН)D в крови на каждые 10 нмоль/л ассоциируется со снижением риска КРР на 6% (95% ДИ 3–9%) [50]. Систематический обзор проспективных исследований взаимодействий между потреблением витамина D и риском рака толстого кишечника включал 18 исследований, в которых участвовало более 1 млн жителей европейских стран. Самый высокий квартиль потребления витамина D соответствовал снижению риска на 12% (ОР 0,88, 95% ДИ 0,80–0,96); самый высокий квартиль уровней 25(ОН)D – снижению риска на 33% (ОР 0,67, 95% ДИ 0,54–0,80) [51].
ОБ ИСПОЛЬЗОВАНИИ ВМК В ТЕРАПИИ/ПРОФИЛАКТИКЕ ОЗ
Выше были приведены результаты доказательных исследований по отдельным витаминам. К настоящему времени получены также данные об эффективности использования многокомпонентных ВМК в профилактике и терапии ОЗ.
Метаанализ 13 когортных исследований (n=676 141) показал, что более высокие дозы витаминов А, С и Е в составе ВМК сильнее снижают риск рака толстой кишки. В объединенной когорте мужчин и женщин было выявлено 5454 случая рака толстой кишки. Регулярный прием мультивитаминных ВМК был статистически значимо ассоциирован со снижением риска рака на 12% (ОР 0,88, 95% ДИ 0,81–0,96). В частности, риск был ниже при более высоком потреблении витамина А (ОР 0,88, 95% ДИ 0,76–1,02, потребление >4000 против <1000 мкг/сут), витамина С (ОР 0,81, 95% ДИ 0,71–0,92, потребление >600 против <100 мг/сут) и витамина Е (ОР 0,78, 95% ДИ 0,66–0,92, потребление >200 против <6 мг/сут) [52].
Метаанализ 47 когортных исследований подтвердил, что множественное потребление витаминов в составе ВМК снижает заболеваемость КРР. Снижение риск доказано для фолиевой кислоты (ОР 0,88, 95% ДИ 0,81–0,95), витамина D (ОР 0,87, 95% ДИ 0,77–0,99), витамина B6 (ОР 0,88, 95% ДИ 0,79–0,99), витамина B2 (ОР 0,86, 95% ДИ, 0,76–0,97), витамина А (ОР 0,87, 95% ДИ 0,75–1,03), витамина С (ОР 0,92, 95% ДИ 0,80–1,06) и витамина Е (OR 0,94, 95% ДИ 0,82–1,07) [14].
ЗАКЛЮЧЕНИЕ
Представлены результаты систематического анализа доказательных исследований, в которых была изучена эффективность применения витаминов как для профилактики ОЗ, так и в качестве адъювантов противоопухолевой терапии. Крупномасштабные исследования и метаанализы указывают на то, что более высокая обеспеченность организма витаминами достоверно ассоциирована со снижением риска возникновения опухолей, тяжести течения ОЗ и побочных эффектов от химиотерапии, а также с повышением выживаемости онкологических пациентов. Результаты проведенного систематического анализа указывают на необходимость компенсации недостаточности витаминов С, А, В2, В6, В12, D и фолатов как важную здоровьесберегающую технологию повышения эффективности лечения пациентов в онкологическом стационаре.



