Клинические рекомендации (КР) – это документы, которые систематически разрабатываются группой экспертов для оказания помощи врачам и пациентам в принятии решений относительно надлежащей медицинской практики. Важным и основополагающим фактором качества медицинской помощи служит выбор медицинского вмешательства в диагностике, лечении, реабилитации и профилактике, основанный на принципах доказательной медицины и клинико-экономическом анализе. Такой подход подразумевает применение наиболее эффективных клинически и экономически обоснованных медицинских вмешательств по конкретному заболеванию/состоянию или группе заболеваний/состояний.
В современном мире КР – повсеместная данность. Во многих развитых странах они используются не только как практическое пособие для врачей, но и при планировании расходов здравоохранения, экономических расчетах, составлении стандартов лечения и страхового покрытия, разработке инструментов оценки качества медицинской помощи [1]. В России процесс создания КР (в виде протоколов лечения) по оказанию медицинской помощи для практикующих врачей начался почти 20 лет назад, и настоящее время Минздравом России проводится активная работа по законодательной регламентации разработки и внедрения КР в медицинскую практику.
В январе 2019 г. вступили в силу изменения к Федеральному закону от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации»: в соответствии с внесенными правками на основе и с учетом КР формируются критерии оценки качества медицинской помощи по группам заболеваний или состояний, проводится контроль объемов, сроков, качества и условий предоставления медицинской помощи в рамках обязательного медицинского страхования (ОМС), формируется перечень специализированных продуктов лечебного питания для детей-инвалидов, список медицинских изделий, ограничительные перечни (перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения, лекарственных препаратов для медицинского применения, в том числе лекарственных препаратов для медицинского применения, назначаемых по решению врачебных комиссий медицинских организаций и т.д.) [2, 3].
В связи этим Минздравом России было инициировано создание единой методологической регламентации разработки и утверждения КР и ее законодательное закрепление. Предназначением этих документов служит упорядочение разработки и применения КР, в том числе определение требований к их структуре и оформлению [3, 4].
Также в мае 2019 г. вышел приказ № 103н Минздрава «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации», который подробно описывает требования к разработке клинических рекомендаций как к структуре и оформлению, так и к научной обоснованности включаемой информации [4].
Целью авторов в данной статье является краткий обзор истории развития КР, методов их разработки в России и за рубежом, а также анализ утвержденных нормативно-правовых актов, регулирующих разработку КР, относительно мирового опыта.
МИРОВОЙ ОПЫТ РАЗРАБОТКИ И ПРИМЕНЕНИЯ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Причина начала разработки и внедрения КР во всем мире – активное развитие доказательной медицины и появление научных исследований, пересматривающих эффективность «устоявшихся» методов лечения. В то же время количество проводимых исследований увеличивается, что делает весьма затруднительным для отдельного специалиста отслеживание актуальной научной информации. B.S. Alper et al. было установлено, что, для того чтобы специалист владел всей новейшей информацией, имеющей отношение к первичной медико-санитарной помощи, ему необходимо изучать порядка 6000 статей в день [6]. Также при библиометрическом подсчете отдельных нозологий с помощью Medline trend по базе данных PubMed отмечено, что уже в 80-х гг. XX в. врачам для осведомленности обовсех актуальных научных тенденций приходилось бы изучать не менее 3000 статей в год, а это около 10 статей в день лишь по одному заболеванию. При этом количество проводимых исследований продолжает с каждым годом увеличиваться, причем весьма стремительно (рис. 1).
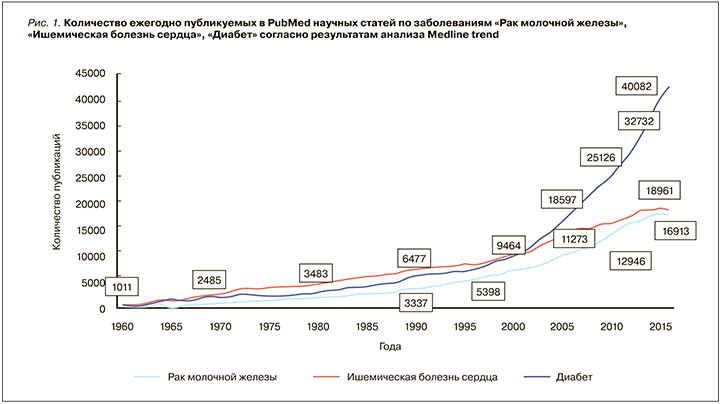
Тем не менее врачам не просто требовалось обобщение всех результатов клинических исследований по выбранному вопросу (эту задачу успешно выполняют систематические обзоры), но и конкретные руководства к действию в определенных ситуациях.
Ключевым этапом развития КР считается издание институтом медицины США (англ. Institute of Medicine, IOM) принципов разработки КР, где было дано определение КР как «систематически разрабатываемых документов для оказания помощи практикующим врачам в принятии решений в конкретных клинических ситуациях», а также создание Агентства по политике в области здравоохранения и научных исследований (AHCPR – англ. Agency for Health Care Policy and Research, в настоящее время – Agency for Healthcare Research and Quality), которому было поручено стать регулирующим органом процесса разработки КР в США [6, 7]. Это было первой широко известной официальной попыткой государственных органов регулирования процесса создания КР.
Тогда же перед медицинским сообществом остро встал вопрос об обязательности КР и их правовом статусе [8, 9]. В США предпринимались попытки сделать КР обязательными, однако были обнаружены некоторые трудности, из-за которых эта практика была приостановлена. В то же время существуют прецеденты использования КР в судебных заседаниях США и Европы как для защиты интересов пациента, доказательства халатности оказанной помощи, так и для защиты врача, подтверждения правомерности его действий в случае неблагоприятного исхода [1, 10, 11].
МЕТОДЫ РАЗРАБОТКИ И ОЦЕНКИ КАЧЕСТВА ДОКАЗАТЕЛЬСТВ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ ЗА РУБЕЖОМ
Для создания качественных КР разработчикам были необходимы единая методика и основные правила, направленные на соблюдение принципов доказательной медицины, прозрачности и объективности разработки. В связи с этим во многих странах были созданы стандарты, включающие основные требования к разработке КР. Например, в 2011 г. Институтом медицины США были созданы стандарты, утверждающие требования к созданию групп разработки, контролю за конфликтом интересов, использованию при разработке систематического обзора, созданию доказательной базы и оценке убедительности рекомендаций, обзору внешних рецензентов и регулярному обновлению [12]. С небольшими отличиями эти правила используются во многих странах, где разрабатываются КР. В качестве примера приводим стандарты, разработанные Американским институтом медицины, в сравнении со стандартами международной сети рекомендаций GIN (табл.) [13].

В настоящее время почти во всем мире используется модель определения силы рекомендаций, созданная рабочей группой GRADE (англ. Grading of Recommendations Assessment, Development and Evaluation). Она начала свою работу в 2000 г. как неофициальный альянс людей, заинтересованных в устранении недостатков систем классификации в области здравоохранения [14]. Рабочая группа GRADE (англ. GRADE working group) разработала подробный подход к классификации качества (или уверенности) доказательств и силы рекомендаций. Схематическое изображение данного процесса приведено на рисунке 2.
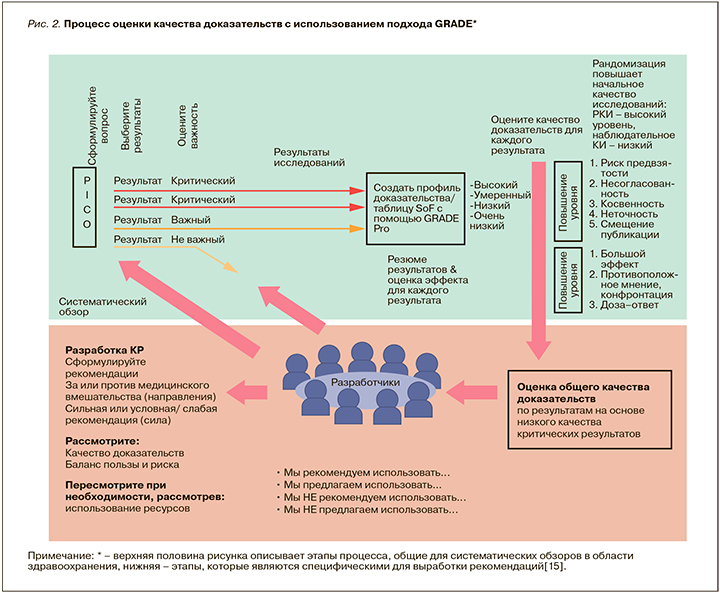
Сначала проводится систематический поиск всех соответствующих теме исследований с учетом их качества, далее проводится оценка результатов (для этого рабочей группой GRADE были созданы таблицы сводки результатов SoF). После этого проводится оценка качества доказательств для каждого результата с учетом факторов, понижающих степень уверенности в пользе вмешательства (риск предвзятости, несогласованность, косвенность, неточность, смещение эффекта) и повышающих этот уровень (величина эффекта, противопоставление мнений, зависимость «доза–ответ»). Затем разработчики руководств рассматривают всю информацию, полученную в результате систематического поиска, и при необходимости переоценивают и принимают окончательное решение о том, какие результаты являются критически важными, а какие менее важными, с учетом рекомендаций, которые они стремятся сформулировать. Общее качество доказательств по всем результатам определяется на основе этой оценки. Исходя из полученных результатов, формируется сильная (жесткая рекомендация или нерекомендация конкретного медицинского вмешательства) или слабая рекомендация (предлагается использовать или не использовать медицинское вмешательство в зависимости от обстоятельств и показаний) [17].
В настоящее время описанным методом оценки доказательств пользуются многие международные организации, включая Всемирную организацию здравоохранения (ВОЗ), Сообщество Кокрейн (англ. Cochrane Community), Канадское агентство по лекарствам и технологиям в здравоохранении (англ. Canadian Agency for Drugs and Technologies in Health – CADTH) и др. [18].
Несмотря на богатый и продолжительный опыт разработки КР в различных зарубежных странах, в мире все еще продолжается поиск и создание оптимальных методов их создания. Например, во Франции в январе 2019 г. был опубликован новый подход к созданию КР, подразумевающий их быстрое (в течение 90 дней) обновление в соответствии научными открытиями более эффективных методов лечения [19]. В то же время в США в настоящее время Агентством по качеству и исследованиям в области здравоохранения (AHQPR) ведется исследование по поиску оптимальных методов координирования КР для лучшего распространения и доступа к научно обоснованным КР, которое должно завершиться в августе 2019 г. [20].
РОССИЙСКИЙ ОПЫТ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ ДО 2019 Г.
После 1997 г. для российского здравоохранения наступил период бурного развития стандартизации. Была утверждена система стандартизации в здравоохранении, которая среди прочего включала следующие нововведения:
- для оценки медицинских технологий внедрили систему доказательств эффективности, безопасности и экономических обоснований, появился термин «клинико-экономический анализ»;
- была разработана серия отраслевых стандартов по правилам стандартизации медицинских технологий и классификаторы медицинских услуг;
- были созданы формулярный комитет, номенклатура работ и услуг, большое количество стандартов медицинской помощи [21].
Первые российские КР назывались «протоколы ведения больных» и для их создания был издан отраслевой стандарт «Протоколы ведения больных. Общие требования» (03.08.1999). Главными причинами создания этих протоколов было установление единых требований к оказываемым медицинским услугам, унификация расчетов стоимости медицинской помощи, а также контроль над показателями медицинской помощи.
Однако в процессе разработки этих документов рабочие группы столкнулись с некоторыми сложностями: отсутствием четкого алгоритма включения медицинской услуги в протокол, сложностями с определением границ между обязательными и рекомендательными медицинскими услугами, недоступностью информационных ресурсов (научной литературы, электронных баз данных и др.), а также трудностями оценки доказательной базы. Новые протоколы подвергались обоснованной критике практикующих врачей, главным образом связанной с недостаточной доказательной базой (ввиду низкого развития отечественной доказательной медицины и недостаточной осведомленностью разработчиков протоколов о результатах клинических исследований в других странах) [22, 23].
В 2014 г. был опубликован национальный стандарт «ГОСТ Р 56034-2014 Клинические рекомендации (протоколы лечения). Общие положения», в котором были изложены требования к процедуре разработки КР (протоколов лечения) и их структуре. Несмотря на представленное в этом ГОСТе определение «протокола» (ключевым термином документа являлся именно «протокол», а не «клинические рекомендации») как «документа, разрабатываемого с целью оптимизации медицинской помощи и поддержки принятия решений врачом, другим медицинским работником и пациентом…», представленные в нем требования не могли способствовать достижению заявленной цели разработки документа. Это объясняется тем, что всю основную информацию по медицинским вмешательствам (медицинским услугам, лекарственным препаратам и т.д.) необходимо было представлять в табличном виде без представления пользователям протоколов сведений о причинах включения медицинского вмешательства в протокол и целей, особенностях их назначения [24]. Необходимо отметить, что, несмотря на обнаруженную малоэффективность этого ГОСТа для разработки КР, он может быть полезен при создании стандартизирующих документов, необходимых для унификации подходов к оказанию медицинской помощи внутри отдельной медицинской организации (клинических протоколов, алгоритмов действий врача и т.д.).
Все разработанные документы (протоколы лечения, КР) до 2015 г. размещались на сайте Федеральной электронной медицинской библиотеки (http://www.femb.ru/), к концу 2015 г. количество размещенных на сайте протоколов насчитывало более 1200 экземпляров. В то же время качество этих документов оставляло желать лучшего: зачастую они не соответствовали принципам доказательной медицины, не содержали полную и необходимую информацию о заболевании, были посвящены лишь отдельным этапам и условиям оказания медицинской помощи, отдельным категориям врачей [25]. Кроме того, в этих рекомендациях не было единообразия по форме, содержанию, а также представлению научных данных. Например, в исследовании Н.И. Журавлевой с соавт. [26] было обнаружено крайне низкое методологическое качество разработанных документов. Большинство врачебных сообществ и ассоциаций предпочитало опираться в своей практике на уровни достоверности доказательств и убедительности рекомендаций, взятых из зарубежных клинических руководств, зачастую не учитывая необходимость их адаптации к условиям России. К основным причинам, не позволяющим напрямую, без адаптации использовать зарубежные руководства, относятся различная доступность медицинских вмешательств и различия в соотношениях пользы и риска их применения для пациентов в разных странах, а это, в свою очередь, обусловлено популяционными различиями между контингентами пациентов, разницей в системах здравоохранения, принципах оказания медицинской помощи, тарификации оказываемых услуг, подходах к подготовке медицинских специалистов [27].
ИЗМЕНЕНИЯ ПОРЯДКА РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ В РОССИИ С 2019 Г.
Так как КР низкого качества могут крайне негативно влиять на эффективность принятий решений в сфере здравоохранения, а высокого качества, наоборот, способствуют повышению качества медицинской помощи [28, 29], Минздравом России было инициировано создание единой методологической регламентации разработки и утверждения КР и ее законодательное закрепление.
В декабре 2018 г. были опубликованы изменения в Федеральный закон от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации», которые заключаются в усилении роли КР в нормативном поле здравоохранения России, а также в закреплении правил их формирования. Согласно этим изменениям медицинская помощь будет осуществляться на основе КР в соответствии с порядками оказания медицинской помощи и с учетом стандартов медицинской помощи. Контроль медицинской помощи будет осуществляться по критериям оценки ее качества, разрабатываемых на основе КР и порядков оказания медицинской помощи.
Также в соответствии с внесенными изменениями Минздрав России получил полномочия по методической регламентации процессов разработки КР, и в начале 2019 г. им были приняты следующие основные документы, регламентирующие разработку КР:
- Приказ Минздрава России от 28.02.2019 № 101н «Критерии формирования перечня заболеваний, состояний (групп заболеваний, состояний), по которым разрабатываются клинические рекомендации» [30]. Он определяет перечень заболеваний, состояний (групп заболеваний, состояний), по которым разрабатываются клинические рекомендации;
- Приказ Минздрава России от 28.02.2019 № 102н «Положение о Научно-практическом совете по вопросам клинических рекомендаций Министерства здравоохранения Российской Федерации». Он устанавливает состав научно-практического совета по вопросам клинических рекомендаций Минздрава [31];
- Приказ Минздрава России от 28.02.2019 № 103н «Порядок и сроки разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации» [4].
Краткое схематическое отображение процесса разработки и утверждения клинических рекомендаций отображено на рисунке 3.

В соответствии с Приказом № 103н, Минздрав России публикует перечень заболеваний, состояний (групп заболеваний, состояний), по которым необходима разработка КР. Такой перечень уже составлен и опубликован на официальном сайте Минздрава России [32]. После его опубликования медицинские профессиональные некоммерческие организации (далее – Ассоциация) уведомляют Минздрав России о начале разработки КР.
Важно отметить, что перечень заболеваний подразумевается не для ограничения количества нозологий, по которым должны разрабатываться КР, а для создания минимального обязательного списка. Ассоциация имеет право разрабатывать КР вне рекомендуемого перечня заболеваний. В процессе создания КР Ассоциация проводит общественные обсуждения проектов КР для достижения согласия по спорным вопросам повышения качества разрабатываемого документа и снижения рисков возникновения ошибок или утверждения заведомо невыполнимых для внедрения в российскую в систему здравоохранения КР. После этого проекты подаются в Минздрав России, который направляет их в экспертную организацию для проверки соответствия требованиям к разработке КР. Разработанные КР вместе с результатами проверки экспертной организации отдаются на рассмотрение научно-практического совета (НПС), созданного уполномоченным федеральным органом исполнительной власти – Минздравом России. По результатам рассмотрения НПС принимает решение об одобрении, отклонении или направлении КР на доработку, после чего возвращает указанные КР в представившую их медицинскую профессиональную некоммерческую организацию с приложением соответствующего решения. Одобренные НПС и утвержденные разрабатывающей профессиональной медицинской ассоциацией проекты КР приобретают статус «национальных» КР – документов, на основании которых с 2022 г. должна организовываться и оказываться медицинская помощь на всей территории России.
Также с 2019 г. появились и требования к содержанию КР: теперь в одном документе должна быть полноценно отражена информация обо всех этапах и направлениях оказания медицинской помощи – диагностике, лечении, реабилитации и профилактике, наблюдении за пациентами и т.д. Рекомендации по применению медицинских вмешательств должны быть оформлены в виде кратких тезисов с указанием, у кого и с какой целью их следует применять. Формирование КР, и в первую очередь таких тезисов, должно базироваться на принципах доказательной медицины. Также утвержден регулярный период обновления КР, составляющий три года. Кроме этого, в КР необходимо включать информацию для пациента, а также критерии оценки качества медицинской помощи, которые в дальнейшем станут инструментом системы контроля медицинской помощи в части экспертизы ее качества [4].
Отдельно стоит сказать о контроле конфликта интересов: в соответствии с законодательством члены рабочих групп по разработке КР и члены НПС, которые могут иметь личную заинтересованность в разработке или утверждении КР, будут отстранены от принятия решений [33].
ЗАКЛЮЧЕНИЕ
Таким образом, проведенный обзор российского и зарубежного опыта создания КР показал сходные исторические пути формирования принципов их разработки. Во многих странах используются стандарты разработки КР, а также существуют государственные организации, поддерживающие обеспечение должного качества этих документов с точки зрения соблюдения принципов доказательной медицины, прозрачности и объективности их подготовки.
В России до 2019 г. процесс разработки КР не регулировался, вследствие чего выпускающиеся профессиональными медицинскими ассоциациями документы были низкого качества. Установленные методы регулирования процесса разработки КР основаны на международном опыте и учитывают состав рабочих групп разработки КР, контроль за конфликтом интересов, оценку доказательной базы, обзор внешних рецензентов и регулярное обновление.
Кроме этого, с 1 января 2019 г. вместе с вступлением в силу поправок к Федеральному закону от 21.11.2011 № 323 «Об основах охраны здоровья граждан в Российской Федерации» в стране появился единый центральный регулирующий орган КР – научно-практический совет Минздрава России.
Необходимо отметить, что законодательно закрепленные на сегодняшний день в России требования к КР соответствуют международным подходам, базирующихся на следовании принципам доказательной медицины
Подготовленные изменения позволят гармонизировать существующие нормативные и рекомендательные документы по вопросам оказания медицинской помощи. КР будут применяться врачом при оказании медицинской помощи пациенту, при этом руководители медицинских организаций должны будут обеспечить условия для их применения в соответствии с порядками оказания медицинской помощи, обязательными для исполнения на территории России и определяющими этапность оказания медицинской помощи и оснащенность медицинских организаций (их структурных подразделений).



