Проблема дисплазии соединительной ткани (ДСТ) имеет большую медицинскую и социальную значимость, обусловленную прежде всего широкой распространенностью недифференцированных ее форм и диспластических фенотипов среди молодого, трудоспособного населения. Учитывая высокую репрезентативность различных разновидностей соединительной ткани в организме, ДСТ характеризуется многообразием, полисистемностью клинико-функциональных проявлений [1]. Одной из наиболее часто встречаемых в терапевтической и ревматологической практике диспластических нозологически обособленных форм является синдром гипермобильности суставов (СГМС). Помимо суставных симптомов, к облигатным клинико-диагностическим составляющим СГМС относятся различные скелетные дисплазии [2, 3, 4].
Соединительнотканная дисплазия зачастую рассматривается в фокусе патологии сердца [5]. Изменения со стороны сердечно-сосудистой системы ‒ клапанный и аритмический синдромы – занимают важное место среди диспластических фенотипов. Это связано не только с их распространенностью, но и с наличием клинически и прогностически значимых патологических форм, риском развития осложнений [6, 7, 8]. Полиморфизм и мультисистемность дисморфогенетических проявлений, ассоциированных в том числе с аномалиями клапанов сердца, связаны с генетически детерминированными дефектами в структуре коллагена и других компонентов соединительной ткани, нарушениями ферментативных и клеточных взаимодействий.
Установление возможной взаимосвязи между костно-мышечными симптомами – облигатной нозологической компонентой СГМС и распространенностью, структурой и особенностями клапанных изменений – представляется при ДСТ клинически и диагностически значимым. Изучение закономерностей патогенеза и общих детерминант различных диспластических синдромов и фенотипов с модификацией факторов риска и разработкой лечебно-профилактических мер повысит возможности превентивного воздействия на формирование и прогрессирование осложнений.
 Цель исследования – оценить распространенность и спектр клапанных проявлений соединительнотканной дисплазии сердца у пациентов с СГМС и их возможную ассоциацию с особенностями ортопедического статуса.
Цель исследования – оценить распространенность и спектр клапанных проявлений соединительнотканной дисплазии сердца у пациентов с СГМС и их возможную ассоциацию с особенностями ортопедического статуса.
МАТЕРИАЛ И МЕТОДЫ
Обследованы 214 пациентов с СГМС (128 мужчин и 86 женщин) в возрасте от 18 до 34 лет (средний возраст 22,8±3,6 лет). Гипермобильный синдром устанавливали по шкале Р. Beighton согласно действующим критериям [1, 9, 10]. Осмотр проводили с детализацией ортопедического статуса. Выполняли рентгенологические и рентгенофункциональные исследования отделов позвоночника, грудной клетки, МРТ позвоночника, суставов по показаниям. Для верификации диспластических клапанных синдромов, нарушений ритма и проводимости сердца применяли ЭхоКГ, ЭКГ покоя и суточное мониторирование ЭКГ. Больные с классифицируемыми наследственными заболеваниями и ревматической патологией в исследование не включались. В контрольную группу вошли 40 человек, сопоставимых по полу и возрасту, без внешних признаков дисплазии соединительной ткани.
Полученные результаты статистически обработаны. Количественные данные представлены в виде средней и стандартной ошибки средней. Достоверность межгрупповых различий устанавливали с помощью t-критерия Стьюдента; достоверность различий качественных признаков оценивали с помощью критерия χ2. Достоверными считали различия при p ≤0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Выраженность гипермобильности в суставах чаще всего (в 51,9% случаев) соответствовала 5 баллам. У 24,3% обследуемых данный показатель составил 4 балла; по 7 и 9 баллов было у 13,1 и 10,7% пациентов соответственно. В качестве верифицирующего диагностического признака у больных СГМС выявлена высокая распространенность поражения периартикулярных мягких тканей, вывихов и дисторсий в суставах. Вывихи суставов на момент обследования или в анамнезе зарегистрированы у 41,6% (χ2=8,563, р=0,003) пациентов, в 27,1% (χ2=9,115, р=0,003) дисторсионный синдром носил рецидивирующий характер (так называемые привычные вывихи). Периартикулярные поражения отмечены у 36,4% (χ2=5,516, р=0,019) обследуемых с СГМС.
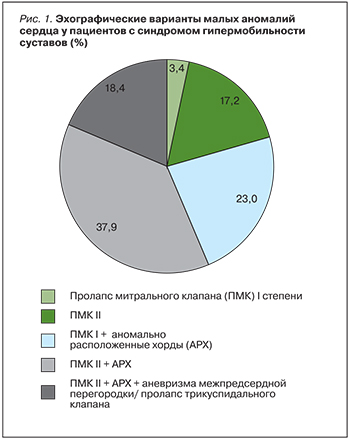
 Различные клапанные проявления дисплазии соединительной ткани сердца верифицированы у 87 (40,7%; χ2=6,356, р=0,003) пациентов с СГМС (рис. 1).
Различные клапанные проявления дисплазии соединительной ткани сердца верифицированы у 87 (40,7%; χ2=6,356, р=0,003) пациентов с СГМС (рис. 1).
Следует отметить, что структурный состав кардиальных диспластических изменений при гипермобильном синдроме имел характерные особенности в виде минимального представительства клинически и прогностически малозначимых внутрисердечных аномалий. Так, изолированный пролапс митрального клапана (ПМК) I степени (от 3 до 6 мм) [7] зарегистрирован у наименьшего числа обследуемых, тогда как аномально расположенные хорды (АРХ) изолированно в группе лиц с гипермобильностью не встречались. Наиболее часто у пациентов с СГМС наблюдались сочетания двух внутрисердечных дисплазий: ПМК I–II степени (от 3 до 6 и от 6 до 9 мм соответственно) с АРХ, а также трех клапанных аномалий: ПМК, АРХ и пролапса трикуспидального клапана или аневризмы межпредсердной перегородки, верифицированные эхокардиографически. Все АРХ были единичными и локализовались в полости левого желудочка. Признаки миксоматозной дегенерации митрального клапана, не превышавшей в 86,7% случаев по эхокардиографическим критериям I степени, имелись у 17,2% гипермобильных больных; митральная регургитация I–II степени отмечена у 68,97% пациентов с СГМС и клапанными синдромами [7].
Сочетание ПМК с АРХ, как и миксоматозную дегенерацию митрального клапана, относят к кардиальным проаритмогенным факторам [11, 12]. Нарушения сердечного ритма зарегистрированы в 65 (74,7%) случаях при клапанных дисплазиях у больных СГМС, что определяет необходимость целенаправленного выявления нарушений ритма и проводимости с уточнением их клинико-прогностической значимости у этой категории пациентов. Диапазон аритмий отличался разнообразием и сочетанием в ряде случаев нескольких видов нарушений ритма (табл. 1).
Доля прогностически значимых нарушений ритма и проводимости у гипермобильных больных с клапанным синдромом была невелика. Так, пароксизмальная желудочковая тахикардия зарегистрирована в ходе холтеровского мониторирования у одного обследуемого с эхографически установленным сочетанием ПМК II степени с АРХ. Желудочковые экстрасистолы, за исключением одного наблюдения, носили характер редких одиночных. Наиболее часто в структуре аритмий при СГМС встречалась одиночная наджелудочковая экстрасистолия, в том числе частая (5,3%), парная (47,4%) и групповая (26,3%).
 Раздельный анализ не установил зависимости между количеством внутрисердечных аномалий, выраженностью пролабирования митрального клапана, наличием миксоматозной дегенерации клапанных структур, митральной регургитации и степенью гипермобильности с учетом суммы балльных показателей по шкале Р. Beighton при СГМС. Таким образом, установление при ДСТ гипермобильности суставов как в виде отдельной нозологической формы, так и в качестве одного из внешних проявлений в диспластическом фенотипе диктует необходимость проведения дополнительного клинико-инструментального обследования для целенаправленного выявления клапанных и аритмических синдромов.
Раздельный анализ не установил зависимости между количеством внутрисердечных аномалий, выраженностью пролабирования митрального клапана, наличием миксоматозной дегенерации клапанных структур, митральной регургитации и степенью гипермобильности с учетом суммы балльных показателей по шкале Р. Beighton при СГМС. Таким образом, установление при ДСТ гипермобильности суставов как в виде отдельной нозологической формы, так и в качестве одного из внешних проявлений в диспластическом фенотипе диктует необходимость проведения дополнительного клинико-инструментального обследования для целенаправленного выявления клапанных и аритмических синдромов.
Имеются данные [1, 5, 13, 14], что наличие скелетных дисплазий, особенно позвоночника, грудной клетки, в той или иной степени способствует возникновению и неблагоприятному течению структурно-гемодинамических нарушений при ДСТ сердца.
Ортопедический осмотр гипермобильных пациентов выявил ряд внешних особенностей костно-мышечной системы, способных модифицировать течение клапанных синдромов. Достоверно чаще в сравнении с контрольной группой у обследуемых встречались нарушения осанки, в том числе обусловленные изменениями выраженности и соотношений физиологических изгибов позвоночника, а также воронкообразная деформация грудной клетки и сколиоз.
Структура нарушений осанки, в соответствии с особенностями грудного кифоза у пациентов с СГМС, представлена на рис. 2.
Преобладающей при гипермобильном синдроме оказалась верхнегрудная форма кифоза, или так называемая верхнегрудная сутуловатость (χ2=5,999, р=0,014). Синдром «плоская спина» встречался в исследуемой группе также достоверно чаще по сравнению с контролем (χ2=8,545, р=0,003). Следует отметить, что именно «плоская спина» предрасполагает к сниженной упругости позвоночного столба и формированию фронтальных его искривлений – сколиозов. Физиологическая форма грудного кифоза встречалась у пациентов с СГМС реже всего: в 22 случаях против 82,5% наблюдений в контрольной группе (χ2=46,645, р <0,0001).
 Другим достоверно частым скелетным проявлением соединительнотканной дисплазии, потенциально способным вызывать адаптивное ремоделирование камер сердца, оказались деформации грудной клетки, зарегистрированные у 48,1% (χ2=12,474, р <0,0001) пациентов с СГМС. В подавляющем большинстве – 79,6% случаев – в группе с деформациями грудной клетки имели место воронкообразные деформации I степени. Деформации с более выраженной глубиной воронки (II и III степени) составили соответственно 16,5 и 2,9% наблюдений, а у одного обследуемого выявлена килевидная деформация грудной клетки. При этом сочетание клапанных аномалий с деформациями грудной клетки у гипермобильных пациентов демонстрировало ряд особенностей. Так, присутствие у больных СГМС в диспластическом фенотипе ПМК I степени – изолированного или сочетанного с АРХ – сопровождалось воронкообразными изменениями грудной клетки исключительно I степени, тогда как при вариантах сочетания ПМК II степени с АРХ и трех внутрисердечных аномалий деформации с глубиной воронки II степени составили 52,9% от всех случаев данной скелетной дисплазии. Наличие воронкообразной грудной клетки III степени при гипермобильном синдроме также всегда ассоциировалось с комплексом трех малых аномалий сердца либо ПМК II степени с АРХ.
Другим достоверно частым скелетным проявлением соединительнотканной дисплазии, потенциально способным вызывать адаптивное ремоделирование камер сердца, оказались деформации грудной клетки, зарегистрированные у 48,1% (χ2=12,474, р <0,0001) пациентов с СГМС. В подавляющем большинстве – 79,6% случаев – в группе с деформациями грудной клетки имели место воронкообразные деформации I степени. Деформации с более выраженной глубиной воронки (II и III степени) составили соответственно 16,5 и 2,9% наблюдений, а у одного обследуемого выявлена килевидная деформация грудной клетки. При этом сочетание клапанных аномалий с деформациями грудной клетки у гипермобильных пациентов демонстрировало ряд особенностей. Так, присутствие у больных СГМС в диспластическом фенотипе ПМК I степени – изолированного или сочетанного с АРХ – сопровождалось воронкообразными изменениями грудной клетки исключительно I степени, тогда как при вариантах сочетания ПМК II степени с АРХ и трех внутрисердечных аномалий деформации с глубиной воронки II степени составили 52,9% от всех случаев данной скелетной дисплазии. Наличие воронкообразной грудной клетки III степени при гипермобильном синдроме также всегда ассоциировалось с комплексом трех малых аномалий сердца либо ПМК II степени с АРХ.
Рентгенологические и рентгенофункциональные исследования позволили верифицировать нозологические формы диспластической патологии позвоночника у больных СГМС, в ряде случаев полифокальные. Наиболее часто отмечено сочетание костно-связочных дисплазий, а также дегенеративно-дистрофических изменений в различных отделах позвоночника. Ряд патологических вертебральных проявлений встречался достоверно чаще в сравнении с контролем (рис. 3).
Как показано на рис. 3, превалировали сколиотические деформации позвоночника, зафиксированные достоверно чаще по сравнению с контрольной группой (χ2=8,210, р=0,004). При этом в подавляющем большинстве – в 83% случаев – отмечена I степень искривления. У 15,1% больных выявлен сколиоз II степени. Выраженные сколиотические деформации, вызывающие, как правило, нарушения конфигурации сердца, у пациентов с СГМС практически не встречались. Лишь у одного больного, имевшего сочетание ПМК II степени с АРХ, клинически и рентгенологически верифицирован сколиоз III степени. С учетом локализации сколиотической дуги наиболее часто имели место грудной и комбинированный – грудно-поясничный – сколиоз.
Диспластические аномалии позвонков, как и изменения их пространственной позиции, напрямую не оказывают механического воздействия на сердце и крупные сосудистые стволы, однако могут провоцировать нарушения осанки и составляют основу фронтальных и сагиттальных деформаций позвоночного столба, влияющих на расположение органов грудной полости [3]. Дисплазия краниовертебрального сегмента позвоночника включает костную, связочную и сочетанные костно-связочные аномалии. Избыточная подвижность суставов шейного отдела позвоночника на фоне связочной дисплазии часто проявляется нестабильностью краниовертебрального сегмента. У лиц с гипермобильным синдромом краниовертебральная дисплазия встречалась достоверно чаще (χ2=6,831, р=0,009) в сравнении с контролем.
Одним из состояний, часто ассоциированных с гипермобильным синдромом, является спондилолистез [15]. Дополнительным фактором, провоцирующим смещение позвонка относительно нижележащего, может служить характерная для СГМС излишняя растяжимость соединительнотканных связочных элементов. В исследуемой группе спондилолистез зарегистрирован у 26,9% пациентов (χ2=5,088, р=0,024). Как и в общей популяции, среди гипермобильных женщин данная патология встречалась в 1,9 раз чаще, чем среди мужчин с СГМС.
Полисегментарный остеохондроз, зарегистрированный у пациентов с СГМС, достоверно часто (χ2=5,691, р=0,017) может свидетельствовать о раннем появлении и прогрессировании при гипермобильном синдроме дегенеративных изменений в суставах, в том числе позвоночника, однако самостоятельного клинического значения в прогрессировании кардиальных диспластических нарушений он не имеет.
Остеохондропатия позвоночника – так называемый ювенильный кифоз, или болезнь Шойермана–Мау, во многих случаях сопровождается нарушением осанки в виде формирования грудного гиперкифоза в молодом возрасте [16]. Распространенность остеохондропатии позвоночника у больных СГМС превышала общепопуляционную (р >0,05), что объясняется общностью патогенетических механизмов нарушенного метаболизма коллагена и других компонентов соединительнотканного матрикса, а также врожденной или приобретенной функциональной недостаточностью хрящевой ткани [16]. Обращала внимание достоверно более частая встречаемость миксоматозной дегенерации пролабирующего митрального клапана у пациентов с СГМС и болезнью Шойермана–Мау (33,3%, р <0,05) по сравнению с другими формами скелетной патологии.
ЗАКЛЮЧЕНИЕ
Высокая частота клапанных и аритмических проявлений соединительнотканной дисплазии сердца при СГМС диктует необходимость включения в алгоритм обследования пациентов с гипермобильностью мероприятий по обследованию сердца, модифицирует диагностические стратегии и программы курации с учетом кардиальных клинико-функциональных проявлений.
Присутствие в фенотипе гипермобильных лиц полифокальных и сочетанных скелетных дисплазий, предрасполагающих к клинически значимым деформациям с возможной диспозицией сердца и крупных сосудистых стволов, относит их в группу риска по развитию и неблагоприятному течению кардиальных диспластических синдромов.



