Респираторные проблемы детей, родившихся недоношенными, определяются анатомической незрелостью легких, недоразвитием грудной клетки, воспалительными и фиброзными изменениями в бронхах и интерстициальной ткани, связанными с реанимацией в неонатальном периоде. Изучение влияния этих процессов на дальнейшее развитие легких и значения респираторных заболеваний периода новорожденности для патологии детства и взрослой жизни с учетом компенсаторных возможностей детского организма представляют большой интерес для педиатрической и терапевтической пульмонологии.
Впервые бронхолегочная дисплазия (БЛД) как тяжелое обструктивное заболевание легких, сопровождавшееся высокой летальностью, была описана в 1967 г. у недоношенных детей с достаточно большим гестационным возрастом и массой тела при рождении. Совершенствование методов выхаживания преждевременно родившихся младенцев привело к снижению тяжести заболевания, но в связи с увеличением числа глубоко недоношенных детей частота болезни не уменьшилась [1, 2].
При классической БЛД, широко распространенной в 60–80-е гг. прошлого века, интенсивное воспаление и деструкция сравнительно зрелых легочных структур приводили к повреждению дыхательных путей, особенно дистальных, и легочной паренхимы с развитием перибронхиолярного и интерстициального фиброза. Главная особенность новой БЛД – диффузное уменьшение альвеолярного развития и клинически значимая потеря поверхности газообмена. При этом повреждение дыхательных путей, выраженность воспаления и фиброза обычно слабее, чем при классической форме [3]. Хотя в последние годы в результате изменения условий выхаживания, оказания медицинской помощи и более низкого гестационного возраста патофизиологические основы болезни изменились, младенцы с БЛД продолжают представлять собой серьезную мультидисциплинарную проблему для здравоохранения, в том числе вследствие имеющихся нарушений легочной вентиляции и газообмена.
В раннем периоде БЛД характеризуется значительными нарушениями вентиляционной способности легких и яркими клиническими симптомами. В дальнейшем, согласно существующему представлению, происходит «перерастание болезни», уменьшение выраженности клинических проявлений заболевания или даже нормализация функции внешнего дыхания (ФВД) по мере роста ребенка. Попытки научно оценить последствия БЛД у подростков и взрослых предпринимались в отдельных исследованиях, однако до настоящего времени исходы заболевания, его значение для респираторной патологии детей и взрослых точно не определены. Сложность долгосрочного прогноза у пациентов с БЛД определяется тем, что больные, у которых данная патология была выделена в самостоятельную нозологическую форму, к настоящему времени достигли второго-четвертого десятилетия жизни. В нашей стране первые публикации, посвященные этой проблеме, появились в 90-е гг. прошлого века. Широкое использование сурфактанта для профилактики респираторного дистресс-синдрома (РДС) новорожденных и щадящих режимов респираторной поддержки относится к началу 2000 гг. С этим связано отсутствие отечественных работ, посвященных последствиям БЛД у детей старшего возраста и взрослых [4, 5].
КЛИНИЧЕСКИЕ СИМПТОМЫ
Известно, что дети с классической БЛД имеют повторные эпизоды свистящего дыхания в первые 2 года жизни. Вместе с тем и после 2-летнего возраста каждый пятый ребенок страдает от рецидивирующих эпизодов бронхиальной обструкции [2, 6, 7]. По данным российских исследований, симп-томы рецидивирующей бронхиальной обструк-ции при интеркуррентных заболеваниях выявляются 80–88% детей с БЛД в возрасте 2–10 лет [4, 8]. Ряд исследований подтвердили увеличение частоты хронического кашля и свистящего дыхания у детей дошкольного и школьного возраста, рожденных недоношенными, имевших в периоде новорожденности пролонгированную искусственную вентиляцию легких (ИВЛ) и развивших БЛД [1, 9, 10]. В отдельных работах отмечалось, что как у подростков, так и у взрослых с БЛД в анамнезе хронические респираторные симптомы могут сохраняться после периода новорожденности. Так, P.M. Wong et al. (2008) наблюдали группу взрослых с БЛД в анамнезе, из которых 10% имели респираторные проблемы и получали лечение ингаляционными стероидами [11]. S.J. Howling et al. (2000), наблюдавшие 5 взрослых, у которых в периоде новорожденности была диагностирована БЛД, отмечают, что 3 из них имели респираторные симптомы [12].
Известно, что дети, рожденные недоношенными, имеют более высокую частоту эпизодов бронхиальной обструкции в раннем возрасте по сравнению с доношенными [9, 13, 14. 15, 16].
W.H. Northway, впервые описавший БЛД, сравнивал 3 группы подростков и молодых взрослых: имевших БЛД в анамнезе, не имевших БЛД, но родившихся с малыми весом и гестационным возрастом, и здоровых субъектов. Из 26 пациентов с БЛД в анамнезе 6 (23%) имели хронические респираторные симптомы. Пациенты этой группы чаще, чем в других группах, имели свистящее дыхание и повторные инфекции нижних дыхательных путей [17].
Большинство исследователей подчеркивает отчетливую тенденцию к клиническому улучшению и постепенному уменьшению частоты или полному исчезновению обструктивных эпизодов даже в том случае, когда при исследовании вентиляционной функции легких имеются стойкие необратимые изменения [1, 17, 18].
Рецидивирующая бронхиальная обструкция нередко приводит к ошибочной диагностике бронхиальной астмы (БА) у детей с БЛД. Метаанализ (2013), включавший 30 исследований 1,5 млн пациентов из 6 стран в возрасте от 1 до 14 лет, установил высокую частоту эпизодов свистящего дыхания и БА у недоношенных детей с БЛД и без БЛД. В обсуждении результатов исследования указано на трудность проведения дифференциальной диагностики между этими двумя заболеваниями, особенно у детей раннего возраста; подчеркивается, что вклад атопии в рецидивирующие обструктивные эпизоды у детей с БЛД не известен и требует уточнения [18]. Более ранние исследования не обнаружили повышения частоты наследственной отягощенности по аллергическим заболеваниями у детей с БЛД [9, 19, 20]. Маркером эозинофильного воспаления, характерного для БА, считается повышение уровня оксида азота в выдыхаемом воздухе. Исследования по определению этого показателя у детей после БЛД подтвердили его низкий уровень, несмотря на имеющиеся повторные обструктивные эпизоды [21, 22, 23]. Отсутствие полной обратимости симптома свистящего дыхания и сохранение нарушений бронхиальной проходимости при лечении бронходилататорами и ингаляционными стероидами, стойкие фиброзные изменения, часто выявляющиеся при рентгенологическом исследовании у этих пациентов, по мнению большинства авторов, также свидетельствуют против аллергической природы имеющихся респираторных симптомов [4, 12, 24, 25].
ПОКАЗАТЕЛИ ФУНКЦИИ ВНЕШНЕГО ДЫХАНИЯ
К основным синдромам нарушения вентиляционной способности легких у детей с БЛД в раннем периоде болезни относятся нарушение бронхиальной проходимости, гиперреактивность дыхательных путей, изменение легочных объемов, нарушение эластических свойств и диффузионной способности легких. Подобные нарушения, но менее выраженные, описаны у детей, родившихся недоношенными и не имевших серьезных неонатальных респираторных проблем [1, 5, 6]. Изучение изменений этих показателей в детском, подростковом возрасте и у взрослых предпринималось в ряде исследований (табл. 1).
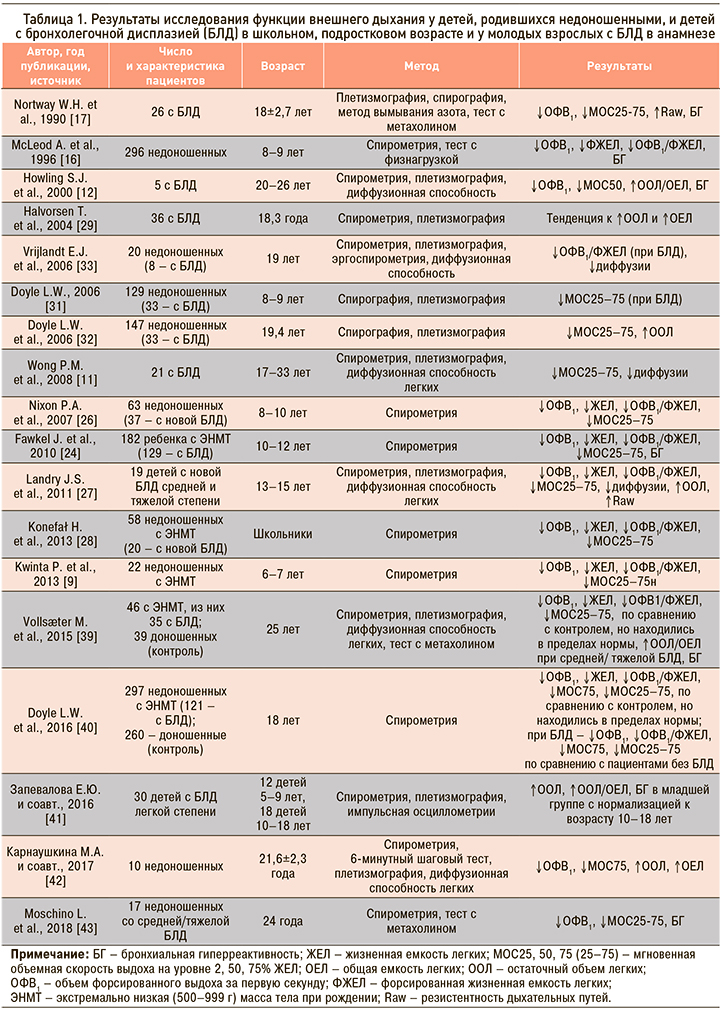
Метаанализ 18 исследований ФВД у детей и подростков 6–19 лет, родившихся недоношенными и страдавших классической формой БЛД в 1990-е гг., установил, что во всех, кроме двух, исследованях показатель объема форсированного выдоха за первую секунду (ОФВ1) был значительно ниже у детей с БЛД по сравнению со здоровыми сверстниками. У подавляющего числа обследованных с БЛД в анамнезе показатель ОФВ1 составил менее 80%. 4 из 18 представленных исследований касались детей с новой БЛД, значения ОФВ1 у этих пациентов не отличались от величины этого показателя у детей с классической формой болезни [1]. Подобные результаты были получены в более поздних исследованиях легочной функции у детей с новой БЛД [26, 27, 28]. В одном из первых исследований, посвященных долговременным последствиям БЛД, W.H. Northway et al. (1990) у 67% взрослых, имевших БЛД в периоде новорожденности, обнаружили обструктивные изменения показателей ФВД, а у 24 % регистрировалась необратимая обструкция бронхов. В этой группе отмечались статистически достоверное снижение показателей ОФВ1, форсированной жизненной емкости легких (ФЖЕЛ), мгновенной объемной скорости выдоха на уровне 25–75% ЖЕЛ (МОС25–75), повышение бронхиального сопротивления и частоты выявления бронхиальной гиперреактивности, по сравнению с контрольными группами [17]. T. Halvorsen et al. (2004) обследовали 46 пациентов (средний возраст 17,7 лет), родившихся с экстремально низкой массой тела, 12 из которых имели среднетяжелую или тяжелую БЛД. У обследованных детей были подтверждены сохраняющиеся нарушения бронхиальной проходимости и бронхиальная гиперреактивность, отмечена тенденция к увеличению обструктивных изменений при более тяжелой болезни в периоде новорожденности [29].
L.W. Doyle et al. (2001, 2006) наблюдали изменения показателей, характеризующих проходимость дыхательных путей у пациентов, родившихся недоношенными (с массой тела при рождении менее 1500 г) с БЛД и без БЛД в периоде новорожденности, в возрасте 8, 11 и старше 18 лет. При отсутствии БЛД скоростные показатели к 18 годам находилась в нормальных пределах, хотя имелась тенденция к несколько более низким значениям по сравнению с нормой. У пациентов с БЛД в анамнезе отмечались достоверно более низкие показатели ОФВ1, МОС25–75, ОФВ1/ФЖЕЛ по сравнению с группой без БЛД во всех возрастах, расцениваемые авторами как признаки хронической обструктивной болезни легких (ХОБЛ). Не было отмечено зависимости исследуемых показателей от гестационного возраста, веса и роста при рождении. При сравнении данных, полученных в возрасте 8 и 18 лет, пациенты с БЛД имели существенное снижение скоростных показателей ФВД и статистически отличались от пациентов без БЛД. Также было отмечено достоверное снижение значения ОФВ1/ФЖЕЛ у пациентов с БЛД к 19 годам жизни по сравнению с показателями исследования, выполненного в 8-летнем возрасте. Авторами высказывается предположение о более быстром снижении функциональных возможностей легких с возрастом у этих больных, что, по их мнению, приведет к клинически значимым респираторным проблемам в зрелом возрасте [30, 31, 32].
В работе P.M. Wong et al. (2008) в группе взрослых пациентов в возрасте от 17 до 33 лет с БЛД в анамнезе только у 3 (14%) не было обнаружено нарушений при спирографии, остаточный объем легких (ООЛ) был повышен у 28% обследованных [11]. Подобные результаты были получены и в исследованиях, опубликованных в последние годы [27, 29, 31]. У большинства детей и подростков, перенесших БЛД, при оценке ФВД в динамике обнаружены признаки обструкции дистальных дыхательных путей без тенденции к нормализации их с возрастом [16, 28, 31]. Результаты исследования ФВД в школьном возрасте у детей, родившихся преждевременно и имевших БЛД в анамнезе, были значительно хуже у тех, кто перенес в младенчестве инфекцию, вызванную респираторно-синцитиальным вирусом [34].
Данные, полученные при изучении влияния состояния недоношенности на изменения показателей ФВД, у пациентов разного возраста противоречивы. В исследовании, выполненном в конце 90-х гг. (McLeod A. et al.), сравнивались клинические симптомы и результаты спирографии большой группы детей, родившихся недоношенными, в возрасте 8–9 лет и их доношенных сверстников (300 и 590 детей соответственно). Было установлено, что недоношенность связана с более высокой частотой респираторной патологии и более низкими значениями ФЖЕЛ, в то же время скоростные показатели ФВД не отличались в группах, хотя низкие значения показателя ОФВ1/ФЖЕЛ, характеризующие нарушения бронхиальной проходимости, в 2 раза чаще встречались у недоношенных детей, по сравнению с контрольной группой. Выявлена зависимость полученных данных от веса при рождении, перенесенного РДС новорожденных и длительности ИВЛ [16]. I. Narang et al. (2008) при сравнении результатов спирометрии у 60 пациентов в школьном и молодом возрасте, родившихся недоношенными и не получавшими сурфактант, обнаружили нормализацию показателей к 21 году жизни [35].
По данным большинства исследований, значение ОФВ1 находится на нижней границе нормы у детей старшего возраста, подростков и молодых взрослых, родившихся недоношенными с дыхательными нарушениями или без серьезных респираторных проблем в перинатальном периоде; лишь небольшая часть из них имеет умеренную или тяжелую степень снижения ОФВ1 [13, 16, 17, 25, 26, 27]. При плетизмографии у старших детей и подростков после БЛД обычно обнаруживается нормальная общая емкость легких (ОЕЛ) с некоторой степенью гиперинфляции, что проявляется в увеличении ООЛ и отношения ООЛ/ОЕЛ [27, 29, 31]. Жизненная емкость легких определялась на нижней границе нормы, функциональная остаточная емкость (ФОЕ) и объем внутригрудного газа (ОВГ) были в норме или слегка увеличены [11, 32, 33, 36]. Нормализацию значений ОЕЛ при повышенных значениях ООЛ, ООЛ/ОЕЛ и также ОВГ можно объяснить потерей эластических свойств легочной ткани и ранними признаками эмфизематозной перестройки у данных больных [37].
Частота гиперреактивности дыхательных путей как чрезмерной реакции на бронходилатирующие факторы описана у подростков и взрослых, переносивших БЛД, в широких пределах от 23 до 72% [16, 24, 29, 36]. Природа этого симптома у детей с данной патологией остается неизвестной, предполагается влияние генетических факторов, последствий ремоделирования дыхательных путей в результате повреждения в неонатальном периоде и нарушения развития легких [25, 32, 36]. Учитывая недостаточный эффект бронходилататоров и стероидов при данном заболевании, воспалительная природа этого феномена кажется сомнительной [24, 38].
Результаты первого отечественного исследования влияния недоношенности на формирование бронхолегочной патологии у молодых взрослых показали, что экс-недоношенные отличались от здоровых добровольцев по количеству перенесенных за последний год бронхитов (1,6±1,17 и 0,22±0,44 соответственно), снижением показателя ОФВ1 до проведения пробы с бронхолитиком, МОС75, средней объемной скорости воздушного потока в интервале между 25 и 75% ФЖЕЛ и повышением ООЛ, что может свидетельствовать о наличии обструкции преимущественно дистальных отделов бронхов [42].
Новая и классическая формы БЛД связаны с нарушениями процессов альвеоляризации и васкуляризации легкого, что может влиять на легочный газообмен в последующей жизни. Определение диффузионной способности легких (ДСЛ) позволяет оценить легочный газообмен и состояние альвеолярно-капиллярной мембраны. Имеется ограниченное число исследований, изучавших данный показатель у молодых взрослых с БЛД в анамнезе. В исследованиях S.J. Howling et al. (2000) и E.J. Vrijlant et al. (2006) не было обнаружено снижения ДСЛ у обследованных как при наличии БЛД в анамнезе, так и в ее отсутствие [12, 33]. Противоположные результаты получены P.M. Wong et al. (2008): у 84% молодых взрослых с БЛД в периоде новорожденности были выявлены сниженные значения ДСЛ. Авторы предполагают, что такое различие в результатах связано с более тяжелой болезнью в периоде новорожденности в этой группе по сравнению с другими исследованиями. Снижение ДСЛ не коррелировало с тяжестью обструктивных нарушений и эмфизематозных изменений и, согласно комментариям авторов, вероятно, выявляло группу пациентов, имеющих стойкие нарушения альвеолярно-капиллярной мембраны вследствие нарушения развития легкого и/или фиброзных изменений [11]. Отмечается связь изменений ДСЛ c недоношенностью независимо от наличия или отсутствия БЛД [32].
E.J. Vrijlandt et al. (2006), сравнивая показатели спирометрии, плетизмографии и эргоспирометрии у 19-летних пациентов, родившихся недоношенными, с их здоровыми сверстниками, сделали вывод, что пролонгированный эффект недоношенности на респираторную функцию характеризуется более низкими значениями ОФВ1 и ДСЛ, хотя средние значения этих показателей находятся в нормальных пределах. Тенденция к снижению ДСЛ, по мнению авторов, может отражать уменьшение поверхности газообмена за счет снижения альвеоляризации, фиброзных изменений альвеолярно-капиллярной мембраны, перфузионно-вентиляционных несоответствий [33].
Снижение толерантности к физической нагрузке у пациентов с БЛД в анамнезе отмечено в ряде исследований и характеризуется нарушением вентиляционной адаптации, снижением диффузии во время физической активности [33, 37]. В исследовании S.H. Mitchell et al. (1998) сообщается о снижении толерантности к физической нагрузке и нарушенной диффузии газов во время нагрузки и отдыха у детей в школьном возрасте с БЛД в анамнезе по сравнению как со здоровыми, рожденными доношенными, так и рожденными недоношенными, перенесшими РДС, сверстниками [37].
РЕНТГЕНОЛОГИЧЕСКАЯ КАРТИНА
Характерные рентгенологические признаки описаны у детей в остром периоде БЛД, динамика этих изменений с возрастом, диагностика остаточных структурных легочных изменений с помощью рентгенологического метода исследования представляет большой интерес. Рентгенография грудной клетки признана недостаточно чувствительным методом для выявления патологических признаков в легких после БЛД [44, 45]. Методом, позволяющим выявить структурные изменения в легких, считается компьютерная томография легких (КТЛ) (табл. 2).
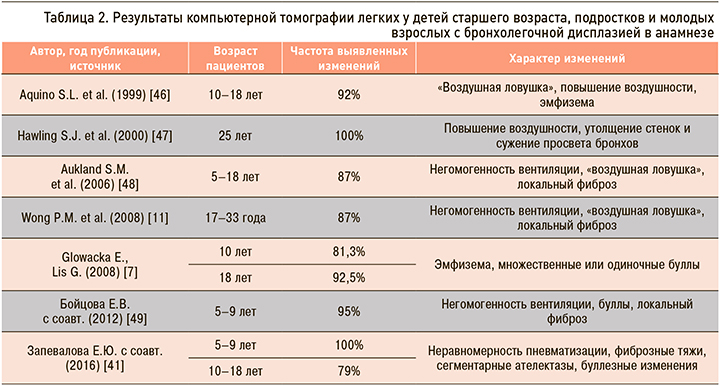
Имеется ограниченное число исследований, выполненных у детей и взрослых с БЛД в анамнезе. И.В. Давыдова (2010) при изучении исходов БЛД у большинства детей в возрасте 2–7 лет обнаружила стойкие изменения при проведении КТЛ, свидетельствующие о фиброзе и повышении воздушности легочной ткани [8].
По данным S.J. Hawling et al. (2000), при проведении КТЛ у 5 взрослых (средний возраст 20–26 лет) с БЛД в анамнезе изменения характеризовались мозаичностью легочного рисунка, наличием «воздушных ловушек», буллами, утолщением стенок бронхов, уменьшением отношения диаметров бронхов и сосудов, линейными затенениями и в редких случаях бронхоэктазами [12]. S.L. Aquino et al. (1999) при проведении экспираторной КТЛ у 26 пациентов после БЛД (возраст 10–17 лет) обнаружили у 70% больных повышение прозрачности легких с вовлечением от 5 до 70% легочной ткани, у 92% – симптом «воздушной ловушки» и только в одном случае подтвердили эмфизему [46]. Похожие результаты получены и в других работах, посвященных исходам БЛД у молодых взрослых, в то же время отмечаются значительные колебания в частоте выявления определенных структурных изменений. Так, в отдельных работах наиболее часто встречающимися признаками у старших пациентов после БЛД были линейные и треугольные субплевральные затенения, в других – негомогенность вентиляции и «воздушная ловушка» [46, 47]. Противоположные данные представлены в исследовании P.M. Wong et al. (2008): структурные нарушения в легких обнаружены у всех обследованных больных, у 84% из них диагностирована эмфизематозная перестройка легочной ткани, преобладала центрилобулярная эмфизема, у единичных пациентов в дополнение к центрилобулярной обнаруживалась панацинарная, буллезная и парасептальная эмфизема. Другими изменениями были утолщения стенок бронхов, «воздушная ловушка», у одного больного обнаружены бронхоэктазы. Не было выявлено корреляционной связи между степенью тяжести эмфиземы и снижением значения ОФВ1 и ДСЛ, повышением ООЛ. Степень выраженности эмфиземы также не была связана с гестационным возрастом, в то же время увеличение массы тела при рождении сопровождалось более распространенными эмфизематозными изменениями. Отсутствие определенной связи между гестационным возрастом и массой при рождении и степенью нарушения функциональных показателей и эмфиземой, отмеченном и в других исследованиях, трудно объяснить. Возможно, это связано с небольшим числом обследованных. Необходимы исследования, позволяющие идентифицировать модифицирующие перинатальные факторы, предопределяющие исход БЛД [11].
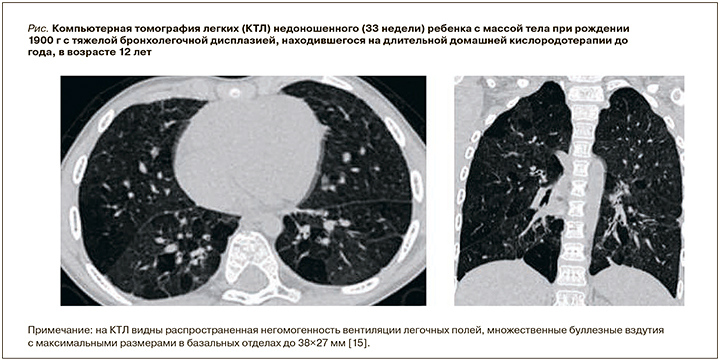
E. Glowacka и G. Lis (2008) при обследовании пациентов с БЛД в анамнезе в возрасте 10 и 18 лет отметили увеличение частоты выявления структурных изменений при КТЛ с возрастом. Преобладающими симптомами были эмфизематозная перестройка легочной ткани, одиночные или множественные буллы обнаруживались у 86% обследованных [7]. Высокая частота выявления эмфиземы в ряде исследований, вероятно, связана использованием более современных методик компьютерной томографии и, возможно, более тяжелым изначальным поражением легких обследованных пациентов. На рис. представлена КТЛ наблюдавшегося нами 12-летнего пациента с тяжелой БЛД с последствиями в виде облитерирующего бронхиолита, эмфиземы легких и БА.
БРОНХОЛЕГОЧНАЯ ДИСПЛАЗИЯ И ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЕГКИХ У ВЗРОСЛЫХ
Представление о том, что низкий вес при рождении и респираторные проблемы в ранней жизни связаны с формированием и тяжелым течением хронической обструктивной болезни легких (ХОБЛ) в зрелом возрасте сформулировано в конце прошлого века, и за этот период времени накоплено уже достаточно фактов, подтверждающих эту гипотезу [50, 51, 52, 53, 54].
Известно, что одна из причин формирования БЛД – это повреждение легких свободными радикалами в результате гипероксии, причем для недоношенных новорожденных гипероксия возникает уже при дыхании комнатным воздухом [55]. Маркеры, свидетельствующие о пероксидации, обнаружены в бронхиальном содержимом недоношенных, которые особенно подвержены действию оксидантов в связи с незрелостью антиоксидантной защиты [54, 56]. На экспериментальных животных моделях установлено, что гипероксия, кроме повреждающего действия на легочную ткань, может нарушать процессы альвеолизации, характерные для БЛД, за счет уменьшения уровня экспрессии различных медиаторов играющих критическую роль в этом процессе [55]. Также было показано, что нарушение альвеоляризации в пренатальном периоде способствует формированию эмфиземы у взрослых животных, это позволяет предположить существование предрасположенности к ХОБЛ с младенческого возраста [54, 56]. Повреждение легких свободными радикалами, присутствующими в сигаретном дыме, играет ведущую роль в патогенезе ХОБЛ [56, 57].
Воспаление имеет большое значение в этиологии и БЛД, и ХОБЛ. При БЛД воспаление является результатом ИВЛ, токсического действия кислорода, инфекции и сопровождается увеличением содержания нейтрофилов и макрофагов в легких [55, 58]. Нейтрофильная и макрофагальная инфильтрация бронхов и легочной ткани характерна для ХОБЛ, сформировавшейся у курильщиков. Инфильтрация воспалительными клетками приводит к увеличению концентрации провоспалительных цитокинов, повышение их уровня доказано как при БЛД, так и при ХОБЛ [56, 57]. Большое значение в формировании ХОБЛ и эмфиземы придается дисбалансу матриксных протеаз и их тканевых ингибиторов. Подобный дисбаланс был также установлен при БЛД [59, 60].
У младенцев с БЛД и в экспериментальных моделях обнаружено увеличение экскреции продуктов дегрануляции эластина, десмозина, что свидетельствует о нарушении процесса эластогенеза с формированием дефектного легочного каркаса. Формирование эмфиземы при ХОБЛ также связано с деградацией эластина и коллагена, и повреждение структуры эластических волокон имеет важное значение в патогенезе ХОБЛ [56, 57]. Дефицит эластогенеза, имеющийся при БЛД, может быть фактором, увеличивающим чувствительность к сигаретному дыму и другим патологическим стимулам в поздней жизни [61].
Во многих исследованиях подчеркивается возможность более тяжелых и быстрых возрастных изменений ФВД у взрослых, имеющих БЛД в детстве [1, 11, 53]. В особенности это касается курящих взрослых с БЛД в анамнезе.
L.W. Doyle et al. (2003) опубликовали результаты сравнительного исследования ФВД 44 взрослых (14 курящих и 30 некурящих) с экстремально низкой (500–999 г) массой тела (ЭНМТ) при рождении, средний возраст которых составлял 20,2 года. Показатели ОФВ1/ФЖЕЛ, МОС25-75 у курящих были значительно снижены. Численность лиц, у которых имело место клинически значимое снижение ОФВ1/ФЖЕЛ (<75%), была гораздо больше у курящих (64%), по сравнению с некурящими (20%) (р <0,01). Темпы ухудшения ФВД к 20 годам жизни были выше у курильщиков при сравнении с исследованием, выполненном данным пациентам в 8-летнем возрасте [62]. Интересно, что в исследовании M. Vollsaeter et al. (2015) была установлена более высокая частота курения во время беременности матерей детей с ЭНМТ и БЛД по сравнению со здоровым контролем (49 и 18%), а также более высокая частота этой привычки у взрослых, родившихся недоношенными и имевших БЛД (41 и 21%) [39].
ЗАКЛЮЧЕНИЕ
Таким образом, большинство исследований, проведенных для определения исхода БЛД у детей, подростков и взрослых, установили длительное сохранение нарушений функции дыхания и структурных изменений в легочной ткани. Стойкие изменения в виде негомогенной вентиляции, повышенной воздушности и эмфиземы в сочетании с локальными фиброзными изменениями обнаружены и при КТЛ. Клиническое значение выявленных изменений может состоять в том, что пациенты с БЛД в анамнезе относятся к группе риска раннего формирования ХОБЛ. Необходимы дальнейшие пролонгированные исследования, а также выявление и изучение различных перинатальных и наследственных факторов, предопределяющих исход БЛД. Также нуждается в исследовании вопрос о взаимосвязи БЛД и БА у взрослых, которая, очевидно, будет иметь место в рамках перекреста БА и ХОБЛ. По данным собственного лонгитудинального наблюдения за 1004 детьми с БЛД в возрасте до 12 лет в Москве, частота БА составила у них 7%, что выше популяционной частоты астмы у детей. По данным проведенного метаанализа, наличие БЛД у детей повышает риск формирования БА в 2,2 раза, что выше, чем недоношенность, увеличивающая риск БА в 1,71 раза [63]. В ряде случаев проведение дифференциальной диагностики БА и облитерирующего бронхиолита в исходе БЛД представляет затруднения; как показали наши собственные наблюдения, возможна коморбидность этих последствий БЛД [64]. При сборе анамнеза у молодых взрослых пациентов с ХОБЛ необходимо обращать внимание на факт недоношенности и респираторные проблемы в периоде новорожденности. Курящие взрослые с БЛД в анамнезе или недоношенные должны подвергаться повторным функциональным исследованиям, чтобы установить, развивается ли у них ХОБЛ быстрее и в более раннем возрасте.



