Периоперационные респираторные осложнения представляют собой патологические процессы, которые возникли в структуре дыхательной системы во время и после проведенного оперативного вмешательства и анестезиологического пособия [1]. Осложнения со стороны дыхательной системы встречаются достаточно часто и вносят значимый вклад в структуру заболеваемости и смертности после проведенного оперативного вмешательства. По данным зарубежной литературы, частота встречаемости респираторных осложнений в периоперационном периоде составляет от 1 до 23% [1]. В целом у 2,8% пациентов, перенесших некардиальные операции, развивается тяжелое послеоперационное легочное осложнение [2]. В большом австралийском обзоре (8372 пациента) было показано, что респираторные осложнения возникали в 2,2% случаев после проведенного эндотрахеального наркоза (ЭТН). Наиболее значимыми среди них были десатурация, аспирация и обструкция верхних дыхательных путей [3]. Основные виды периоперационных респираторных осложнений представлены в таблице. 1.

По данным литературы, каждый пятый пациент (14–30%) с респираторными осложнениями после больших оперативных вмешательств имеет высокий риск летального исхода в первые 30 дней после операции по сравнению с пациентами, которые не имели таких осложнений [1].
Таким образом, необходимо выделять и оценивать факторы риска респираторных осложнений перед планируемым хирургическим вмешательством, чтобы снизить частоту их развития. Многие группы исследователей пытались представить шкалы прогнозирования риска респираторных осложнений. Однако не существует идеальной шкалы оценки, так как все они были основаны на ретроспективном анализе данных и оценивают, как правило, один из видов осложнений (пневмонию, дыхательную недостаточность и т.д.) [1]. Развитие послеоперационных респираторных осложнений обусловлено совокупностью показателей: соматическим состоянием пациента, эффектами проводимого анестезиологического пособия и наличием оперативного вмешательства на органах дыхательной системы [1–3]. Все эти факторы условно можно подразделить на 2 группы – модифицируемые и немодифицируемые (табл. 2).
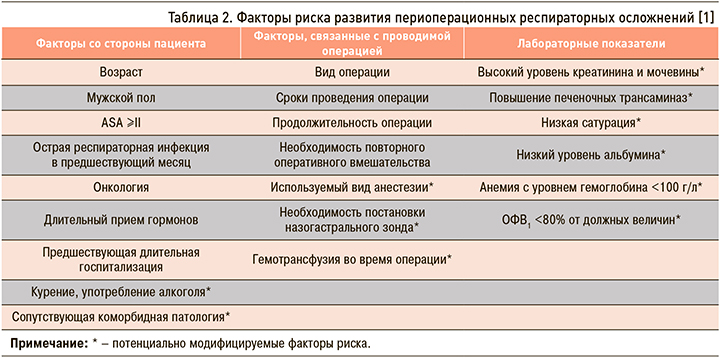
Рассмотрим перечисленные факторы риска более подробно. Основными среди них являются возраст старше 70 лет, ≥2 класс по ASA-классификации, курение, гипоальбуминемия <30 г/л, анемия с уровнем гемоглобина <100 г/л и наличие коморбидной патологии (хронические заболевания дыхательной системы, застойная сердечная недостаточность и нервно-мышечная патология). Эти факторы приводят к снижению пульмонального резерва и соответственно усилению эффектов проводимой анестезии [3].
В ряде исследований показано, что уровень гемоглобина <100 г/л у пациента до операции повышает риск развития респираторных осложнений в послеоперационном периоде в 3 раза вне зависимости от вида оперативного вмешательства [1].
По данным литературы, у пациентов с бронхиальной астмой (БА) существует повышенный риск развития бронхоспазма, пневмонии и дыхательной недостаточности при наличии в анамнезе частых обострений, недавней госпитализации по данному заболеванию или проведения искусственной вентиляции легких (ИВЛ). В работе Т. Numata et al. отмечено, что при наличии у пациента с БА уровня эозинофилов >200/мм3 и индекса курения >20 пачка/лет имеется более высокий риск развития респираторных осложнений после проведенной операции. В другом исследовании, включившем 1500 пациентов с БА, было показано, что эти риски одинаковы как при проведении общей, так и региональной анестезии [5].
Хроническая обструктивная болезнь легких (ХОБЛ) также ассоциирована с высокими рисками развития респираторных осложнений в послеоперационном периоде. Это может быть связано со слабостью дыхательной мускулатуры, недиагностированным легочным сердцем и наличием дополнительно явлений бронхоспазма. Алгоритм диагностики и коррекции бронхоспазма представлен на рисунке [3, 5].
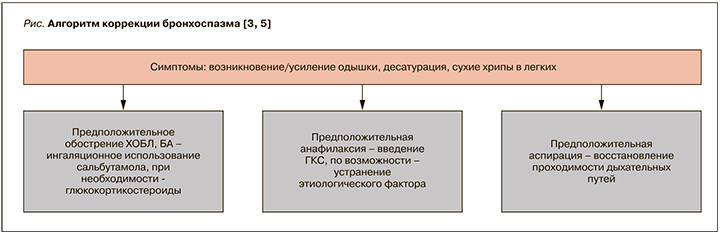
Необходимо продолжение применения базисной терапии у пациентов с ХОБЛ и БА в периоперационном периоде. При выраженной бронхообструкции возможно добавление ингаляционных бронходилататоров через небулайзер за несколько дней до планируемого оперативного вмешательства [3].
Более часто подвержены эпизодам постоперационной гипоксемии пациенты с обструктивным апноэ сна (ОАС). Седативные и обезболивающие препараты снижают фарингеальный тонус и реакцию организма на возникающую гипоксию и гиперкапнию. Общая анестезия влияет на физиологию сна, что в сочетании с использованием опиоидных анальгетиков может приводить к развитию дополнительной обструкции в послеоперационном периоде и удлинять эпизоды ОАС [6, 7].
Отказ от курения важен у всех пациентов. Элиминация оксида углерода и никотина происходит через 12–48 ч после курения, а реактивность дыхательных путей начинает снижаться примерно через 1 нед. В ряде исследований показано, что отказ от курения за 4–6 нед до оперативного вмешательства значительно уменьшает частоту периоперационных осложнений: за 4 нед до операции на 23%, более 8 нед – на 47% [1–3].
Необходимо оценивать также хирургические факторы риска. Выбор доступа и объема оперативного вмешательства вносят существенный вклад в развитие периоперационных осложнений. Так, например, торакальные и абдоминальные операции (включая большие сосудистые вмешательства) приводят к развитию дисфункции диафрагмы, увеличивая риски развития дыхательной недостаточности (ДН). Это обусловлено возможным повреждением диафрагмальных и межреберных нервов во время оперативного вмешательства (в том числе «микротравмы» при тракции рядом расположенных анатомических структур), болевым синдромом в области проведенной операции (за счет ограничения глубоких дыхательных движений). Было показано, что у пациентов после проведенного лапароскопического вмешательства функциональная остаточная емкость легких (ФОЕЛ) снижается примерно на 50% от исходного уровня и нормализуется в дальнейшим в течение 1–2 нед (что обусловлено повышением внутрибрюшного давления на фоне лапароскопического доступа, пневмоперитонеума). Доказано, что размер операционной раны, продолжительность операции более 3 ч, объем кровопотери и гемотрансфузия во время операции также являются независимыми факторами риска респираторных осложнений в послеоперационном периоде преимущественно за счет участия в развитии системной воспалительной реакции (СВР), что может приводить к появлению реактивности дыхательных путей, бронхоспазму и пневмонии [3, 8].
На частоту развития периоперационных осложнений влияет и выбор вида анестезиологического пособия. Применение общей анестезии снижает ФОЕЛ в среднем на 20% и обусловливает развитие ателектазов в легких. При наличии у пациента ожирения и ХОБЛ происходит более значимое снижение ФОЕЛ. Эпидуральная анестезия без использования общего наркоза редко приводит к развитию ателектазов, в связи с чем данный вид анестезиологического пособия более предпочтителен у пациентов высокого риска [9]. Продолжительность анестезиологического пособия более 2 ч является независимым фактором риска развития респираторных осложнений [1]. Необходимо помнить, что резидуальное действие анестетиков, анальгетиков и седативных препаратов снижает чувствительность дыхательных рецепторов, что приводит к дополнительной гиповентиляции и гипоксемии [7, 10].
В крупном исследовании 1954 г., включившем 600 000 пациентов, было показано, что использование данных препаратов в 63% случаев приводило к развитию респираторных осложнений [1].
 ИВЛ-индуцированное повреждение легких – еще одно осложнение, причиной которого может стать использование высоких дыхательных объемов и вентиляция с показателями FiO2 более 60%, что приводит к циклическому перерастяжению альвеол, выделению воспалительных маркеров и образованию свободных радикалов с последующим развитием местной воспалительной реакции и разрушением альвеолярно-капиллярной мембраны. Следовательно, защитная стратегия легких при ИВЛ должна включать использование дыхательного объема из расчета 6–8 мл/кг; значения РЕЕР 5–8 мм вод.ст.; использование наименьшего значения FiO2, обеспечивающего удовлетворительную периферическую оксигенацию крови (SaO2 >90%), для предотвращения окислительного повреждения легких [11].
ИВЛ-индуцированное повреждение легких – еще одно осложнение, причиной которого может стать использование высоких дыхательных объемов и вентиляция с показателями FiO2 более 60%, что приводит к циклическому перерастяжению альвеол, выделению воспалительных маркеров и образованию свободных радикалов с последующим развитием местной воспалительной реакции и разрушением альвеолярно-капиллярной мембраны. Следовательно, защитная стратегия легких при ИВЛ должна включать использование дыхательного объема из расчета 6–8 мл/кг; значения РЕЕР 5–8 мм вод.ст.; использование наименьшего значения FiO2, обеспечивающего удовлетворительную периферическую оксигенацию крови (SaO2 >90%), для предотвращения окислительного повреждения легких [11].
При выделении группы пациентов с факторами риска респираторных осложнений затруднительным остается количественная оценка развития данных осложнений. Лабораторные показатели, определение газов артериальной крови, функцио-нальные легочные тесты и рентгенологические методы исследования легких не являются обязательными, если не нацелены на определенный диагностический поиск имеющихся изменений при объективном осмотре [3]. Группой исследователей на большой выборке пациентов была разработана шкала риска развития ДН, представленная преимущественно клиническими показателями (табл. 3) [12].
Развитие обструкции верхних дыхательных путей в периоперационном периоде чаще всего обусловлено неадекватным восстановлением дыхательных рефлексов и тонуса дыхательной мускулатуры. Клиническими проявлениями является слабая дыхательная экскурсия грудной клетки, дискоординация дыхательной мускулатуры грудной и брюшной стенки. Признаками частичной обструкции может быть появление стридора или эпизоды апноэ. К группе риска относят пациентов с ОАС, аномалиями развития черепа, ожирением, акромегалией, гипертрофией миндалин [3].
ПЕРИОПЕРАЦИОННАЯ ОБСТРУКЦИЯ ДЫХАТЕЛЬНЫХ ПУТЕЙ И ГИПОВЕНТИЛЯЦИЯ
Можно выделить несколько видов обструкции верхних дыхательных путей. Наиболее частая причина – фарингеальная обструкция, которая происходит за счет западения языка и снижения глоточного рефлекса у пациентов без сознания. Мышцы – дилататоры верхних дыхательных путей (подбородочно-язычная и мышца, напрягающая нёбную занавеску) обеспечивают воздушную проходимость в ответ на отрицательное давление, создаваемое в глотке во время вдоха. Резидуальное действие анестетиков после операции может приводить к нервно-мышечной блокаде данной мускулатуры, вызывая их дисфункцию и обусловливая явления ДН. Как правило, фарингеальная обструкция легко поддается коррекции путем наклона головы вниз и выдвижением нижней челюсти или использованием специальных воздуховодов [3, 13].
Другим видом дыхательной обструкции является развитие ларингоспазма, обусловленное тоническими интенсивными сокращениями мышц и прогибом надгортанника с перекрытием просвета гортани в ответ на действие раздражающего фактора. Нарушение дыхания также может быть обусловлено парезом гортани, который возникает при повреждении возвратного гортанного нерва или механического повреждения голосовых связок. Данные осложнения могут возникнуть при проведении операций на щитовидной и паращитовидных железах, торакальных вмешательствах, а также при выполнении бронхоскопии жестким эндоскопом и интубации [14]. При наличии ларингоспазма эффективно проведение вентиляции при помощи мешка Амбу на непродолжительный срок с полным восстановлением дыхательной проходимости, при наличии пареза гортани требуется проведение ИВЛ с формированием трахеостомы. Отек гортани чаще встречается у детей (за счет меньшего объема дыхательных путей) после продолжительных оперативных вмешательств с массивной инфузионной терапией или при позиционных движениях головы. В большинстве случаев лечение отека гортани включает комплекс следующих мероприятий: дополнительную оксигенацию, вертикальное положение пациента (если он в сознании) для обеспечения венозного оттока, ограничение объема вводимой жидкости, форсированный диурез, введение ингаляционно 2,25% раствора адреналина, внутривенно дексаметазона (до 8 мг каждые 6 ч на протяжении первых суток). В тяжелых случаях прибегают к повторной интубации и проведению ИВЛ [3, 14, 15].
Реже причиной бронхиальной обструкции может быть наружная компрессия дыхательных путей, возникающая за счет развития гематом, после операций на щитовидной и паращитовидных железах, каротидной эндартерэктомии. Давление, обусловленное наличием гематомы, нарушает венозный и лимфатический отток, что приводит к развитию отека. Клиническими проявлениями компрессии дыхательных путей может быть появление локальных болезненных ощущений, дисфагия, одышка, появление стридорозного дыхания. Для купирования явления ДН рекомендовано выполнение интубации пациента, проведение ИВЛ с одновременным устранением причины, вызвавшей компрессию [3].
Необходимо помнить о возможности развития гиповентиляции в послеоперационном периоде, которая возникает из-за низкой альвеолярной вентиляции в результате гиперкапнии (PaCO2 >45 мм рт.ст.) и респираторного ацидоза. Клинические проявления гиповентиляции могут варьировать от заторможенности пациента и поверхностного дыхания до развития сердечно-легочной недостаточности. Тяжелый респираторный ацидоз может вызвать гипотензию и ишемию миокарда. Даже легкая гиперкапния не должна допускаться у пациентов с анамнезом респираторных и сердечно-сосудистых заболеваний, например, при легочной гипертензии [3]. Пульсоксиметрия служит простым и доступным методом наблюдения за адекватной оксигенацией пациента. J. Canet et al. показано, что уровень SpO2=91–95% повышает риск развития респираторных осложнений в 2 раза, а уровень SpO2 ≤90% – в 10 раз. Угнетению дыхания в таких случаях может способствовать использование опиоидных препаратов, бензодиазепинов. Наиболее простым методом коррекции в данной ситуации является пролонгирование ИВЛ до момента полного элиминирования препаратов. При необходимости возможно использование своеобразных антидотов: налоксона в дозе от 0,04 до 0,08 мг (более высокие дозы могут вызывать артериальную гипертензию, отек легких, ишемию миокарда), флумазенила (нейтрализация седативного эффекта бензодиазепинов) в дозе от 0,2 до 1 мг в/в каждые 5 мин, максимально до 5 мг [16].
ОСЛОЖНЕНИЯ СО СТОРОНЫ ЦНС И ГИПОКСЕМИЯ
Заболевания центральной нервной системы – достаточно редкая причина гиповентиляции в послеоперационном периоде. К ним относят развитие острого нарушения мозгового кровообращения (ОНМК) по ишемическому или геморрагическому типу, наличие объемного образования головного мозга различной этиологии. Развитие ДН также может быть обусловлено дисфункцией дыхательной мускулатуры грудной клетки и диафрагмы, болевым синдром (за счет ограничения глубокого вдоха и выдоха). В данном случае гиповентиляция возникает при наличии респираторного ацидоза, в сочетании этих факторов со сниженной ФОЕЛ (сопутствующее заболевание дыхательной и нервно-мышечной системы).
У таких пациентов возникает десатурация, тахипноэ, общая слабость. Прием ряда лекарственных препаратов (аминогликозиды, тетрациклины, блокаторы кальциевых каналов, магнезия, ингибиторы холинэстеразы, некоторые антиаритмические препараты и др.), электролитные нарушения (гипокалиемия, гипокальциемия, гипернатриемия), ацидоз, печеночная и почечная недостаточность, нейромышечные заболевания (миастения, миотоническая дистрофия) обусловливают развитие гиповентиляции [3, 7].
Гипоксемия встречается достаточно часто в послеоперационном периоде. В ряде исследований было показано, что от 30 до 50% пациентов, доставленных в отделение реанимации и интенсивной терапии (ОРИТ) сразу после операции, имели хотя бы один эпизод десатурации <90% [17]. Наличие гипоксемии определяется путем измерения пульсоксиметрии. Первыми клиническими проявлениями могут быть беспокойство пациента и спутанность сознания, в дальнейшим присоединяется одышка и тахикардия. Брадикардия, гипотония и цианоз являются более поздними симп-томами ДН. Развитие гипоксемии возможно при наличии ателектазов, гиповентиляции, отека легких, аспирации, пневмоторакса и тромбоэмболии легочной артерии (ТЭЛА). Отек легких может быть обусловлен повышением сосудистого гидростатического давления и проницаемости сосудистой стенки и снижением интерстициального гидростатического давления. Развитие пневмоторакса возможно при травмах грудной клетки, установке центрального венозного доступа, проведении операций в области шеи, интраабдоминальных и ретроперитонеальных вмешательствах с вовлечением диафрагмы. ТЭЛА – редкая причина послеоперационной гипоксемии, но может возникать при наличии у пациента онкологического процесса, сочетанной травмы, тромбоза глубоких вен нижних конечностей, операций на интракраниальных сосудах (воздушная эмболия). Основным лечением гипоксемии является обеспечение адекватной оксигенации, при необходимости проведение ИВЛ с устранением по возможности причины, вызвавшей ее развитие [3, 16, 18].
В настоящее время частота периоперационных респираторных осложнений в мире остается высокой, что обусловливает актуальность представленной темы. Несмотря на проводимые многочисленные исследования, в практике врача нет единой шкалы – инструмента для прогнозирования развития данных осложнений. Поэтому важным остается консультирование пациента терапевтом и анестезиологом перед планируемым оперативным вмешательством для выделения имеющихся модифицируемых и немодифицируемых факторов риска и возможности их коррекции с учетом особенностей планируемой операции.


