В настоящее время ожирение стало одной из важнейших медико-социальных проблем в Российской Федерации (РФ). Так, по данным Всемирной организации здравоохранения (ВОЗ), в 2013 г. распространенность избыточной массы тела и ожирения в российской популяции составили 59,2 и 24,1% соответственно [1]. По данным доклада ООН, в том же 2013 г. Россия занимала 19-е место в мире по распространенности ожирения, отставая от возглавлявших список Мексики и США всего на 8%. Согласно результатам многоцентрового (11 регионов РФ) наблюдательного исследования ЭССЕ-РФ (эпидемиология сердечно-сосудистых заболеваний и их факторов риска в регионах РФ) с участием 25 224 человек в возрасте 25–64 лет, встречаемость ожирения в популяции составила 29,7% [2].
За последние три десятилетия распространенность избыточной массы тела и ожирения в мире среди взрослых и детей выросла почти на 30–50%. С учетом увеличения количества лиц с ожирением в мире приблизительно на 1% в год ближайшие перспективы не выглядят оптимистичными. Предполагается, что при сохранении существующих темпов роста этого заболевания к 2030 г. доля взрослого населения нашей страны с избыточной массой тела составит более 85%, из них более половины будут страдать ожирением.
Уже сегодня ожирение сродни глобальной пандемии. В 2015 г. более 2,7 млрд человек в мире имели избыточную массу тела и более 700 млн – ожирение. Доля людей с индексом массы тела (ИМТ) >25 кг/м2 в США составляет 68%, в странах западной Европы – 55%. При этом распространенность и ожирения, и избыточного питания в среднем на 5–10% выше среди женщин [3].
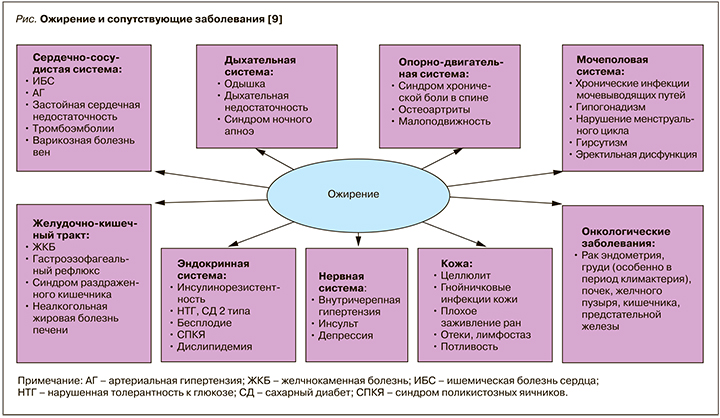
По данным ВОЗ, избыточная масса тела и ожирение предопределяют развитие до 44–57% всех случаев сахарного диабета (СД) 2 типа, 17–23% случаев ишемической болезни сердца, 17% — артериальной гипертензии [4]. При этом в настоящее время ожирение рассматривается не только как важнейший фактор риска сердечно-сосудистых заболеваний и СД 2 типа, но и нарушения репродуктивной функции, а также повышенного риска развития онкологических заболеваний [5, 6] (рис.). В целом ожирение, по экспертным оценкам, приводит к увеличению риска сердечно-сосудистой смертности в 4 раза, а смертности в результате онкологических заболеваний – в 2 раза [7, 8].
ДИСФУНКЦИЯ ЖИРОВОЙ ТКАНИ КАК ГЛАВНЫЙ ФАКТОР КАРДИОМЕТАБОЛИЧЕСКОГО РИСКА
Жировая ткань – главный метаболический субстрат организма. Основная роль этой ткани заключается в отложении про запас энергии в форме триглицеридов c ее выделением в виде свободных жирных кислот в зависимости от потребностей организма. Кроме того, жировая ткань обладает термоизолирующим свойством, что также определяет ее существенный вклад в поддержание энергетического баланса тела [10].
Помимо содержания адипоцитов, жировая ткань хорошо васкуляризована и иннервирована, содержит соединительнотканную матрицу и многочисленные иммунные клетки, включая макрофаги [11, 12]. Первоначально считалось, что жировая ткань служит пассивным депо для хранения энергии, в настоящее же время известно, что она выделяет значительное число различных веществ, которые во многом определяют метаболический гомеостаз. К ним относятся лептин, адипонектин, резистин, фактор некроза опухоли альфа (ФНО-α), интерлейкин-6 (ИЛ-6), моноцитарный хемоаттрактантный белок-1 (MCP-1; также известный как CCL2), ингибитор активатора плазминогена-1 (PAI-1), ангиотензиноген, ретинол-связывающий белок-4, сывороточный амилоид а (SAA) и целый ряд других факторов [13, 14].
Таким образом, жировая ткань является сложным и активным секреторным органом, который одновременно посылает и принимает сигналы, модулирующие расход энергии, аппетит, чувствительность к инсулину, эндокринные и репродуктивные функции, метаболизм костей, воспаление и иммунитет.
Избыточное развитие жировой ткани, особенно в висцеральной области, прямо коррелирует с инсулинорезистентностью, гипергликемией, дислипидемией, артериальной гипертензией, протромботическим и провоспалительным состояниями.
Настоящая работа посвящена анализу эффективности коррекции дисфункции жировой ткани как главного фактора кардиометаболических рисков при использовании различных подходов к лечению ожирения.
МЕТОДЫ КОРРЕКЦИИ ИЗБЫТОЧНОГО ВЕСА
Существующие подходы к коррекции избыточного веса у больных ожирением могут быть классифицированы на три большие группы:
- 1. Методики снижения избыточного веса путем изменения образа жизни.
- 2. Применение препаратов при неэффективности немедикаментозных методов лечения (критерием этой неэффективности служит снижение массы тела менее чем на 5% в течение 3 мес лечения).
- 3. Снижение массы тела и вмешательство в обмен веществ методами бариатрической хирургии.
ИЗМЕНЕНИЕ ОБРАЗА ЖИЗНИ
Принципиальная возможность снизить вес, устранить или значительно уменьшить дисфункцию жировой ткани, улучшить гликемический контроль, повысить чувствительность к инсулину и скорректировать факторы риска сердечно-сосудистых заболеваний за счет коррекции диеты и физической активности продемонстрирована во многих исследованиях. Вместе с тем степень их доказательности можно подвергнуть критике из-за недостаточной стандартизации метода, отсутствия рандомизации и контроля, короткого периода наблюдения либо обсервационного характера самого протокола.
Эти противоречия планировалось преодолеть в масштабном проспективном многоцентровом рандомизированном контролируемом исследовании с мотивирующим названием Look AHEAD [15]. Оно охватило более 5000 пациентов с СД 2 типа и ожирением, которые случайным образом распределялись в группу интенсивной модификации образа жизни (рестриктивная диета и физическая активность) либо в группу традиционной терапии и обучения при диабете, которая использовалась в качестве контрольной. Главный акцент делался на использовании стандартизированной и применимой на практике стратегии снижения веса и оценке его влиянии на частоту неблагоприятных сердечно-сосудистых событий и летальность. Несмотря на впечатляющие результаты в уменьшении веса (-8,6 %) и уровня гликированного гемоглобина (HbA1c), полученные в течение первого года, когда осуществлялись наиболее интенсивное обучение и мотивирование, а также тщательное наблюдение за выполнением пациентами требований протокола, в последующие годы положительные эффекты заметно нивелировались, а само исследование было остановлено через 11,5 лет из-за отсутствия сколько-нибудь значимого снижения частоты первичной конечной точки. Возможные причины этой неудачи продолжают активно обсуждаться, тем не менее исследование показало ряд преимуществ активного изменения образа жизни при СД 2 типа и ожирении в отношении качества контроля углеводного и липидного обмена, повышения чувствительности к инсулину, уменьшения частоты апноэ во сне, потребности в медикаментах и улучшения качества жизни [16]. Кроме того, проведенный недавно post-hoc-анализ продемонстрировал, что среди пациентов, достигших и удержавших снижение веса более 10%, частота неблагоприятных кардиоваскулярных исходов (3P-MACE) достоверно снизилась на 21% [17].
Опираясь на гипотезу о том, что эффективность снижения факторов кардиоваскулярного риска зависит от устойчивости первоначального снижения массы тела, в Джослиновском диабетологическом центре (США) было проведено 5-летнее исследование по уменьшению массы тела у больных СД 2 типа и ожирением с использованием программы Why WAIT [18]. Ее активная фаза продолжалась 12 нед, а через год от начала исследования пациенты были разделены на две группы в зависимости от величины и стойкости снижения веса. В результате установлено, что больные СД 2 типа и ожирением, удержавшие к концу года снижение веса на 7% и более (68 из 129 испытуемых, или 52,7%), успешно сохраняли его и в дальнейшем, что сопровождалось снижением ЛПНП и повышением ЛПВП, тогда как первоначальное снижение триглицеридов и HbA1c оказалось нестойким. Количество пациентов, требовавших инсулинотерапии, уменьшилось в группе со стойким снижением веса и увеличилось среди тех, кто не смог удержать достигнутую массу тела в течение первого года.
Помимо уже завершившихся исследований, заслуживает внимание программа DiRECT, которая преследует амбициозную цель – достичь ремиссии СД 2 типа путем использования сбалансированного сверхнизкокалорийного искусственного питания (600 ккал/сут) с последующим переходом на средиземноморскую диету для удержания эффекта [19]. Результаты первого года исследования, представленные в декабре 2017 г., демонстрируют достижение ремиссии СД 2 типа в 46% случаев (68 пациентов) в группе обследуемых, снизивших вес в среднем на 10 кг. К концу 2-го года исследования ремиссии СД 2 типа достигли 53 (36%) испытуемых, 36 (24%) сохранили потерю веса не менее 10 кг [19].
Таким образом, снижение массы тела путем интенсивной модификации образа жизни способно уменьшить дисфункцию жировой ткани, инсулинорезистентность и риск сердечно-сосудистых осложнений у больных СД 2 типа и ожирением, а также привести к развитию стойкой ремиссии диабета, однако примерно в половине случаев возникают существенные трудности в долгосрочном удержании достигнутых результатов. Тем не менее дешевизна и безопасность этого вида лечения позволяют рекомендовать его максимальному количеству пациентов.
ПРИМЕНЕНИЕ МЕДИКАМЕНТОЗНОЙ ТЕРАПИИ
Новым и активно развивающимся направлением в лечении ожирения является использование агонистов рецепторов глюкагоноподобного пептида-1 (аГПП-1), представленных эксенатидом, дулаглутидом, албиглутидом, лираглутидом, семаглутидом и ликсисенатидом. Длительное применение этих препаратов приводит к значимому снижению массы тела и сопровождается приростом общего инсулинстимулированного усвоения глюкозы [20]. Очевидно, что, как и в случае с метформином, восстановление чувствительности к инсулину на фоне лечения аГПП-1 происходит за счет снижения эффекта липотоксичности в мышечной и печеночной тканях на фоне снижения веса. Похудание, которое сочетается с усилением секреции инсулина, объясняется тем, что рецепторы ГПП-1 присутствуют не только в островках поджелудочной железы, но и в гипоталамусе, подавляя чувство голода, а также в желудке, замедляя его опорожнение [21]. Кроме того, инкретиновые рецепторы представлены в кардиомиоцитах, клетках эндотелия и гладкомышечных клетках сосудов [22]. Результаты экспериментальных и клинических работ свидетельствуют о способности эксенатида и лираглутида, независимо от сахароснижающего действия и снижения массы тела, оказывать протективный эффект в отношении эндотелиоцитов, который может реализоваться путем активации eNOS, подавления ФНО-α, ингибитора активатора плазминогена-1, различных ростовых факторов и молекул адгезии. Внутриклеточный механизм этого многообразия эффектов до конца не выяснен, но его итогом может быть регресс эндотелиальной дисфункции, снижение артериального давления, регресс атеросклероза, ограничение размеров инфаркта миокарда, улучшение систолической и диастолической функции левого желудочка сердца [22, 23, 24].
Способность сахароснижающих препаратов из группы аГПП-1 уменьшать кардиоваскулярные риски убедительно доказана в больших проспективных исследованиях. Так, в исследовании LEADER [24] более 9 тыс. пациентов с СД 2 типа и высоким риском сердечно-сосудистых осложнений в течение в среднем на протяжении 3,8 лет ежедневно получали инъекции лираглутида или плацебо. Результатом стало достоверное снижение общей и сердечно-сосудистой летальности на 13%, при этом наиболее выраженный эффект наблюдался в подгруппе больных, имевших подтвержденные сердечно-сосудистые заболевания уже на момент начала лечения.
Исследование SUSTAIN-6 было регистрационным для нового препарата данной группы – семаглутида [25] – и не предполагало выявления превосходства препарата над плацебо. Тем не менее в результате лечения у более 1600 человек в течение 2 лет было достигнуто еще большее, чем в случае с лираглутидом, снижение первичной конечной точки (сердечно-сосудистой смертности, нефатальных инфаркта и инсульта) – на 26% относительно плацебо. Наблюдавшиеся в обоих исследованиях позитивные изменения факторов кардиоваскулярного риска – снижение массы тела, артериального давления, частоты сердечных сокращений – не были значительными и, по мнению исследователей, не могут в полной мере объяснить достигнутое снижение заболеваемости и смертности. По-видимому, наряду с коррекцией инсулинорезистентности и ее проявлений лираглутид и семаглутид обладают прямым кардио- и ангиопротективным эффектом, однако на сегодня только лираглутид среди аГПП-1 статистически значимо снижает сердечно-сосудистую смертность больных СД 2 типа. Эти свойства в совокупности с удобством использования (многие препараты вводятся 1 раз в неделю) могли бы вывести аГПП-1 в препараты первой линии терапии у больных с ожирением и СД 2 типа, если бы не их весьма высокая стоимость.
С учетом того что ожирение нередко связано с функциональными нарушениями в гипоталамусе и другими центрами, отвечающими за пищевое поведение, а также с нарушениями метаболизма определенных нейтротрансмиттеров, при лечении ожирения целесообразно использовать препараты с центральным механизмом действия [26, 27]. Единственный зарегистрированный в России препарат из этой группы для лечения ожирения – сибутрамин, который относится к селективным ингибиторам обратного захвата серотонина и норадреналина в синаптических щелях нейронов головного мозга. Препарат усиливает и продлевает чувство насыщения и таким образом снижает количество потребляемой пищи. Сибутрамин не влияет на дофаминергические системы мозга и не вызывает зависимости, привыкания и синдрома отмены.
Опыт применения сибутрамина в России обобщен в крупном исследовании PRIMAVERA, завершенном в 2018 г. Целью его стала оценка эффективности и безопасности длительного приема сибутрамина в повседневной клинической практике у пациентов с ожирением, а также изучение спектра нежелательных явлений препарата в российской популяции. В исследовании принимали участие почти 100 000 пациентов из 142 городов России (средний возраст 39,4±10,4 года, 82,3% женщин и 17,7% мужчин). Средняя масса тела пациентов составила 99,1±14,28 кг, среднее значение ИМТ 35,7±4,41 кг/м2. Основные сопутствующие патологии в исследуемой популяции включали СД 2 типа (18,8%), гинекологические заболевания (9,8%), артериальную гипертензию, контролируемую гипотензивными препаратами (6,5%), дислипидемию (4,8%), нарушение толерантности к глюкозе (3,3%). Длительность терапии сибутрамином определялась лечащим врачом и составляла 6 мес у 59,3 % пациентов, 12 мес – у 37,7 %, 3 мес – у 3% пациентов. Снижение ИМТ коррелировало с длительностью лечения и составило 3,4±1,53 кг/м2 после 3 мес терапии, 5,4±2,22 кг/м2 – после 6 мес и 7,2±3,07 кг/м2 – после 12 мес лечения. Относительное снижение массы тела после 3, 6 и 12 мес терапии было равно 9,5; 15,1 и 19,7% соответственно. Клинически значимые результаты (снижение массы тела на 5% и более) были достигнуты в 92,5% случаев.
Уменьшение массы тела на фоне лечения сибутрамином сопровождалось небольшим снижением артериального давления и не вело к значимому увеличению частоты сердечных сокращений [31]. Общая частота развития нежелательных явлений в исследуемой популяции составила 3%, а встречаемость побочных эффектов, имеющих, по мнению лечащих врачей, вероятную или несомненную связь с сибутрамином, была равна всего лишь 1,7%. Таким образом, результаты клинического исследования PRIMAVERA подтвердили отсутствие повышенного кардиоваскулярного риска при использовании сибутрамина в повседневной клинической практике у пациентов с фоновой патологией сердечно-сосудистой системы, а также низкую частоту нежелательных явлений [28].
С учетом позитивных результатов исследования PRIMAVERA было принято решение изучить эффективность и безопасность патогенетически обоснованного комбинированного применения сибутрамина с метформином и микрокристаллической целлюлозой (МКЦ) у пациентов с ожирением и СД 2 типа и/или дислипидемией в рутинной клинической практике России в наблюдательной программе АВРОРА. Популяция наблюдения включала пациентов обоих полов в возрасте 18–65 лет c установленным диагнозом алиментарного ожирения в сочетании с СД 2 типа. Длительность приема комбинированного препарата (сибутрамин+метформин+МКЦ) определялась лечащим врачом и составляла до 6 мес. Препараты назначались в дополнение к имеющейся сахароснижающей терапии, доза метформина корректировалась с учетом потребностей пациента. Всего в программе АВРОРА приняли участие 259 врачей и 5812 больных, находящихся на лечении в 240 лечебных учреждениях из 12 городов России (средний возраст 46,6±10,5 лет, соотношение мужчины/женщины – 24/76%).
Динамика антропометрических показателей свидетельствует о высокой эффективности используемого препарата в отношении снижения массы тела. Так, динамика снижения ИМТ за 3 мес терапии составила 3,4±1,5 кг/м2 (в среднем 9,5±4,2 кг), в группе 6-месячной терапии удалось добиться снижения ИМТ на 5,4±2,3 кг/м2 (15,1±6,4 кг). Снижение окружности талии за 3 и 6 мес терапии в среднем составило 7,8±4,8 и 13,8±7,4 см соответственно, что свидетельствует в пользу целесо-образности более длительной терапии комбинацией сибутрамин+метформин+МКЦ для снижения количества висцерального жира и уменьшения риска развития осложнений СД 2 типа. Стоит отметить, что добавление этого комбинированного препарата к базовой терапии СД 2 типа позволяло добиться значимого снижения веса даже в группе пациентов, принимающих терапию, негативно влияющую на массу тела (препараты сульфонилмочевины). Кроме того, наблюдалось снижение показателей гликемического контроля и липидного обмена вплоть до целевых значений [29].
В рамках программы АВРОРА была продемонстрирована хорошая переносимость оцениваемого препарата. Нежелательные явления были зарегистрированы у 295 человек (5,1%), причем, по мнению врачей, внутри этой когорты пациентов причинно-следственная связь побочных эффектов с приемом комбинации сибутрамин+метформин+МКЦ может быть оценена как вероятная или определенная только у 35,3% пациентов (n=104), как возможная (т.е. не исключающая и других причин) – у 30,2 % (n=89). Наиболее частые нежелательные явления распределились следующим образом: сухость во рту – 48,8%, головные боли – 13,8%, тахикардия – 7,9%, тошнота – 7,9%, диспепсические явления – 7,9%, нарушения сна – 5,9%, повышение артериального давления – 3,9%, запор – 3,9%. Как правило, эти явления были выражены слабо и уменьшались по мере продолжения приема препарата.
Приведенные результаты свидетельствуют, что прием сибутрамина в комбинации с метформином и МКЦ на фоне базовой сахароснижающей терапии у пациентов с СД 2 типа и ожирением обес-печивает эффективное и безопасное снижение массы тела и способствует повышению эффективности лечения вплоть до достижения целевых значений показателей углеводного и липидного обменов [29].
БАРИАТРИЧЕСКАЯ ХИРУРГИЯ
При всем многообразии консервативных методов лечения ожирение представляет серьезную терапевтическую проблему. Бариатрическая хирургия – это довольно разнородная по технике, эффективности и безопасности группа оперативных вмешательств на желудочно-кишечном тракте, которые приводят либо к уменьшению объема желудка (рестриктивные операции), либо к выключению из пассажа пищи части тонкого кишечника (шунтирующие, или мальабсорбтивные, операции) либо сочетают в себе оба эти эффекта (комбинированные вмешательства). Детальное описание различных операций, их техник и модификаций приводится в классических руководствах и входит в задачи нашего обзора. Эффективность комбинированных бариатрических операций чрезвычайно высока: выраженное и стойкое снижение массы тела достигается у подавляющего большинства пациентов [30].
Кроме того, по мере накопления опыта успешных вмешательств стало очевидно, что эффект от метаболической хирургии не ограничивается снижением массы тела. Прежде всего это реальная возможность ремиссии или по крайней мере улучшения течения диабета, появляющаяся у большинства пациентов с сочетанием СД 2 типа и ожирения [30, 31, 32]. Данный феномен наблюдается при всех вариантах операций, однако в случае рестриктивного вмешательства улучшение углеводного обмена происходит параллельно со снижением массы тела, тогда как после комбинированных операций ремиссия СД 2 типа значительно опережает бариатрический эффект по времени и выраженности [33]. Природа этого явления понятна не до конца и активно изучается. Существующие гипотезы среди причин называют как вполне очевидные механизмы (ограничения в питании перед и особенно после шунтирующих операций, непосредственное уменьшение всасывания глюкозы), так и снижение инсулинорезистентности вследствие уменьшения поступления в организм свободных жирных кислот, а также различные изменения секреции кишечных гормонов (повышение инкретинов и аноректиков, снижение стимуляторов аппетита), связанные с выключением из пассажа пищи определенных участков тонкой кишки [33, 34, 35], улучшение профиля адипокинов [36], увеличение всасывания желчных кислот и опосредованные этим фактором метаболические эффекты [37] и даже изменение кишечной микробиоты [38].
Накоплен значительный массив данных по благоприятному влиянию бариатрических операций на факторы риска сердечно-сосудистых заболеваний. Ряд метаанализов позволил сделать вывод, что бариатрическая хирургия приводит к значительной краткосрочной потере веса (≈41 кг за 30 дней) [38, 39]. Доля пациентов с ремиссией СД 2 типа составила 77%, с устранением артериальной гипертензии – 62%, с существенным улучшением гиперлипидемии – ≥70% [40, 41].
Что касается отдаленных последствий, то в результате метаанализа рандомизированных клинических исследований с 2-летним наблюдением также было установлено, что бариатрическая хирургия приводит к существенной потере веса (≈26 кг) и ремиссии СД [42]. Другое исследование выявило ее способность улучшать контроль над факторами риска сердечно-сосудистых заболеваний с частотой ремиссии 73% при СД 2 типа, 63% – при артериальной гипертензии и 65% – при гиперлипидемии [43]. Кроме того, крупное проспективное когортное исследование продемонстрировало: бариатрическая хирургия снижает совокупность показателей смертности, частоты инфаркта миокарда и инсульта (отношение рисков [HR] 0,67) [44]. При изучении долгосрочной эффективности бариатрической хирургии в отношении летальности соответствующее ретроспективное исследование (медиана наблюдения 7,1 года) показало, что этот метод может снизить общую смертность на 40%, смертность из-за ИБС – на 56%, из-за СД – на 92%, из-за онкологической патологии – на 60% [44].
К сожалению, высокая эффективность бариатрической хирургии в лечении СД 2 типа и ожирения дается ценой риска послеоперационных осложнений, как ранних, так и отдаленных. Ранние осложнения в этом случае в целом те же, что и при любых полостных операциях на органах ЖКТ – рвота, несостоятельность анастомозов, их изъязвления и стенозы, кровотечения, раневая инфекция, перитонит, тромбоэмболия легочной артерии, пневмонии. Впрочем, по мере совершенствования хирургических техник эти осложнения развиваются все реже, а периоперационная летальность за последние 30 лет снизилась с 2–5 до 0,3%.
Поздние осложнения бариатрической хирургии более специфичны и напрямую связаны с характером вмешательства. Это может быть постбариатрическая гипогликемия (в том числе вследствие редких, но тяжелых случаев незидиобластоза), мальабсорбция с развитием тяжелого дефицита витаминов и микроэлементов, что, как правило, требует пожизненной заместительной терапии, а иногда вынуждает идти на повторную операцию с реверсией шунта и в случае незидиобластоза с резекцией поджелудочной железы. Все эти факторы в совокупности со значительными диетическими ограничениями могут снижать качество жизни, однако, несмотря на это, бариатрическая хирургия все равно остается единственной стратегией, обес-печивающей существенное и долгосрочное снижение массы тела, наряду с улучшением течения большинства сопутствующих заболеваний.
Критически оценивая резервы консервативной терапии, необходимо принимать во внимание возможность осложнений бариатрической хирургии, необходимость пожизненной курации прооперированных пациентов, соотношение рисков вмешательства и пользы от нее.
ЗАКЛЮЧЕНИЕ
Современные представления о патогенезе ожирения позволяют с уверенностью говорить, что дисфункция жировой ткани выступает одним из главных факторов кардиометаболического риска и сопровождается инсулинорезистентностью, гипергликемией, дислипидемией, артериальной гипертензией, протромботическим и провоспалительным состояниями. В связи с этим она должна служить главной мишенью терапевтических или хирургических интервенций.
В настоящее время получены доказательные данные, свидетельствующие, что эффективное устранение ожирения (снижение массы тела на ≥10%) в результате применения рациональных рестриктивных технологий в питании в сочетании с повышением физической активности и инвазивными (бариатрическими) методами лечения позволяет не только улучшить течение СД 2 типа (с развитием у многих больных ремиссии этого заболевания), но также снизить общую и сердечно-сосудистую смертность.



