К ревматологическим заболеваниям с высокой медико-социальной значимостью относится ревматоидный артрит (РА), характеризующийся большой распространенностью, прогрессирующим характером течения и приводящий к ранней инвалидизации трудоспособного населения. РА – это аутоиммунное ревматическое заболевание неизвестной этиологии, сопровождающееся хроническим эрозивным артритом (синовитом) и системным поражением внутренних органов. Распространенность его среди взрослого населения находится в пределах 0,5–2%, причем у женщин 65 лет достигает ≈5%. Соотношение женщин и мужчин с РА составляет 2–3:1 [1].
С точки зрения теорий патогенеза РА является гетерогенным заболеванием, в развитии которого значительную роль играет воспалительный механизм. Одной из важных составляющих воспаления и тканевой деструкции при этом заболевании служат дефекты клеточного иммунореагирования и гиперпродукция фактора некроза опухоли α (TNF-α).
При РА наблюдается дисбаланс иммунной системы с существенным нарастанием цитотоксических лимфоцитов СD4+ на фоне снижения CD3+ Т-лимфоцитов, повышение уровня иммуноглобулина G. По мере нарастания активности РА интерлейкин 1β (IL-1β) и моноцитарно-хемотаксический протеин 1 (MCP-1) становятся основными предикторами аутоиммунного воспаления, определяя хронизацию процесса [2]. Идет обсуждение роли провоспалительных цитокинов в формировании эндотелиальной дисфункции у больных РА (TNF-α, IL-6, -8, -17 и -18). Чрезмерный синтез TNF-α на ранних стадиях индуцирует развитие эндотелиальной дисфункции, а IL-6 усиливает ее по мере прогрессирования воспаления [3].
В настоящее время качество жизни пациентов с РА определяется не только тяжестью основного заболевания, но и коморбидной патологией, которая встречается до 86% случаев [4]. Среди наиболее часто встречающихся сопутствующих состояний – ожирение и кардиоваскулярные заболевания. Так, при ревматических заболеваниях известно более выраженное развитие атеросклероза, который усугубляет дальнейшее развитие и прогрессирование артериальной гипертензии [5]. Кроме того, описана связь ремоделирования левого желудочка с показателями активности артрита [6]. В свою очередь, кардиоваскулярная патология является основной причиной смерти пациентов.
Согласно современным представлениям, взаимосвязь ожирения с кардиоваскулярными рисками не вызывает сомнений. Кроме того, ожирение занимает особое место среди коморбидных факторов, отягощающих течение РА. В последние годы происходит изменение представлений о пациенте с РА как о человеке с дефицитом массы тела. Так, в некоторых когортах доля больных РА с избыточной массой тела и ожирением достигает 63–68%, тогда как недостаток массы тела встречается всего у 1–13% пациентов. По данным Норфолкского регистра, среди больных с ранним РА ожирение имели 25% пациентов [7].
По данным экспертов ВОЗ, ожирение – причина ≈10% смертей в Европе. Жировая ткань – это не только источник энергии и амортизатор внутренних органов; прежде всего это эндокринный орган, способный продуцировать огромное число различных про- и антивоспалительных цитокинов и более 50 гормональных факторов. Провоспалительные цитокины способны увеличивать выработку адипоцитокинов, которые, в свою очередь, опосредованно способствуют возникновению воспаления в суставах. D. Xibille-Friedmann et al. обнаружили корреляцию между увеличением уровня лептина и индексом активности DAS28, что свидетельствует о связи РА и ожирения [8, 9].
Влияние ожирения на РА является сложным, поскольку повышает не только риск его развития, но и оказывает влияние на активность и тяжесть уже возникшего заболевания. Подобное сочетание существенно сказывается на общем состоянии организма, повышая риск развития сердечно-сосудистых, неврологических и метаболических нарушений. Сообщается, что наличие высокого индекса массы тела (ИМТ) может увеличить вероятность развития РА у генетически восприимчивых людей и снизить скорость достижения устойчивой ремиссии у пациентов с активным ревматоидным процессом [10, 11].
Цель исследования – изучить влияние массы тела на течение РА и развитие структурно-геометрического ремоделирования миокарда.
МАТЕРИАЛ И МЕТОДЫ
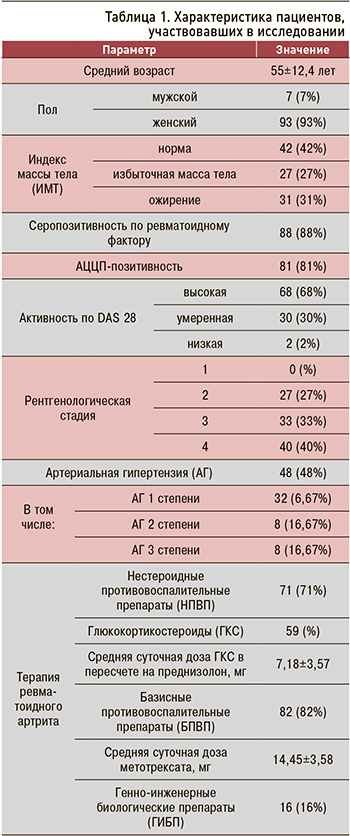
В исследовании приняли участие 100 пациентов (мужчины – 7%, женщины – 93%) в возрасте от 21 до 81 года (средний возраст 55±12,4) с достоверным РА (согласно критериям EULAR, ACR 2010 г.).
Больным проводилось стандартное обследование при суставном синдроме: определение степени боли в суставах по визуально-аналоговой шкале (ВАШ), подсчет числа болезненных и припухших суставов (ЧБС). Оценка активности РА проводилась по шкале DAS 28 (Disease Activity Score). Помимо рутинных лабораторных анализов, пациентам были выполнены специфические для ревматических заболеваний исследования: определение уровня антител к циклическому цитруллинированному пептиду (АЦЦП), С-реактивного белка (СРБ), ревматоидного фактора (РФ), циркулирующих иммунных комплексов (ЦИК), скорости оседания эритроцитов (СОЭ).
 Индекс массы тела рассчитывался по формуле ИМТ=кг/м² с дальнейшим определением степени превышения массы тела. У всех пациентов проводилось измерение артериального давления (АД) на обеих руках. Кроме этого, были выполнены эхокардиография, рентгенография суставов с определением рентгенологической стадии ревматоидного артрита по Kellgren.
Индекс массы тела рассчитывался по формуле ИМТ=кг/м² с дальнейшим определением степени превышения массы тела. У всех пациентов проводилось измерение артериального давления (АД) на обеих руках. Кроме этого, были выполнены эхокардиография, рентгенография суставов с определением рентгенологической стадии ревматоидного артрита по Kellgren.
У всех пациентов было взято информированное добровольное согласие на участие в исследовании. Пациенты с тяжелой органической патологией сердца (пороки сердца, ИБС, кардиомиопатия и т.п.) или декомпенсацией внекардиальных заболеваний (декомпенсированный сахарный диабет и т.п.), которые могли нарушить чистоту исследования, были исключены из него.
Характеристика пациентов представлена в таблице 1. Высокая активность по DAS28 наблюдалась у 68% больных, умеренная – у 30%, низкая – у 2%, позитивность по ревматоидному фактору – у 85%, АЦЦП – у 32% человек. Нестероидные противовоспалительные препараты (НПВП) принимали 71% пациентов. В качестве базисной противовоспалительной терапии (БПВП) 79% больных получали метотрексат, 3% – лефлуномид. Глюкокортикостероиды (ГКС) принимали 59% человек. Терапия генно-инженерными биологическими препаратами (ГИБП) проводилась у 16% пациентов: 13% получали ритуксимаб, 1% – голимумаб, 2% – тоцилизумаб.
Обращает на себя внимание, что в ходе исследования у части пациентов была впервые установлена и задокументирована артериальная гипертензия (АГ). Таким образом, ее распространенность в исследуемой когорте пациентов возросла с 41 до 48%. ИМТ составил от 14,8 до 46,5 кг/м2 (средний 26,8±5,86).
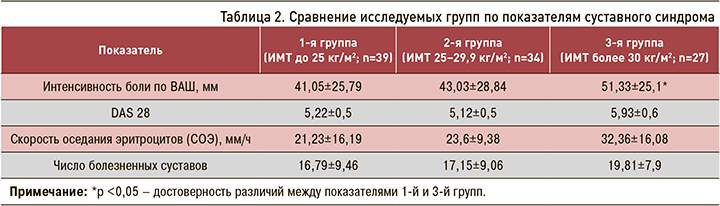
В зависимости от ИМТ пациенты были разделены на три группы: 1-я (n=39) с нормальным весом и ИМТ до 25 кг/м2; 2-я (n=34) с избыточным весом и ИМТ 25–29,9 кг/м2, 3-я (n=27) с ожирением и ИМТ более 30 кг/м2.
Статистическую обработку материала проводили с использованием программы Statistica 13.0 (StatSoft, США). Результаты для описательных характеристик представлены в виде медианы и процентилей 25 и 75% (Ме [Q1; Q3]) или M±σ для непрерывных значений, где М – среднее арифметическое значение, σ – стандартное отклонение. При сравнении двух независимых групп по количественному признаку применяли критерий Манна–Уитни. Корреляционный анализ проводили по методу ранговой корреляции Спирмена с определением коэффициента корреляции r. Для сравнения качественных характеристик в различных группах использовался критерий χ2. Достоверность полученных результатов оценивалась по уровню р <0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Пациенты 1-й и 2-й групп практически не имели достоверных различий по показателям суставного синдрома. Нами было выявлено, что в 3-й группе (ожирение) интенсивность боли по ВАШ была выше по сравнению с 1-й (51,33±25,1 и 41,05±25,79 соответственно; р <0,05) (табл. 2). При этом не было достоверных различий по уровням СРБ, ЦИК, наличию РФ, АЦЦП-позитивности, рентгенологической стадии, средним суточным дозам метилпреднизолона и метотрексата.
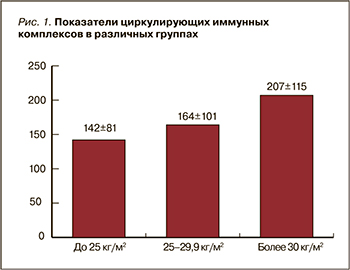
В ходе сравнения трех исследуемых групп была обнаружена тенденция к возрастанию уровня ЦИК от 1-й группы пациентов к 3-й (рис. 1).
 Также отмечалась корреляция между ИМТ и уровнем АД (р <0,01; r=0,34), при этом наибольшее повышение АД наблюдалось у пациентов с установленным ожирением. Так, среднее систолическое АД у пациентов с нормальной массой тела было 118,7±14,77 мм рт.ст., с избыточной массой тела – 126,5±19,4 мм рт.ст., с ожирением – 136,9±22,15 мм рт.ст.
Также отмечалась корреляция между ИМТ и уровнем АД (р <0,01; r=0,34), при этом наибольшее повышение АД наблюдалось у пациентов с установленным ожирением. Так, среднее систолическое АД у пациентов с нормальной массой тела было 118,7±14,77 мм рт.ст., с избыточной массой тела – 126,5±19,4 мм рт.ст., с ожирением – 136,9±22,15 мм рт.ст.
Корреляционный анализ позволил обнаружить прямую, но слабую связь между уровнем боли по ВАШ и конечным диастолическим размером левого желудочка (p <0,05; r=0,138).
Аналогичные данные были получены и при анализе взаимосвязи между интенсивностью боли по ВАШ как с индексом массы миокарда левого желудочка (ИММЛЖ) (p <0,05; r=0,2), так и систолическим АД (p <0,05; r=0,205). Нами была обнаружена прямая слабая корреляция между этими параметрами. Возможно, это связано с тем, что боль выступает активатором симпатоадреналовой системы, которая косвенно влияет на ремоделирование миокарда и уровень АД, а также вызывает дисфункцию эндотелия. Снижение двигательной активности, в свою очередь, способствует прогрессированию набора массы тела, а боль вызывает депрессию у восприимчивых лиц, которая предрасполагает к перееданию [12–14].
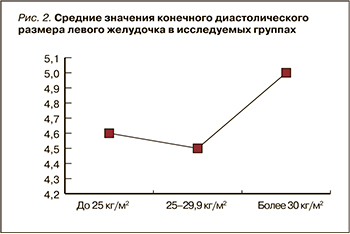 При корреляционном анализе было выявлено, что с повышением ИМТ происходит увеличение конечного диастолического размера левого желудочка (р <0,01; r=0,268) (рис. 2), толщины задней стенки левого желудочка (p <0,05; r=0,375) и толщины межжелудочковой перегородки (р <0,05; r=0,372). Это свидетельствует о том, что с увеличением массы тела у больных РА происходит структурно-геометрическое ремоделирование миокарда и нарушение диастолической функции сердца.
При корреляционном анализе было выявлено, что с повышением ИМТ происходит увеличение конечного диастолического размера левого желудочка (р <0,01; r=0,268) (рис. 2), толщины задней стенки левого желудочка (p <0,05; r=0,375) и толщины межжелудочковой перегородки (р <0,05; r=0,372). Это свидетельствует о том, что с увеличением массы тела у больных РА происходит структурно-геометрическое ремоделирование миокарда и нарушение диастолической функции сердца.
Как известно, ожирение само по себе является предиктором кардиоваскулярных событий. Действительно, различные исследования подтверждают связь между избыточной массой тела и патологическими изменениями в работе сердца, в том числе у лиц с РА. При этом кардиоваскулярные нарушения служат основной причиной повышенного риска смерти этих пациентов. Своевременная диагностика сердечно-сосудистой патологии позволяет снизить частоту фатальных осложнений и улучшить выживаемость больных РА [13, 14].
Стоит отметить, что при сравнении пациентов, длительно и постоянно принимавших НПВП, с больными, принимавшими НПВП редко и эпизодически, достоверных различий между ними по уровню АД обнаружено не было. Это позволило нам предположить, что в исследуемой выборке пациентов интенсивность болевого синдрома и ИМТ имели большее влияние на уровень АД, чем прием НПВП. Это немаловажно, поскольку нередко бытует мнение, что АГ у пациентов с РА становится следствием приема лекарственных средств.
ЗАКЛЮЧЕНИЕ
Таким образом, в нынешнее время РА нередко сочетается с повышенным ИМТ. У пациентов с РА и ожирением интенсивность боли существенно выше. Это сопровождается повышением цифр АД, изменением эхокардиографических параметров, свидетельствующих о развитии структурно-геометрического ремоделирования и нарушения диастолической функции сердца. В связи с этим пациенты с ревматоидным артритом и повышенным ИМТ нуждаются в наблюдении не только ревматолога, но также участкового врача-терапевта и кардиолога для раннего выявления нарушений со стороны сердца.



