Артериальная гипертония (АГ) остается одной из наиболее значимых медико-социальных проблем и является основным фактором риска сердечно-сосудистых заболеваний (ССЗ), занимающих ведущее место в структуре смертности, заболеваемости и инвалидизации населения многих стран мира [1].
Предиктором прогрессирования и осложненного течения АГ служит ремоделирование миокарда (РМ) – одного из патогенетических компонентов регуляции в условиях хронического повышения артериального давления (АД). Основу морфологических изменений при РМ составляют несбалансированные эффекторные механизмы апоптоза и пролиферации кардиомиоцитов с диспропорцио-нальным увеличением внеклеточного матрикса. РМ сопровождается увеличением массы миокарда и размеров желудочков, изменением геометрии камер сердца, нарушениями сократимости миокарда и выступает неблагоприятным прогностическим фактором течения АГ [2, 3].
Развитие дисфункции эндотелия – важный фактор, определяющий течение АГ и развитие ее осложнений. Центральным аспектом дисфункции эндотелия является снижение продукции ключевого эндотелиального вазодилататора оксида азота (NO) и гиперпродукция вазоконстрикторных, проагрегантных и прокоагулянтных субстанций. Изменения метаболизма, такие как окислительный стресс, увеличение провоспалительных цитокинов и вазоконстрикторов у больных АГ, независимо и синергетически способствуют снижению продукции NO и метаболическим нарушениям [4, 5].
Одним из частых сопутствующих проявлений АГ выступает окислительный стресс, который обнаруживается у 57–95% больных АГ и часто клинически проявляется манифестным развитием ишемической болезни сердца и инсульта. В поражении органов-мишеней при АГ существенное значение придается патогенетической роли окислительных процессов и неспецифического эндогенного воспаления [6].
Нарушения структуры и функции клеточных мембран при дисфункции эндотелия и окислительном стрессе, сопровождающие течение АГ, играют определяющую роль в развитии нарушений липидного профиля, атеросклеротического поражения стенки сосудов и ремоделирования миокарда. Важную роль в развитии окислительного повреждения клеток и субклеточных структур играют активные формы кислорода и азота – закиси, перекиси и органические радикалы [7, 8].
В условиях умеренной гипоксии продукция NO возрастает за счет адаптационных процессов: активации NO-синтаз, нитритредуктазной активности металлопротеидов и ферментов, эритроцитоза, депонирования NO и других адаптивных процессов [9, 10].
Цель исследования – изучить особенности дисфункции эндотелия и липидного профиля плазмы крови при РМ у больных АГ в условиях высокогорья.
МАТЕРИАЛ И МЕТОДЫ
В высокогорных районах Приэльбрусья (2200–3400 м над уровнем моря) обследовано 200 коренных жителей, которые были разделены на следующие группы:
- 60 больных АГ 1 степени (28 мужчин и 32 женщин, возраст 49,3±2,8 лет), индекс массы тела (ИМТ) 24,6±0,3 кг/м2.
- 65 больных АГ 2 степени (31 мужчин и 34 женщин, возраст 55,2±2,7 года), ИМТ 23,9±0,8 кг/м2.
- Контрольная группа: 75 здоровых лиц (35 мужчин и 40 женщин, возраст 46,8±3,2 лет), ИМТ 23,2±0,6 кг/м2.
Исследование проводилось в соответствии с этическими принципами Хельсинкской декларации Всемирной медицинской ассоциации (2008). Все пациенты были ознакомлены с методиками исследований, дали информированное согласие для дальнейшего их проведения до рандомизации. Исследование было одобрено локальным этическим комитетом (протокол № 63 от 27.03.2014).
Диагноз АГ, стратификацию факторов риска и общего риска определяли в соответствии с рекомендациями Рабочей группы по лечению АГ Европейского общества гипертонии и Европейского общества кардиологов (ESH/ESC) 2018 г. [11].
Критериями исключения из исследования были больные АГ с уровнем САД >180 и ДАД >110 мм рт.ст., пациенты с симптоматической гипертензией, метаболическими и эндокринными заболеваниями, признаками сопутствующих воспалительных заболеваний, нарушениями ритма и проводимости сердца, выявленной стенокардией и/или постинфарктным кардиосклерозом в анамнезе, больные с ассоциированными состояниями в анамнезе. Для исключения синдрома «белого халата» обследование проводили в обычной одежде.
Всем пациентам было проведено общее клиническое, лабораторно-инструментальное и биохимическое обследование. Состояние сердечно-сосудистой системы оценивали с помощью электрокардиографии Nihon Cohden FQW210-3-140 (Япония). Систолическое (АДс, мм рт.ст.), диастолическое (АДд, мм рт.ст.) и среднединамическое АД (АДср, мм рт.ст.) определялись с помощью автоматических тонометров Omron М2 (Япония) и суточными многофункциональными портативными носимыми мониторами ЭКГ и АД – МЭКГ – ПН – МС «ДМС»-«СОЮЗ», «ДМС – Передовые технологии» (Россия). Анализ средневзвешенной вариабельности ритма (СВВР, мс), скорость распространения пульсовой волны (PWV, м/с) рассчитывали с использованием программы «ДМС – Союз 2013» (Россия).
Эхокардиографию (ЭхоКГ) проводили в М –, В –, М/В –, М/В/D – режимах, в сечениях сердца по длинной и короткой оси левого желудочка (ЛЖ) из стандартных позиций на аппаратах Aloka SSD 500 (Япония), ACUSON Antares Siemens Medical Solutions (США) с оценкой функции ЛЖ. Определялись линейные размеры (КДР, см, КСР, см) и объемы (КДО, мл, КСО, мл) ЛЖ. Рассчитывались ударный объем и ударный индекс (УИ=УО, мл/м2), общее и удельное периферическое сосудистое сопротивление (ОПСС=УПСС, дина*с/см3/м2). Устанавливались показатели глобальной сократимости ЛЖ: фракция выброса (ФВ, %), относительное сокращение (ОС, %), объемная скорость сердечного выброса (ОССВ=УО/ВВ, мл/мс), масса миокарда ЛЖ (ММЛЖ, г), индекс массы миокарда (иММ, г/м2). Кроме этого, рассчитывались параметры, характеризующие геометрию ЛЖ:
- индекс относительной толщины стенки ЛЖ (ИОТ ЛЖ, ед.). ИОТ ЛЖ = ТМЖ + ТЗС ЛЖ/КДР, где ТМЖ – толщина межжелудочковой перегородки, ТЗСЛЖ – толщина задней стенки ЛЖ, КДР – конечный диастолический размер ЛЖ;
- функциональный индекс соответствия (ФИС) – отношение УИ/иММ (мл/г/м2);
- индекс напряжения миокарда ЛЖ (ИНМ) – отношение АДс/КСО (ед.);
- объемно-массовое отношение – иКДО/иММ (мл/г/м2);
- индекс дилатации – КДР/Р (см/м2), где Р – поверхность тела в м2;
- показатель артериальной жесткости (ПАЖ, ед.) – УИ/ПАД (мл/м2/мм рт.ст.), где ПАД пульсовое АД.
Индексы систолической (ИСс, ед.) и диастолической сферичности ЛЖ (ИСд, ед.) вычисляли как отношение диаметра ЛЖ (d) к его длинной оси (L). Конечный систолический (КСМС, г/м2) и диастолический меридиональный стресс (КДМС, г/м2) рассчитывали по общепринятым формулам [12].
Гипертрофию ЛЖ констатировали при индексе массы миокарда левого желудочка (иММЛЖ) >115 г/м2 у мужчин и > 95 г/м2 у женщин [13]. Гипертрофию стенки ЛЖ оценивали по ИОТ. Согласно рекомендациям Российского медицинского общества по артериальной гипертонии выделяли следующие типы геометрии миокарда:
- Нормальная геометрия ЛЖ (НГ) – при иММЛЖ = N и ИОТ <0,42 ед.
- Концентрическое ремоделирование (КР) – при иММЛЖ = N и ИОТ >0,42 ед.
- Концентрическая гипертрофия (КГ) – при иММЛЖ >N и ИОТ >0,42 ед.
- Эксцентрическая гипертрофия (ЭГ) – при иММЛЖ > N и ИОТ < 0,42 ед.
Содержание NO рассчитывали по суммарной концентрации его стабильных метаболитов – нитрит-анионов (NO2-) и нитрат-анионов (NO3-) – в безбелковых фильтратах плазмы крови и трижды отмытых эритроцитах, спектрофотометрическим методом (СФ-6-А, Россия). Пробы крови брали утром, натощак, в количестве не менее 6 мл. Концентрацию NO2- определяли с помощью реактива Грисса по методу Грина. Концентрацию NO3- устанавливали в безбелковых фильтратах плазмы крови и эритроцитах прямым методом, используя бруциновый реактив. Величину экстинкции рассчитывали при λ=543 нм для NO2- и λ=405 нм для NO3- [14].
Концентрацию общего холестерина (ОХС), ХС липопротеидов высокой плотности (ХС ЛПВП), триглицеридов (ТГ) определяли с помощью анализатора Cholestech LDX Cholestech (США). Уровень ХС липопротеидов очень низкой плотности (ХС ЛПОНП) и ХС липопротеидов низкой плотности (ХС ЛПНП) выявляли фотометрическим методом на полуавтоматическом анализаторе Prima (Италия). Индекс атерогенности (ИА) рассчитывали по формуле (ОХС – ХС ЛПВП)/ХС ЛПВП (ед.). Атерогенный индекс плазмы (AIP) вычисляли как логарифм отношения ТГ и ХС ЛПВП: AIP = log (ТГ/ХС ЛПВП).
В рамках статистического анализа рассчитывались средние величины, их стандартные средние ошибки (M±m), а также 95% доверительный интервал. Для сравнения независимых групп использовался t-критерий Стьюдента. Проверка гипотез о равенстве средних значений проводилась с помощью парного критерия Вилкоксона.
Анализ корреляционных связей был проведен стандартным методом математического моделирования с помощью программы Statistica v. 10.01 StatSoft (США). Связь признаков изучалась посредством уравнений регрессии и корреляции по Пирсону. Вычислены уравнения множественной регрессии, показавшие закономерность зависимости абсолютных и относительных значений морфофункциональных параметров ЛЖ, показателей гемодинамики от концентрации липидов и NO в крови.
Информативность и влияние факторов в уравнениях регрессии оценивали по коэффициенту детерминации (R2). Модель считали информативной при R2 >0,6. Вклад факторных признаков (xJ) в объясненную вариацию результативного признака (Y) оценивали по относительным частным коэффициентам эластичности (Е). Результаты были обработаны на ПК и считались статистически значимыми при уровне р <0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Как видно из таблицы 1, у больных АГ с умеренно выраженной гемодинамической перегрузкой ЛЖ изменения миокарда сопровождается незначительным увеличением ИОТ ЛЖ и увеличением размеров полости ЛЖ, нормальным иММЛЖ при НГ. Увеличенные показатели иКДО выявлены у больных с КГ и ЭГ (на 3 и 7%) выше, чем в группе здоровых лиц. УИ ЛЖ оказался снижен (на 10%) у больных с КР и выше в группах с КГ и ЭГ (на 5 и 7%).
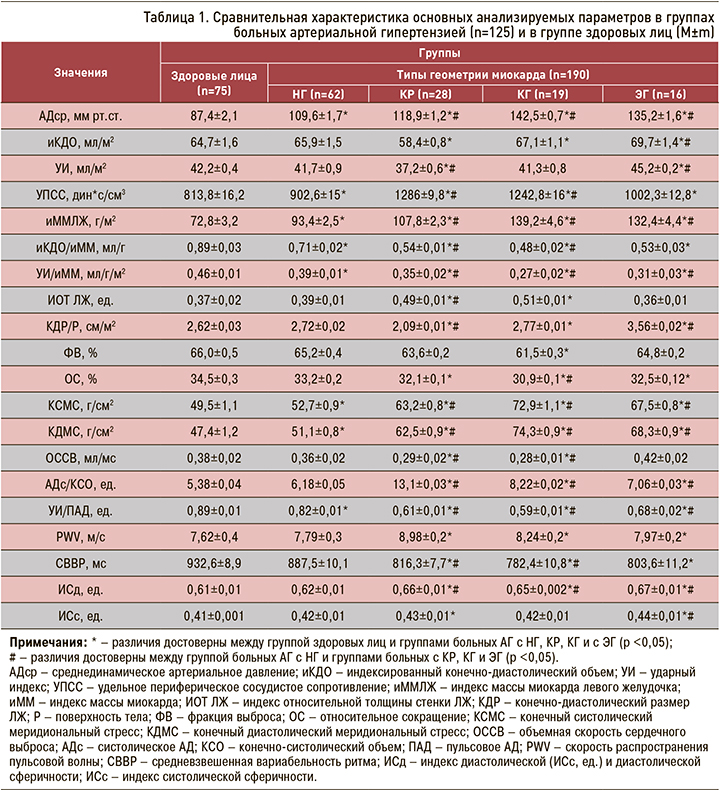
Наиболее высокие показатели УПСС выявлены в группах больных АГ с КР и КГ – на 57 и 52% выше, чем в группе здоровых лиц. Значения иММЛЖ (г/м2) при всех типах РМ превосходили аналогичную величину у здоровых лиц и больных с НГ как в процентном отношении (на 15–88%), так и в абсолютных величинах (на 17–66 г/м2). Низкие значения объемной нагрузки на миокард (иКДО/иММ) выявлены в группах больных с КР и КГ – на 10 и 70% ниже, чем в группе здоровых людей. ИОТ ЛЖ достоверно не различался в группе с НГ, ЭГ и был увеличен в группах больных АГ с КР и КГ (на 32 и 38%) по сравнению с группой здоровых лиц. Изменение геометрии миокарда ЛЖ – от эллипсоидной формы к сферичной – характерно для типов ремоделирования с преобладанием процессов дилатации над процессами гипертрофии миокарда. Индекс дилатации ЛЖ (КДР/Р, см/м2) был достоверно снижен в группе больных с ЭГ (на 35%) и увеличен в группе пациентов с КГ (на 25%).
РМ у больных АГ не приводит к существенному изменению сократительной способности миокарда на протяжении длительного времени. При этом КГ у больных АГ 2 степени протекает на фоне умеренного снижения сократимости миокарда. Показатели глобальной сократимости – ФВ и ОС – снижены на 4–6% в группе пациентов с КГ. ОССВ была статистически значимо снижена у больных АГ с КР и КГ (на 30–35%). Сократительная способность ЛЖ при других геометрических моделях ЛЖ достоверно не различалась, что может свидетельствовать о сохранении компенсаторного характера ремоделирования как механизма, направленного на поддержание адекватного ударного выброса.
Функциональный индекс соответствия (УИ/иММЛЖ) оказался достоверно снижен в группах больных с КР и КГ (на 45–55%) по сравнению с группой здоровых лиц. Показатель систолического напряжения ЛЖ – АДС/КСО – был увеличен у больных АГ с высоким уровнем АДср в группах с КР (на 78%), КГ (на 52%), у больных с ЭГ (на 33%). КСМС и КДМС статистически значимо были увеличены в группах больных АГ с КР, КГ и с ЭГ (на 30–45%) по сравнению с группой здоровых людей. Показатель артериальной жесткости (УИ/ПАД) был снижен у больных с КР на 85%, у пациентов с КГ и ЭГ – на 55 и 30%. Скорость распространения пульсовой волны (PWV, м/с) была увеличена у больных АГ с КР на 18%; у пациентов с КГ и ЭГ этот показатель был незначительно выше (на 8 и 5%) по сравнению с группой здоровых лиц. СВВР была статистически значимо снижена у больных АГ с КР, ЭГ. Индексы диастолической (ИСд) и систолической сферичности (ИСс) оказались выше в группах больных с КГ и ЭГ (на 3–9%) по сравнению со здоровыми участниками исследования.
Тенденция к возрастанию основных морфофункциональных параметров миокарда ЛЖ в группе больных АГ с различными уровнями АДср отличались между собой по геометрии миокарда и типам РМ. Высокие уровни АДср в сочетании со снижением NO в крови взаимосвязаны с распространением КР и КГ ЛЖ. Не выявлено достоверных взаимосвязей между типом ремоделирования ЛЖ и ростом, индексом массы тела и возрастом обследованных лиц.
В таблице 2 представлены данные концентрации липидов в плазме и стабильных метаболитов оксида азота в крови. Как видно из нее, концентрация ОХС увеличена в группах больных АГ с КГ (на 13%) и ЭГ (на 10%). Концентрация ХС ЛПВП снижена у всех групп больных АГ, причем у больных с КР, КГ и ЭГ значительно снижена – на 20–57%.
Концентрации ХС ЛПНП и ХС ЛПОНП были увеличены у больных с КГ (на 58%) и ЭГ (на 50%) по сравнению с группой здоровых лиц. Концентрация ТГ в плазме статистически значимо была увеличена у больных АГ с КР, КГ и ЭГ (на 15–32%). Также у этих групп пациентов были увеличены КА (в 2–2,3 раза по сравнению с группой здоровых лиц) и АIP (на 16–68%).
Концентрация нитритов в крови в группе больных АГ с НГ достоверно не отличалась от показателей здоровых лиц (см. табл. 2). Концентрация NO2- в крови была снижена в группах с КР и КГ (в 1,7–1,9 раза). Концентрация NO3- статистически значимо не отличалась от показателей здоровых лиц в группе больных с НГ и была снижена в группах больных с КР и КГ (на 50–80%).
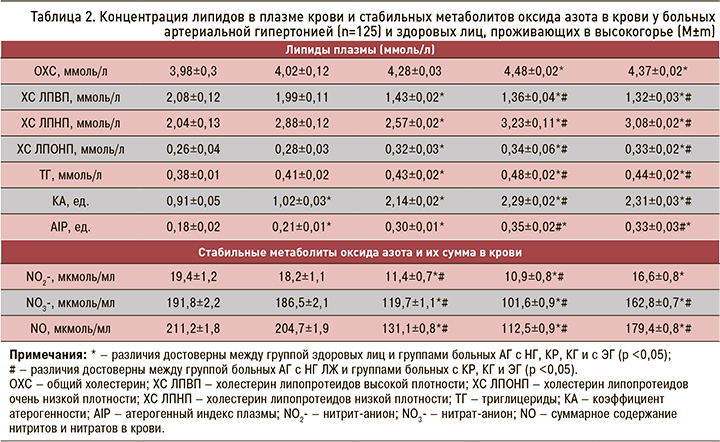
Общая концентрация NO2- и NO3- в крови (NO) статистически значимо не отличалась в группе больных с НГ и была статистически значимо снижена в группах больных с КР и КГ (на 65–85%) по сравнению с группой здоровых лиц.
Полученные результаты свидетельствуют о более выраженных нарушениях липидного профиля плазмы у больных АГ со снижением концентрации стабильных метаболитов NO в крови и развитием ремоделирования миокарда.
Проведен корреляционный анализ, и вычислены уравнения множественной регрессии, в которых показаны закономерности, отражающие зависимость абсолютных и относительных значений показателей гемодинамики и морфофункциональной структуры миокарда от концентрации липидов в плазме и NO в крови.
Уравнения множественной регрессии представлены как зависимость переменных:
Y = f (βX) + ε,
где X = (X1, X2, .., Xn) – факторные признаки (объясняющие) переменные; β – вектор параметров; Y – результативный признак; ε – случайная ошибка (отклонение) регрессии.
Эмпирическое уравнение множественной регрессии представлено в виде:
Y = b0+b1X1 + b2X2 + b3X3 + b4X4 + b5X5 +e,
где b0 – свободный член, определяющий значение Y в случае, когда все факторные признаки Xj=0.
Относительные частные коэффициенты эластичности (Е) рассчитывали по формуле:
Еi=bi*(Xim/Ym), где bi – коэффициент регрессии, Xim – среднее значение факторного признака,
Ym – среднее значение результативного признака.
Если Еi >1, то он существенно влияет на объясненную вариацию результативного признака Y. При изменении Еi на 1 единицу результативный признак Y изменится на 1%. Если Еi <1, то он мало влияет на результативный признак Y.
Уравнения множественной регрессии для здоровых лиц и больных АГ:
- Y(АДср) = b1X1(NO) + b2X2(ММЛЖ) + b3X3(УО) + b4X4(ХС ЛПВП) + b5X5(ТГ);
- Y(АДср) = b1X1(ОПСС) + b2X2(PWV) + b3X3(ОССВ) + b4X4(AIP) + b5X5(СВВР);
- Y(ММЛЖ) = b1X1(ОПСС) + b2X2(NO) + b3X3(АДср) + b4X4(ТГ) + b5X5(СВВР);
- Y(NO) = b1X1(АДср) + b2X2(УО) + b3X3(ХС ЛПОНП) + b4X4(ОПСС) + b5X5(AIP);
- Y(ХС ЛПНП) = b1X1(АДср) + b2X2(УО) + b3X3(NO) + b4X4(ОПСС) + b5X5(AIP).
Всего рассчитано 54 уравнения регрессии, из которых приводятся значимые по коэффициентам b и частным коэффициентам эластичности E.
В группе здоровых лиц зависимость АДcр от ОХС, ХС ЛПНП, ТГ, ММЛЖ, УО, PWV, AIP была слабой или не значимой (p >0,05; Е Xj <1). Выявлена зависимость АДcр от факторов: СВВР, NO (R2=0,696; r=-0,798; (-0,526); p <0,01).
В группе больных АГ с НГ установлена зависимость АДcр от NO, СВВР (R2=0,623; r=-0,412 –0,667; p<0,001) и прямая зависимость АДcр от ОПСС, AIP, КСМС (R2=0,782; r=0,538–0,692; p <0,001, Е 1–4; Е 2–5 >1).
В группе больных АГ с КР и КГ установлена зависимость АДcр от концентрации NO, ХС ЛПВП, СВВР (R2=0,683; r=-0,436 – 0,763; p<0,01), прямая зависимость АДcр от ОПСС, ММЛЖ, AIP, КСМС (R2=0,728; r=0,548 – 0,783; p <0,001) и зависимость NO от ОПСС, ММЛЖ, ХС ЛПНП, КСМС (R2=0,632; r=-0,623 - 0,747; p <0,01, Е 1–4 >1).
В группе больных АГ с ЭГ установлена зависимость концентрации NO от факторов ММЛЖ, АДcр, ОПСС, ХС ЛПОНП (R2=0,513; r=-0,458 – 0,523; p <0,03), зависимость АДcр от СВВР, ХС ЛПВП (R2=0,597; r= -0,675 –0,513; p <0,05) и прямая зависимость АДcр от ММЛЖ, ОПСС, AIP, УО (R2=0,604; r= 0,452 – 0,568; p <0,02).
Зависимости и взаимосвязи между показателями морфофункциональной структуры ЛЖ, липопротеидами и метаболитами NO в группе здоровых лиц незначительно отличались от показателей в группе больных АГ с НГ ЛЖ и нарастали в группах больных АГ с КГ и ЭГ ЛЖ.
Снижение содержания стабильных метаболитов NO на фоне увеличения уровня ХС ЛПНП было наиболее выражено у больных АГ с изменениями геометрии миокарда – с КГ и ЭГ ЛЖ.
ЗАКЛЮЧЕНИЕ
Полученные данные свидетельствуют о более выраженном нарушении липидного профиля плазмы и дисфункции эндотелия у больных АГ с гипертрофией миокарда и дилатацией полости ЛЖ. Снижение продукции NO и других вазодилататоров при дисфункции эндотелия сопровождается нарушениями липидного обмена с развитием окислительного стресса, усугубляющих течение АГ и вызывающих ее осложнения – ремоделирование миокарда.
Патогенетический вклад окислительных и воспалительных процессов при ремоделировании миокарда на фоне АГ не может интерпретироваться однозначно ввиду гетерогенности миокарда и различиях его геометрии как у разных больных АГ, так и в разных популяциях. Повреждение миокарда и сосудов активными формами кислорода и активация процессов липопероксидации в липопротеидах низкой плотности активируют неспецифическое воспаление миокарда и сосудов, снижают концентрацию NO в крови, что способствует прогрессированию АГ и развитию ее осложнений.


