Спондилоартриты (СпА) относятся к заболеваниям, представление о которых в течение последних десятилетий претерпевает постоянные изменения [1, 2]. На момент написания настоящей статьи группа СпА включает рентгенологический аксиальный СпА, или анкилозирующий спондилит, нерентгенологический аксиальный СпА, псориатический артрит, реактивные артриты, артриты, ассоциированные с воспалительными заболеваниями кишечника (болезнь Крона, язвенный колит), HLA-B27-ассоциированный увеит и недифференцированные СпА [1, 2].
Согласно клиническим рекомендациям, СпА должны диагностироваться и лечиться под наблюдением ревматолога [3–7]. Вместе с тем при появлении первых признаков заболевания пациент со СпА обычно обращается к врачу-терапевту, врачу общей практики или врачам смежных терапевтических специальностей. И именно от знаний врачей-терапевтов зависит правильная маршрутизация пациентов со СпА, подразумевающая прямое направление больного с высоким риском этой группы заболеваний к врачу-ревматологу. Правильное понимание терапевтом проблемы СпА позволит исключить необоснованные посещения пациентом таких специалистов, как неврологи, ортопеды, травматологи и другие, а также свести к минимуму необходимое дообследование, в результате чего диагноз будет поставлен своевременно. Это крайне важно, поскольку своевременная диагностика – одно из условий успешного лечения СпА, целью которого служит достижение клинической, лабораторной, магнитно-резонансной ремиссии и предотвращение необратимого повреждения органов и тканей [6–10].
С учетом того что в ревматологии последних десятилетий произошло большое число изменений (полностью изменилась парадигма СпА, их терминология, классификация, подходы к диагностике и лечению), информирование терапевтической общественности о современной концепции СпА представляется задачей первоочередной важности [11–14]. Еще более важно своевременное распространение среди врачей реальной клинической практики информации о новых подходах к ведению пациента со СпА в свете подготовки XI пересмотра МКБ (Международной классификации болезней и причин смерти), в которой уже применена современная терминология и отсутствую привычные наименования отдельных нозологических форм СпА (например, «анклозирующий спондилит»).
Целью настоящей работы стало представление современных подходов к определению, терминологии, классификации СпА как части общей истории развития учения о СпА.
Для упрощения понимания читателем логики смены парадигм СпА перед представлением основ терминологии и классификации этой группы заболеваний мы постарались представить историю ее изучения.
ИСТОРИЯ ИЗУЧЕНИЯ И ЭТАПЫ ФОРМИРОВАНИЯ УЧЕНИЯ О СПОНДИЛОАРТРИТАХ
История изучения СпА уходит в глубь веков. Известны многочисленные клинические и патологоанатомические описания случаев, напоминающие болезнь Бехтерева, опубликованные в период с 500 г. до н.э. по XIX в. Сохранились останки скелетов, которые относят к пятому тысячелетию до н.э., с изменениями, типичными для анкилозирующего спондилита (АС). В то же время до 1892 г. отдельных нозологических форм СпА не существовало, а все заболевания позвоночника рассматривали как «остеохондроз» (или дегенеративно-дистрофические изменения, согласно современной терминологии) [14].
Первое описание АС как отдельной нозологической формы принадлежит русскому клиницисту В.М. Бехтереву, который в том самом 1892 г. опубликовал статью «Одеревенелость позвоночника с искривлением его как особая форма заболевания» [Врач, т. 13, с. 899, 1892]. А. Strumpell в 1897 г. и Р. Marie в 1898 г. опубликовали собственные описания АС, после чего он получил свое историческое название – болезнь Бехтерева–Штрюмпелля–Мари, а применяемый по сей день термин «анкилозирующий спондилит» впервые в литературе использовал Е. Frankel (1904) [14].
С момента первого описания АС до настоящего времени взгляды на СпА изменялись не эволюционно, а революционно: происходила смена парадигм. На основании анализа истории развития спондилоартритов мы выделили следующие периоды:
1. Ранний период (V век до н. э. – 1892 г.): представлен отдельными клиническими и патологоанатомическими наблюдениями, описывающими картину, характерную для АС без выделения его в качестве отдельной нозологической формы.
2. Период первичного накопления знаний о клинических проявлениях отдельных СпА (1892–1961): начинается с описания АС В.М. Бехтеревым (1892), характеризуется формированием представлений о типичных клинических (позвоночных, суставных, внесуставных), рентгенологических, лабораторных проявлениях этой болезни. Появляются теории, предполагающие патогенетическое родство АС, реактивного артрита, псориаза, инфекционных болезней. Активно обсуждается нозологическая принадлежность АС к ревматоидному артриту (как его особая форма). Псориатический артрит в этот период не относят к СпА и рассматривают как особую форму ревматоидного артрита.
3. Период формирования критериев АС (1961–1984). В 1961 г. были созданы первые критерии диагностики АС (Римские критерии), включавшие клинические и рентгенологические признаки (причем сакроилиит учитывался вне зависимости от стадии процесса). В 1966 г. на основе Римских были разработаны Нью-Йоркские критерии, уделявшие большее значение боли в нижней части спины и не включавшие ирит и сакроилиит I стадии (были включены только стадия II с двух сторон или III–IV – с одной). С течением времени Нью-Йоркские критерии претерпели ряд изменений: более точно описана клиника воспалительной боли в спине (длительность более 3 мес, уменьшение боли при движении, ночной и предутренний характер боли в спине). В настоящее время используются критерии АС 1984 г. [14, 15].
4. Период формирования представлений о серонегативных СпА как о группе патогенетически связанных заболеваний, включающей псориатический артрит в качестве самостоятельной нозологической формы заболевания (70–90-е гг. XX в).
В описываемый период стало очевидным, что АС не единственный серонегативный СПА. После детального изучения случаев серонегативного ревматоидного артрита из него была выделена группа заболеваний – «серонегативные спондилоартриты», объединенные общими клиническими признаками, такими как частое поражение позвоночника и крестцово-подвздошных сочленений, асимметричный артрит периферических суставов, энтезиты, отсутствие подкожных узелков, семейная предрасположенность. Позднее наследственная предрасположенность была объяснена тесной ассоциацией между СпА и носительством антигена гистосовместимости человека HLA-B27 и некоторыми другими.
В это же время разрабатываются критерии диагностики псориатического артрита, который теперь рассматривается как самостоятельная нозологическая форма и окончательно «отделен» от ревматоидного артрита. Диагностику псориатического артрита проводят по отдельным критериям, из которых наиболее часто применяемыми становятся критерии Moll, Wright, позднее – критерии Mathies (1974). В России несколько позже разрабатываются и начинают использоваться критерии Э.А. Агабабовой с соавт. (1989) [14–17]. Указанные критерии псориатического артрита, так же как и описанные выше критерии СпА, включают рентгенологический сакроилиит и подразумевают обязательное наличие псориатического поражения кожи или ногтей у пациента.
5. Период расширения знаний о патогенезе СпА, формирования концепции аксиальных и периферических СпА, выделения понятия нерентгенологического аксиального СпА (последняя декада XX в. – настоящее время) [18–26]. В конце XX – начале XXI в. на фоне прогресса молекулярных и клеточных лабораторных методик и значимого прогресса визуализирующих методик (МРТ, КТ, ПЭТ-КТ и др.) получены новые данные о патогенезе СпА и особенностях их прогрессирования [7, 8, 27, 28]. Изучение роли отдельных цитокинов, хемокинов и сигнальных молекул в развитии и структурном прогрессировании СпА позволило патогенетически обосновать новые подходы к их лечению. Они заключаются как в изменении режимов назначения ранее применявшихся лекарственных средств (НПВП), так и во внедрении новых групп препаратов – ингибиторов фактора некроза опухоли α (ФНОα), ингибиторов интерлейкинов (ИЛ-17А, ИЛ-12, ИЛ-23), ингибиторов янус-киназ, блокаторов фосфодиэстеразы 4-го типа и др. [29–31].
Одновременно с изменением представлений о патогенезе СпА в начале XXI в. группой ASAS (Assessment of SpondyloArthritis International Society) сформулирована концепция периферических и аксиальных СпА и представлены новые классификационные критерии для этих заболеваний (2009, 2011). Несомненным достоинством критериев ASAS (2009, 2011) следует считать возможность ранней диагностики СпА, определившей возможность раннего начала лечения заболеваний. При этом с учетом накопления новых сведений о специфичности и чувствительности составляющих их параметров и совершенствования подходов к МРТ-диагностике сакроилиита стала очевидна необходимость совершенствования критериев ASAS с повторной валидацией.
В настоящий момент продолжается работа над валидацией критериев СпА, совершенствованием методов диагностики (клинических, лабораторных и визуализирующих) и над разработкой новых методов лечения. Создаются новые молекулы, направленные на блокаду основных патогенетических путей развития СпА, например молекулы, блокирующие ИЛ-17А (нетакимаб) или репертуары Т-лимфоцитов, участвующие в патогенезе СпА, обсуждается возможность пересадки мезенхимальных стромальных клеток.
ТЕРМИНОЛОГИЯ СПОНДИЛОАРТРИТОВ
Согласно определению экспертной группы по изучению СпА при ассоциации ревматологов России (ЭКСПА), СпА (М46.8) – это группа хронических воспалительных заболеваний позвоночника, суставов, энтезисов, характеризующаяся общими клиническими, рентгенологическими и генетическими особенностями [1, 2] (табл.).

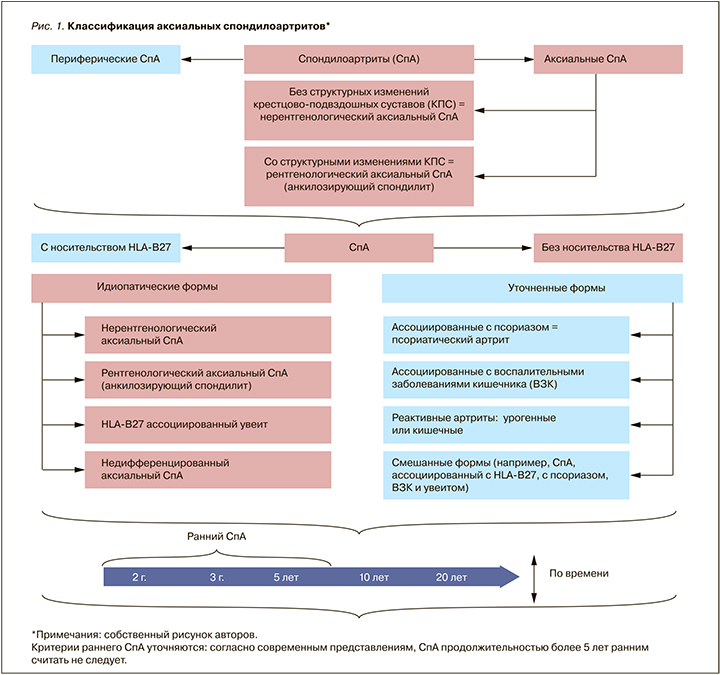
Аксиальный СпА (аксСпА) – СпА с преимущественным поражением позвоночника и крестцово-подвздошных суставов. Его разновидностями являются рентгенологический (АС, или болезнь Бехтерева) и нерентгенологический аксСпА.
Рентгенологический аксСпА (АС; М 45.0 согласно МКБ X пересмотра) – хроническое воспалительное заболевание из группы СпА, характеризующееся обязательным поражением крестцово-подвздошных суставов (КПС) и/или позвоночника с потенциальным исходом их в анкилоз, с частым вовлечением в патологический процесс энтезисов и периферических суставов. Структурные изменения КПС, выявляемые рентгенологически или при МРТ, обязательны для диагностики АС.
С 2019 г. термины «рентгенологический аксиальный спондилоартрит» и «анкилозирующий спондилит» считаются взаимозаменяемыми; предпочтительно использовать первый термин. МКБ XI пересмотра включает рубрики «аксиальный спондилоартрит» и «периферический спондилоартрит», а вот рубрика «анкилозирующий спондилит» в ней отсутствует.
Периферический СпА – СпА с преимущественным поражением периферических суставов.
Такие понятия, как периферический СпА и аксиальный СпА с периферическим вовлечением, не являются равнозначными. Периферический СпА – это спондилоартрит, при котором у пациента не было в анамнезе и нет в настоящем типичной воспалительной боли в спине и типичного спондилита! Наличие сакроилиита не исключает периферическую форму СпА. Сакроилиит как со структурными изменениями, так и без них может встречаться при периферическом СпА, если у пациента никогда не болела спина в типичной для СпА воспалительной манере [27, 28].
Периферическое вовлечение при аксиальном СпА – это участие в воспалительном процессе суставов, не относящихся к аксиальному скелету (коленные, голеностопные, локтевые, лучезапястные суставы, суставы стоп и кистей) и энтезисов. Таким образом, у пациента может быть периферический СпА с двусторонним сакроилиитом II ст. (если спина не болела, нет типичного спондилита и пациент соответствует критериям ASAS) и АС с периферическим вовлечением (двусторонний гонит, артрит суставов кистей, стоп) [27, 28]. Так, если у пациента имеется типичная аксиальная форма болезни Бехтерева и при этом наблюдается артрит голеностопных суставов – это рентгенологический аксиальный СпА с периферическим вовлечением (олигоартрит). Если же у пациента без болей в спине отмечается артрит голеностопных суставов, выявлены носительство HLA-B27, односторонний сакроилиит (II ст. по Kellgren), то речь идет о периферическом СпА, ассоциированном с HLA-B27.
Псориатический артрит (L40.5; М 07.0–07.3; M09.0) – хроническое воспалительное заболевание из группы СпА, характеризующееся поражением суставов, позвоночника, энтезисов и ассоциированное с псориазом. «Ассоциированное с псориазом» означает наличие у больного на момент осмотра или в анамнезе, диагностированного врачом-дерматологом псориаза (в том числе ногтей) и/или наличие псориаза у его кровных родственников. Таким образом, ПсА может и должен быть диагностирован у пациента в случае соответствия диагностическим критериям даже в случае, если псориаза у пациента не было никогда.
СпА, ассоциированный с воспалительным заболеванием кишечника (М 07.4; М 07.5) – хроническое воспалительное заболевание из группы СпА, характеризующееся поражением суставов, позвоночника и энтезисов и ассоциированное с болезнью Крона или язвенным колитом. Диагноз болезни Крона или язвенного колита должен быть подтвержден документально.
Реактивный артрит (М 02.1; 02.3; 02.8; 02.9) – воспалительное негнойное заболевание суставов, энтезисов, позвоночника, хронологически связанное с острой урогенитальной или кишечной инфекцией. Хронологическая связь с инфекцией: развитие артрита спустя 1–6 нед после клинических проявлений урогенитальной или кишечной инфекции. Триггерными инфекционными факторами реактивных артритов следует считать Сhlamydia trachomatis, Yersinia enterocolitica, Salmonella enteritidis, Campylobacter jejuni, Schigella fleхneri. Изолированные серологические методы при отсутствии предшествующей дебюту артрита клинической картины самостоятельного значения не имеют!
Не рекомендуемые к использованию в качестве формулировки диагноза термины: дорентгенологический спондилоартрит (правильно – нерентгенологический), хронический урогенный артрит (правильно – реактивный артрит), анкилозирующий спондилоартрит (правильно – рентгенологический аксиальный спондилоартрит или анкилозирующий спондилит), серонегативный спондилоартрит (правильно – спондилоартрит), псориатическая артропатия, артропатический псориаз (правильно – псориатический артрит), болезнь Рейтера.
Рекомендуемая орфография написания терминов: сакроилиит (от лат. ilium – подвздошная кость); написание «сакроилеит» неверно, так как ileum – подвздошная кишка (лат.).
Классификация СпА (рис. 1 и 2) строится на основании различных критериев [30–33]:
1. По наличию сакроилиита со структурными изменениями:
- нерентгенологический аксСпА (см. рис. 1);
- рентгенологический аксСпА (АС, болезнь Бехтерева).
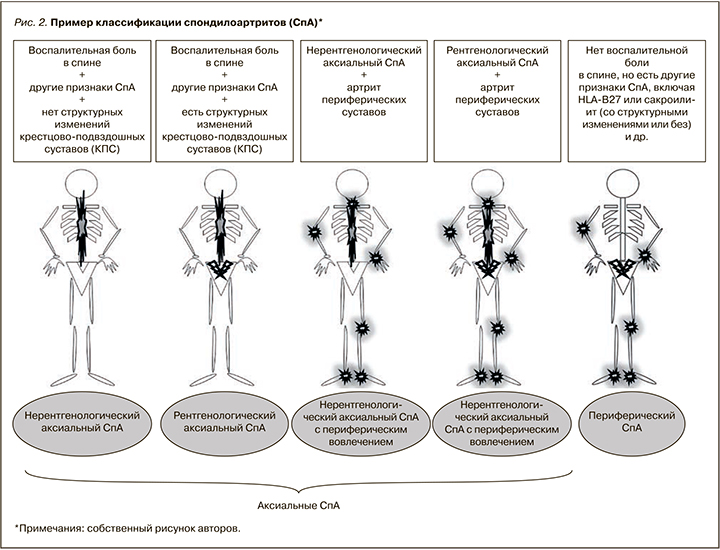
NB! Достоверным рентгенологическим сакроилиитом считают двусторонний сакроилиит II стадии или односторонний сакроилиит III–IV стадии по J.H. Kellgren c примечаниями Р. Bennett (1966)
2. По наличию носительства антигена HLA-B27:
- ассоциированный с носительством антигена HLA-B27;
- не ассоциированный с носительством антигена HLA-B27.
3. По наличию внепозвоночных проявлений:
- с внепозвоночными проявлениями (артрит, энтезит, дактилит);
- без внепозвоночных проявлений.
4. По наличию внескелетных проявлений:
- с внескелетными проявлениями (увеит, аортит, апикальный легочный фиброз, воспалительные заболевания кишечника, гангренозная пиодермия, псориаз, и др.);
- без внескелетных проявлений.
NB! Отдельно в структуре основного заболевания указывают наличие псориаза, его форму и стадию (прогрессирование, стабилизация, регресс) и наличие воспалительного заболевания кишечника (болезнь Крона/язвенный колит) с указанием формы, характера течения и стадии заболевания.
5. По наличию осложнений:
- с осложнениями (вторичный АА-амилоидоз, нарушения проводимости и ритма, хроническая сердечная недостаточность и др.);
- без осложнений.
6. По степени активности:
- клиническая ремиссия;
- умеренная активность;
- высокая активность;
- очень высокая активность.
NB! Степень активности СпА измеряют по ASDASСРБ (Ankylosing Spondylitis Disease Activity Score) – индексу, определенному с применением С-реактивного белка высокочувствительным методом (вчСРБ). При отсутствии показателей вчСРБ используют индекс ASDASСОЭ; при отсутствии данных о СРБ и СОЭ – по индексу BASDAI (Bath Ankylosing Spondylitis Disease Activity Index). Значения ASDAS и/или BASDAI следует указывать в скобках после степени активности.
7. По функциональному классу:
- функциональный класс I – пациент не имеет ограничений профессиональной, непрофессиональной деятельности, самообслуживание сохранено;
- функциональный класс II – пациент имеет ограничения профессиональной деятельности, в непрофессиональной деятельности и самообслуживании не ограничен;
- функциональный класс III – пациент имеет ограничения профессиональной и непрофессио-нальной деятельности, в самообслуживании не ограничен;
- функциональный класс IV – пациент имеет ограничения профессиональной, непрофессиональной деятельности, в самообслуживании ограничен.
ДИАГНОСТИКА АКСИАЛЬНЫХ СПОНДИЛОАРТРИТОВ
Первые признаки аксиальных СпА, как правило, появляются в возрасте до 45 лет. Дебют болезни в более позднем возрасте возможен, но требует выполнения дифференциальной диагностики с другими заболеваниями осевого скелета, в первую очередь с идиопатическим оссифицирующим гиперостозом скелета (болезнь Форестье), тяжелым дегенеративно-дистрофическим поражением позвоночника, метастатическими процессами, инфекциями (в том числе с бруцеллезом, туберкулезом, стафилококковым спондилитом) и др.
В настоящее время изменились и представления о соотношении лиц разного пола при аксиальных СпА. Если в XX в. АС считался преимущественно «мужской» болезнью, то к началу века XXI столетия стало очевидным, что заболеваемость аксиальными СпА среди пациентов разного пола сопоставима (женщины : мужчины = 1:1). При этом мужской пол продолжает рассматриваться как фактор неблагоприятного прогноза для структурного прогрессирования аксиальных СпА, а женский – как фактор, определяющий более выраженный болевой синдром и худший ответ на лечение [1, 2, 7, 8]. При сопоставимой клинической и лабораторной активности у пациентов мужского пола выше склонность к анкилозированию КПС и/или позвоночника, а у пациенток женского пола наблюдается большая интенсивность боли в спине. Мужчины чаще подвержены рентгенологическому аксиальному СпА (АС/болезни Бехтерева), женщины чаще страдают нерентгенологическим аксиальным СпА.
Диагностических критериев для аксиальных СпА в настоящий момент не существует. Диагноз устанавливается на основании наличия у пациента совокупности симптомов, характерных для аксиальных СпА. Активно обсуждается возможность применения с диагностическими целями классификационных критериев аксиальных СпА, разработанных группой ASAS (2009).
Классификационные критерии ASAS применимы к пациентам с болью в спине продолжительностью ≥3 мес, начавшейся у пациента моложе 45 лет [27, 28].
Аксиальный СпА может быть установлен:
- при наличии сакроилиита, подтвержденного рентгенологически или с применением МРТ, в сочетании с одним из перечисленных далее признаков СпА («визуализирующий» рукав критериев);
- при наличии носительства антигена HLA-B27 в сочетании с двумя нижеперечисленными признаками СпА («клинический» рукав критериев).
Признаки спондилоартрита:
- воспалительная боль в спине;
- артрит;
- энтезит;
- дактилит;
- псориаз;
- болезнь Крона/язвенный колит;
- отягощенная наследственность по СпА;
- хороший ответ на НПВП;
- повышение С-реактивного белка, скорости оседания эритроцитов (СОЭ);
- НLA-B27;
- сакроилиит.
О рентгенологических критериях сакроилиита было сказано выше. В свою очередь, сакроилиит считается подтвержденным при МРТ, если в режимах с жироподавлением (STIR) установлено наличие субхондрально расположенного очага гиперинтенсивного сигнала на двух и более последовательно расположенных срезах или на одном срезе имеется два и более субхондрально расположенных очагов гиперинтенсивного сигнала.
Структурные изменения, выявленные посредством МРТ в режиме Т1 (жировая дегенерация – Fatty lesions, эрозии, субхондральный склероз, изменение ширины суставной щели в виде сужения, псевдорасширения или анкилоза), могут расцениваться как сакроилиит. Определение структурных изменений разрабатывается.
Критерии воспалительной боли в спине (консенсус ASAS). Воспалительная боль – хроническая боль, продолжительностью ≥3 мес, имеющая 4 из 5 нижеперечисленных особенностей:
- возраст начала – до 40 лет;
- постепенное начало;
- улучшение после физических упражнений;
- отсутствие улучшения в покое;
- ночная боль с улучшением при пробуждении.
Применявшиеся ранее для диагностики АС модифицированные Нью-Йоркские критерии (1984) могут использоваться и в настоящее время. Модифицированные Нью-Йоркские критерии АС включают сочетание одного рентгенологического признака (двусторонний сакроилиит II–IV стадий и/или односторонний сакроилиит III–IV стадий) с одним из нижеперечисленных клинических критериев:
- боль и скованность в спине, уменьшающиеся при физической нагрузке и не уменьшающиеся в покое (в течение 3 мес);
- ограничение подвижности в поясничном отделе позвоночника во фронтальной и сагиттальной плоскостях;
- ограничение экскурсии грудной клетки.
ДИФФЕРЕНЦИАЛЬНЫЙ ДИАГНОЗ
Аксиальные СпА необходимо дифференцировать со следующими группами заболеваний, ассоциированными с болью в спине:
1. Дегенеративно-дистрофическими заболеваниями позвоночника, включая дискогенные болевые синдромы и болевые синдромы, обусловленные спондилоартрозом. Для указанных заболеваний характерно преобладание механической боли в спине. Механическая боль в спине может возникать после известного травмирующего фактора или перегрузки, пациент может указать день и время ее возникновения, боль усиливается при движениях, уменьшается в покое и в определенных положениях тела. В отличие от аксиальных СпА, дегенеративно-дистрофические заболевания не ассоциируются с изменением острофазовых показателей крови.
2. Миофасциальными синдромами. Наибольшие трудности вызывает дифференциальный диагноз между синдромом грушевидной мышцы и сакроилиитом. Вместе с тем наличие локальной пальпаторной болезненности области пораженной мышцы, а также данные электронейромиографии и МРТ позволяют выполнить дифференциальную диагностику в указанном случае. Эффект от массажа и миорелаксантов (тизанидин и др.) позволяет подтвердить диагноз синдрома грушевидной мышцы.
3. Болевыми синдромами, связанными с дисплазиями соединительной ткани, врожденными аномалиями развития позвоночника и нарушением осанки врожденного или приобретенного генеза. Применение методов визуализации (рентгенография, при необходимости МРТ или КТ) позволяют дифференцировать АС с указанными состояниями.
4. Идиопатическим диффузным оссифицирующим гиперостозом скелета (болезнь Форестье); отличается от АС поздним дебютом (в возрасте старше 50 лет), отсутствием лабораторных признаков воспалительной активности и типичными массивными грубыми крючкообразными боковыми межпозвонковыми сращениями.
5. Остеохондропатиями – асептическими некрозами тел позвонков и головок трубчатых костей, наблюдающимися в детском и подростковом возрасте, приводящими к изменениям осанки и появлению постоянного или преходящего болевого синдрома в спине или суставах, усиливающимися при нагрузке. Применение визуализирующих методов позволяет уточнить наличие асептического некроза соответствующих позвонков или головок трубчатых костей с наличием типичных деформаций на поздних стадиях (клиновидные позвонки, головка бедренной кости по типу «шляпки гриба»). Наиболее часто дифференциальный диагноз приходится проводить с болезнью Шейермана–Мау (остеохондропатия позвонков) или болезнью Легга–Кальве–Пертеса (остеохондропатия головки бедренной кости).
6. Компремирующим остеитом подвздошной кости (osteitis condensans ilii); бывает трудно отличить от СпА. Особенностью этого заболевания является дебют в молодом возрасте; им страдают преимущественно женщины, начало болезни чаще наблюдается в последнем триместре беременности или после родов. Отмечается двусторонний склероз субхондральных отделов подвздошных костей типичной треугольной формы при отсутствии лабораторной активности, отсутствии адекватного ответа на НПВП. При МРТ отек костного мозга в зоне подвздошной кости, как правило, отсутствует, в то же время выявляется остеосклероз субхондральных отделов подвздошных костей типичной треугольной формы. Наибольшей диагностической ценностью обладает рентгеновская КТ костей таза.
7. Травматическими повреждениями позвоночника и крестца, иногда клинически похожими на СпА. Следует заподозрить наличие перелома при отсутствии типичного суточного ритма боли (усиление боли при нагрузке), адекватного ответа на НПВП, наличии указаний на наличие в анамнезе частых падений, микротравм или перегрузок аксиального скелета (например, у наездников, скейтбордистов, парашютистов и т.п.), отсутствии лабораторной активности, атипичном расположении отека костного мозга при МРТ (например, перпендикулярно поверхности крестца). Целесообразно выполнить МРТ с контрастированием (без контрастирования отек костного мозга в зоне травмы маскирует перелом) или (предпочтительно) КТ костей таза или позвонка.
8. Остеопоретическими переломами крестца или позвонков ‒ они должны быть заподозрены у пациентов пожилого возраста при наличии факторов риска остеопороза.
9. Наличием остеомаляции ‒ вызывает трудности дифференциальной диагностики, так как «пестрый» вид тазовых костей и головок бедренных костей при этом заболевании может симулировать сакроилиит и/или коксит. Вместе с тем следует учитывать, что изменение роста и осанки пациента при остеомаляции не сопряжено с формированием типичных для АС синдесмофитов. Также требует внимания типичная О-образная деформация нижних конечностей, что в совокупности с нетипичным для АС расположением зон отека костного мозга, значимым снижением концентрации витамина D3 в сыворотке крови позволит уточнить правильный диагноз.
10. Костной болезнью Педжета; также нужно отличать от СпА. При костной болезни Педжета отмечается наличие очагов деструкции плоских костей при рентгенографии/КТ костей, типичный «пестрый вид» костного мозга при МРТ, может встречаться типичная «саблевидная» деформация конечностей. Типично значимое увеличение концентрации щелочной и костной фосфатаз в сыворотке крови.
11. Опухолями; требуют дифференциальной диагностики при метастазировании солидных опухолей в кости (наиболее часто костные метастазы наблюдаются при раке молочных желез у женщин, опухолях легких, предстательной железы у мужчин). Метастазирование в кости скелета проявляется нарушением ритма боли: в этом случае характерны выраженные ночные боли с усилением при движениях и отсутствием улучшения в покое, которые сопровождаются общими симптомами (указание на выраженное похудание, извращением или отсутствием аппетита, слабость, анемия и др.), а также неполным эффектом от НПВП. При подозрение на наличие метастазов требуется выполнить рентгенологическое дообследование (рентгенография, КТ). Рекомендована сцинтиграфия с радиоактивным технецием. При выявлении новообразований – трепанобиопсия с целью верификации типа опухоли.
12. Большую сложность вызывает дифференциальный диагноз СпА и лимфопролиферативных заболеваний на ранних этапах. Во всех случаях, когда у пациента молодого возраста имеют место диффузные боли в позвоночнике, костях таза, других плоских костях, общие симптомы (субфебрилитет, снижение массы тела, слабость и др.), нетипичный «разлитой» отек костного мозга костей таза и позвонков, необходимо исключить лимфопролиферативное заболевание путем выполнения биопсии лимфатических узлов (при наличии) или трепанобиопсии подвздошной кости. У лиц старшей возрастной группы аналогичные симптомы при ускорении СОЭ требуют исключения парапротеинемий (исследование М-градиента, стернальная пункция и/или трепанобиопсия).
13. Среди инфекционных заболеваний наибольшее сходство со СпА имеют бруцеллезный спондилит и туберкулез костей. Особенности лихорадки (волнообразная при бруцеллезе), анамнестические указания на контакт с продуктами животноводства (для туберкулеза и бруцеллеза) или с больными туберкулезом лицами, а также указание на наличие туберкулеза любой локализации в анамнезе требует проведения дообследования для исключения этих инфекций (рентгенография или КТ органов грудной клетки, кожные тесты и/или квантифероновый тест при подозрении на туберкулез, выполнение ИФА- и ПЦР-тестов для выявления бруцеллеза). Следует иметь в виду наличие специфических МР-признаков туберкулезного спондилита, сакроилиита и коксита (туберкулезный инфильтрат, как правило, распространяется за пределы анатомической границы пораженной кости, формируя так называемые натечники).
Среди инфекционных заболеваний, имитирующих СпА, достаточно распространены бактериальные спондилиты, спондилодисциты, сакроилииты. Чаще других клиницистам встречается стафилококковый спондилит, для которого характерно повышение температуры тела до фебрильных значений (часто с гектическими размахами), наличие анамнестических указаний на «входные ворота» инфекции – разные формы стафилодермии (акне, фурункулез). Также в анамнезе у таких пациентов нередко имеют место длительно не заживающие инфицированные раны на коже (том числе паронихии), внутривенные инфузии; при этом особо пристального внимания заслуживают ослабленные пациенты с иммуносупрессией (опухоли, ВИЧ-инфекция) и лица, употребляющие внутривенные наркотики. Бактериальные спондилодисциты и сакроилииты не редкость при инфекционных эндокардитах: появление болей в спине у таких пациентов требует в первую очередь исключения бактериальных отсевов в позвоночник. Бактериальные спондилодисциты и сакроилииты распространяются за пределы анатомической структуры пораженной кости, для них характерно формирование внутрикостных секвестров, очагов деструкции, а также абсцессов/флегмон и других форм инфекционного поражения прилежащих мягких тканей.
14. К редким причинам болей в спине относят подагрический спондилит с отложением кристаллов моноурата натрия внутрикостно («пробойник позвонка») или паравертебрально (паравертебральные тофусы).
15. Еще одна крайне редкая причина болей в спине – болезнь Уиппла, проявляющаяся диареей, стеатореей, похуданием, лихорадкой и полисерозитом.
ЗАКЛЮЧЕНИЕ
Очевидно, что изучение СпА переживает очередной виток быстрого накопления данных об этиологии, патогенезе, особенностях клинического течения и прогрессирования, что приводит к постоянным изменениям терминологии, подходов к диагностике и лечению этой группы заболеваний. Указанные изменения требуют постоянного повышения квалификации врачей, работающих в реальной клинической практике.
Обращаем внимание читателя на тот факт, что целью указанной статьи явилось отражение ситуации, актуальной на настоящий момент и о некоторых ожидаемых в сфере концепции СпА изменениях.



