Рассеянный склероз (РС) – хроническое прогрессирующее заболевание центральной нервной системы, которое характеризуется рецидивирующими эпизодами воспаления и демиелинизации, приводящими к непрерывной дегенерации аксонов и необратимой прогрессирующей инвалидности [1].
В литературных источниках представлена информация о том, что у людей с этим неврологическим заболеванием повышен риск возникновения сердечно-сосудистых заболеваний [2– 5].
Поскольку в настоящее время сердечно-сосудистая система и, в частности, микроциркуляторное русло у больных РС изучены недостаточно, необходимо обратить особое внимание на оценку состояния и выявления расстройств тканевого микрокровотока для ранней диагностики и профилактики кардиоваскулярных заболеваний, а также оптимизации терапии РС (использования вазоактивных препаратов, способных повлиять на показатели тканевой перфузии) [6].
Расстройства микроциркуляции отличаются разнообразием по патогенезу и клиническим проявлениям. Система микроциркуляции крови состоит из множества взаимосвязанных сосудов от 2 до 200 мкм в диаметре, принимает важное участие в поддержании обменных процессов во всех системах организма, обеспечении транспорта и потребления кислорода на системном и локальном уровнях. Изучение функциональных особенностей микроциркуляторного русла у здоровых лиц и при различной патологии является актуальной и сложной проблемой современной медицины [7, 8].
В состав микроциркуляторной системы входят микрососуды, способствующие метаболизму клеток окружающих тканей [9, 10]. Вклад микрокапиллярного русла в обменные процессы зависит от количества и диаметра сосудов, одновременно участвующих в обеспечении кровотока. Перепад давления на «входе» и «выходе» микроциркуляции оказывает влияние на микрососуды, принимающие участие в обеспечении перфузионных способностей тканей [11, 12].
В последнее время для изучения состояния системы микроциркуляции широко используется метод лазерной допплеровской флоуметрии (ЛДФ). В его основе лежит регистрация допплеровского сдвига частоты оптического излучения при движении форменных элементов крови за счет зондирования тканевой поверхности низкоинтенсивным лазерным излучением. ЛДФ-сигнал способен оценить микрокровоток в объеме до 1,5 мм3 ткани [11, 13].
Метод ЛДФ позволяет изучать функциональное состояние периферической гемодинамики. В норме и при патологических состояниях выявлены значимые различия перфузионной способности тканей. Сложности механизмов регуляции микрокровотока объясняются вегетативным статусом обследованных лиц [14].
Исходя из вышеизложенного, целью нашего исследования стало определение особенностей микроциркуляторного русла у больных с ремиттирующим течением РС, определение типа микроциркуляции методом ЛДФ.
МАТЕРИАЛ И МЕТОДЫ
В этой статье приведена вторая часть нашего крупного исследования сердечно-сосудистой системы у больных с ремиттирующим течением РС. В первой части были описаны результаты суточного мониторирования артериального давления с определением суточной жесткости сосудистой стенки, суточного мониторирования ЭКГ по Холтеру, эхокардиографического исследования, состояния системы «оксидант/антиоксидант», эндотелиальной дисфункции [15].
В исследование принимало участие 45 пациентов с ремиттирующим течением РС, диагностированным в соответствии с международными критериями МакДональда (2010). Среди обследованных было 17 мужчин и 28 женщин в возрасте 28 [24; 32] лет. Длительность заболевания составила 5,5 [2; 7] лет, средняя частота обострений в год – 0,8 [0,38; 1] (группа 1). В качестве контрольной группы (группа 2) были отобраны 15 практически здоровых пациентов (10 женщин и 5 мужчин) без клинических проявлений неврологических заболеваний. Средний возраст пациентов составил 30 [25; 33] лет.
При сборе анамнеза у пациентов обеих групп не было выявлено заболеваний сердечно-сосудистой системы, сахарного диабета, ишемической болезни сердца, артериальной гипертонии. Пациенты обеих групп не принимали препараты, способные повлиять на уровень артериального давления и микрокровоток.
Больным РС была произведена оценка инвалидизации по шкале Expanded Disability Disease Score (EDSS). 10-бальная шкала тяжести заболевания позволяет оценить состояние отдельных неврологических областей. В настоящем исследовании EDDS составила 2,54 [1; 3,5] баллов.
Для изучения состояния микрокровотока использовался метод ЛДФ с применением лазерного анализатора ЛАКК-ОП (НПП «Лазма», Москва). В основе метода ЛДФ лежит постановка световодного зонда в зоне Захарьина–Геда на подушечке II пальца, далее производилась запись ЛДФ-граммы у пациента в состоянии покоя в течение 15 мин. С целью определения типов микроциркуляции осуществлялось проведение окклюзионной пробы.
Для изучения общего состояния микроциркуляторного русла определяли следующие показатели ЛДФ: показатель микроциркуляции (ПМ), отражающий уровень перфузии, среднеквадратичное отклонение (σ), коэффициент вариации (Кv), а также амплитудно-частотные характеристики отраженного сигнала. Среднеарифметическое значение уровня перфузии (М), σ и Kv позволяют оценить общее состояние микроциркуляции крови. Для более тонкого изучения функциональных особенностей микроциркуляторного русла применяется исследование структуры ритмов колебаний кровотока. Величина амплитуды колебаний кровотока микрососудов в частотных диапазонах позволяет оценить функциональные особенности механизмов контроля перфузии [12].
Механизмы регуляции микрокровотока на частоте 0,005–3 Гц формируют пять частотных спектров, которые, согласно литературным данным, можно подразделить на «пассивные» и «активные»:
- диапазон эндотелиальной активности (0,007–0,017 Гц);
- диапазон нейрогенной симпатической активности (0,023–0,046 Гц);
- диапазон гладкомышечной активности (0,05–0,145 Гц);
- диапазон дыхательного ритма (0,2–0,4 Гц);
- диапазон сердечного ритма (0,8–1,6 Гц) [13].
Для расчета амплитудно-частотного спектра колебаний и оценки влияния «активных» и «пассивных» механизмов регуляции микрокровотока используется метод вейвлет-преобразования.
По величине амплитуд колебаний кровотока затруднительно оценить работу механизмов регуляции ввиду большого разброса результатов измерений. В связи с этим анализ нормированных (Amax./M) и приведенных (Amax./3σ) характеристик спектров колебаний позволяет облегчить понимание работы механизмов регуляции микроциркуляторного русла и используется для исключения вклада второстепенных факторов, оказывающих влияние на перфузионную способность тканей [12, 14].
Для более подробного изучения состояния микроциркуляторного русла методом ЛДФ используются функциональные пробы, которые позволяют оценить резервы микрокровотока и определить функциональную активность механизмов регуляции перфузионной способности тканей [16].
В настоящем исследовании для изучения резервных возможностей микроциркуляторного русла, а также для определения типов микроциркуляции осуществлялось проведение обтурационной пробы ЛДФ. В ее основе лежит остановка кровотока (ишемия) изучаемой области посредством пережатия в течение 1–3 мин исследуемого участка конечности манжетой тонометра. У здоровых лиц при прекращении окклюзии отмечается возобновление кровотока с развитием реактивной постокклюзионной гиперемии. При этом происходит возрастание показателя микроциркуляции до определенного уровня, превышающего исходную величину ПМ с постепенным снижением до исходного уровня [17].
При интерпретации результатов окклюзионной пробы оцениваются следующие показатели:
- ПМ исх. – среднее значение показателя микроциркуляции в перфузионным единицах (пф. ед.) до окклюзии;
- ПМ мин. – минимальный средний уровень микроциркуляции в течение окклюзии;
- ПМ макс. – максимальное значение показателя микроциркуляции в постокклюзионный период;
- РКК – резерв капиллярного кровотока, рассчитываемый по формуле: ПМ макс./ПМ исх. × 100%. В группе здоровых лиц РКК составляет больше 200%;
- dM – уровень снижения кровотока в перфузионных единицах, который определяется как разность ПМ исх. и ПМ мин. dM% – уровень снижения кровотока в процентах;
- ПМ вост. – показатель микроциркуляции после восстановления кровотока либо до исходного уровня ПМ, либо на 1–3 пф. ед. выше ПМ исх. [17].
Анализ данных осуществлялся с использованием статистического пакета программ IBM SPSS Statistics (версия 22.0). Перед проведением расчетов выполнялась проверка на нормальность распределения по критерию Колмогорова–Смирнова. Ввиду того что большинство данных было отклонено от нормального распределения, описание выборок представлялось в виде медианы, 1 и 3 квартиля. Для выявления различий между анализируемыми группами был применен метод попарного сравнения групп с помощью непараметрического критерия Манна–Уитни. Статистически значимыми считались различия p <0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Все участники исследования были сопоставимы по полу, возрасту, индексу массы тела (ИМТ) и общеклиническим показателям. Сравнительная характеристика клинических и лабораторных показателей изучаемых групп представлена в таблице 1.
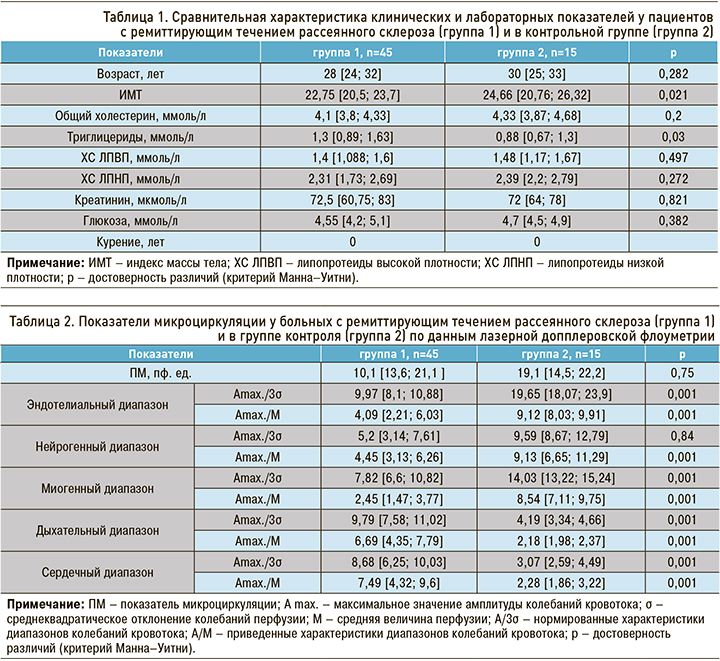
В таблице 2 приведена сравнительная оценка средних ПМ в обеих группах, полученных при проведении ЛДФ.
В основе колебательного процесса в ЛДФ-грамме лежит наложение колебаний, полученных при функционировании так называемых активных и пассивных факторов контроля микрокровотока. Активные факторы регулируют поток крови со стороны стенки сосудов, оказывая непосредственное влияние на ее мышечную составляющую, создавая поперечные колебания посредством чередования сокращения и расслабления мышц. К ним относятся миогенный, нейрогенный и эндотелиальный факторы контроля микроциркуляторного русла. В отличие от активных, пассивные механизмы регуляции модулируют колебания кровотока вне микроциркуляторного русла за счет периодического изменения объема крови в сосудах, создавая продольные колебания кровотока [13, 17]. К пассивным механизмам со стороны артерий относится пульсовая волна, со стороны вен – присасывающее действие «дыхательного насоса» [11, 18].
Использование частотного анализа отраженного сигнала при проведении ЛДФ на частоте 1 Гц позволило произвести оценку регуляторных особенностей системы микрокровотока.
В начале рассмотрим механизмы «активной» модуляции кровотока. При сравнении изучаемых групп по амплитуде миогенного ритма получено статистически значимое снижение показателя в группе больных РС по сравнению с контролем (p <0,01). Амплитуда миогенного ритма зависит от функционирования гладкомышечных клеток и регистрируется на уровне прекапилляров и сфинктеров.
В исследовании Meyer M.F. et al. описана рациональность вазомоторных колебаний. При периодическом изменении мышечного тонуса сопротивление сосуда току крови ниже, чем сопротивление сосуда с постоянным диаметром. Увеличение амплитуды миогенных колебаний в ЛДФ-грамме обратно пропорционально колебаниям миогенного тонуса, что характеризует снижение миогенного периферического сопротивления. Регистрируемые на капиллярном уровне миогенные и пульсовые колебания проникают с током крови через прекапилляры [19].
Выявленное достоверное снижение амплитуды миогенных колебаний в группе больных РС свидетельствует о повышении мышечного сопротивления и снижении перфузионной способности тканей [12, 17, 19].
В сосудах кожи расположены преимущественно α-адренорецепторы, роль β-адренорецепторов клинически не значима. Под действием адреналина происходит стимуляция α2-адренорецепторов, что приводит к вазоконстрикции сосудов кожи. В литературе сообщается об отсутствии парасимпатической холинергической иннервации кожных сосудов. За счет этого при повышении симпатической активности происходит выраженная вазоконстрикция микрососудов кожи (артериол и артериоло-венулярных анастомозов), не уравновешиваемая метаболической вазодилатацией [20]. По амплитуде нейрогенной симпатической регуляции можно судить о количестве задействованных нервных волокон, а по частоте – об активности симпатической нервной системы [21].
При проведении сравнительной характеристики между изучаемыми группами у больных РС выявлено достоверное снижение амплитуды колебаний в нейрогенном диапазоне по сравнению с контролем (p <0,01). Полученные данные демонстрируют регрессивное влияние симпатической нервной системы на микрокровоток.
Вышеописанные изменения приводят к мысли о том, что снижение тонуса микрососудов связано с предрасположенностью больных с РС к артериальной гипотонии.
Впервые симпатический генез колебания микрокровотока был описан в работе Kastrup J. et al. (1989). Снижение влияния симпатических колебаний на микроциркуляторное русло может встречаться при нехватке или дисфункции симпатических волокон (вегетативной полинейропатии, невритах, нарушении целостности нервных волокон, общем нагреве тела) [22].
Рассмотрим еще один «активный» фактор контроля микроциркуляции – эндотелиальный. Известно, что эндотелиальная регуляция сосудистого диаметра оказывает влияние на прекапиллярное звено: артерии, артериолы, прекапилляры. Микроваскулярный эндотелий осуществляет модуляцию мышечного тонуса сосудов секрецией в кровь периодически изменяющихся концентраций вазоактивных субстанций. Kvandal P. et al. (2003) обосновали, что эндотелиальный выброс оксид азота (NO) включен в физиологическую регуляцию мышечного тонуса и играет важную роль в регуляции давления и распределения потока крови [23–25]. В настоящем исследовании при сравнении изучаемых групп у пациентов РС было выявлено снижение амплитуды колебаний в эндотелиальном диапазоне (p <0,01).
При оценке «пассивных» механизмов регуляции микрокровотока выявлены статистически значимые различия: в группе больных РС диапазон сердечных и дыхательных колебаний был выше по сравнению с контрольной группой (р <0,001).
Регрессия нейрогенной симпатической активности способствует расслаблению сосудов и увеличению кардиального ритма в системе микроциркуляции посредством возрастания притока артериальной крови, создаваемой пульсовой волной. Амплитуда пульсовой волны также может быть увеличена при снижении эластичности сосудистой стенки [26].
Колебание венозного давления в системе микроциркуляции формирует дыхательную волну посредством механической активности легочной ткани и работе «дыхательного насоса». Динамическая циклическая работа дыхательных мышц на вдохе способствует снижению давления в грудной клетке, вплоть до отрицательных значений, что объясняет функциональность «дыхательного насоса». Амплитуда дыхательной волны может возрастать, демонстрируя при этом снижение давления в микроциркуляторном русле. Отток крови из микрососудов, наряду с увеличением объема крови в венулах, приводит к повышению амплитуды респираторной волны, что объясняет генез застойных явлений в системе микроциркуляции [25–27].
Таким образом, анализируя влияние механизмов регуляции периферического кровотока у больных с ремиттирующим течением РС, был выявлен дисбаланс факторов контроля перфузии в виде регрессии «пассивных» и активацией «активных» факторов.
За счет регрессии «активных» факторов контроля кровотока на участке микроциркуляторного русла с большим сопротивлением происходит сокращение объемного кровотока с проявлением стазических изменений и преобладанием анаэробного метаболизма в окружающих тканях. За счет снижения влияния миогенных колебаний отмечается шунтирование кровотока, при этом больший объем крови, притекающий в систему микроциркуляции, поступает по меньшей части капилляров, приводя к метаболическому «обкрадыванию» периферических тканей. При сокращении объемного кровотока отмечается дисфункция механизмов регуляции межклеточного обмена и объемных процессов в периферических тканях. Наиболее чувствительно к этому нутритивное звено микроциркуляторного русла. Артериоловенулярные и артериовенозные анастомозы наиболее устойчивы к нарушениям микроциркуляции, способствуя сохранению микрокровотока при распространении стаза на большую часть микроциркуляторного русла [28]. При различных нарушениях гемодинамики встречаются расстройства проницаемости стенки капилляров, в результате приводя к повышению гипоксии и тканевой ишемии [16, 28].
При изучении адаптационных резервов микроциркуляторного русла, оценке «активных» и «пассивных» механизмов регуляции микрокровотока и общего состояния микроциркуляции используют функциональные пробы, что позволяет характеризовать системные и органные расстройства микроциркуляции [12].
Анализируя показатели обтурационной пробы в изучаемых группах, в группе больных РС отмечено достоверное снижение РКК (p <0,001) и dM (p <0,001). Изучение вышеописанных показателей способствовало определению гемодинамических типов микроциркуляции обследуемых групп. Остальные показатели окклюзионной пробы в группах статистически не отличались (табл. 3).
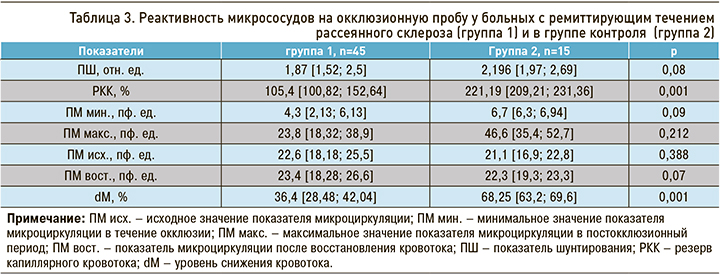
В.И. Маколкин с соавт. предложили классифицировать гемодинамические варианты периферического кровотока по отношению среднего значения потока крови в микроциркуляторном русле и величине РКК с выделением нормоциркуляторного, гиперемического, спастического и стазического гемодинамических типов микроциркуляции (общепризнанных значений РКК и dM нет) [11, 17].
Нормоциркуляторный тип микроциркуляции (200% ≤ РКК ≤300%, 40% ≤ dM ≤70%) чаще встречается у здоровых людей и характеризуется наиболее благоприятными функциональными показателями периферической гемоциркуляции и хорошим прогнозом.
При гиперемическом типе (РКК <200%, dM >70%) преобладает повышенный приток крови в микроциркуляторное русло, значительно увеличивается число функционирующих капилляров, повышается их извитость, происходит расширение микрососудов, что обусловливает гиперемию тканей, отмечается эффективный отток венозной крови, повышается проницаемость сосудистой стенки [6, 7].
Спастический тип (РКК >300%, или 200% ≤РКК ≤300% и dM <40%, ПМ исх. <6–7 п.е.) характеризуется побледнением капилляроскопического фона, резким уменьшением или отсутствием капиллярных петель, выраженными нарушениями калибра и формы капиллярных петель. Чаще всего встречается при повышении тонуса симпатической нервной системы [16, 17].
Стазический тип (РКК <200%, dM <40%) выражается в полиморфизме капиллярных петель. Количество капилляров увеличено. Наряду с капиллярами правильной формы располагаются мелкие или крупные, удлиненные и крайне извитые капиллярные петли, часто неравномерные в диаметре. В описанных петлях кровоток замедлен, крупнозернистый, с остановками. Указанные изменения капиллярного кровообращения развиваются при нарушениях нейрогенного контроля или полной денервации сосудов микроциркуляторного русла кожи [11, 16, 17].
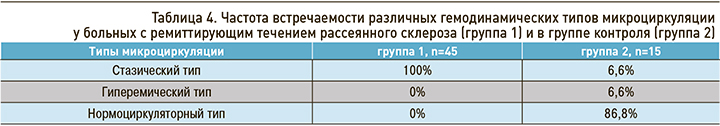
В настоящем исследовании при оценке состояния периферической гемодинамики в группе пациентов с РС в 100% случаев отмечался стазический тип микроциркуляции. У пациентов контрольной группы как наиболее распространенный (86,8% случаев) выявлен нормоциркуляторный тип (табл. 4).
ЗАКЛЮЧЕНИЕ
В группе больных РС выявлено нарушение равновесия регуляторных механизмов периферической гемодинамики с преобладанием «пассивных» (респираторные, сердечные ритмы) и уменьшением «активных» (миогенный, нейрогенный, эндотелиальный) факторов контроля перфузии. Это, вероятнее всего, связано с нарушением нейрогенного контроля микроциркуляторного русла (дисбаланс вегетативного контроля со снижением активности симпатической нервной системы), что является отражением патогенеза РС.
Прогрессирование перфузионных нарушений у пациентов РС, вероятно, также связано со снижением сосудистой эластичности.
У больных РС выявлено преобладание патологического вида микроциркуляции – стазического, который характеризуется снижением кровотока в капиллярном звене системы микроциркуляции с повышенной агрегацией эритроцитов и нарушением барьерной функции микрососудов.
Показатели обтурационной пробы (снижение резерва капиллярного кровотока) сопоставимы с данными частотного анализа и преобладанием стазического типа микроциркуляции в группе больных РС и демонстрируют выраженные перфузионные нарушения кровотока тканей и дисбаланс равновесия механизмов регуляции капиллярокровотока и межклеточного обмена. Вышеописанные изменения способствуют нарушению проницаемости, нарастанию гипоксии, преобладанию анаэробного метаболизма и ишемии тканей.
Безусловно, эти процессы требуют дальнейшего изучения с исследованием различных методов коррекции. Необходимо разработать дифференцированный подход к терапии с учетом выявленных изменений, особенно при использовании «вазоактивных» препаратов, которые способны усугубить имеющиеся нарушения.


