Семейная гиперхолестеринемия (СГХС) — распространенное аутосомно-доминантное заболевание, которое обусловлено мутацией генов, оказывающих влияние на обмен липопротеидов низкой плотности (ЛПНП) и ответственных за синтез мембранного рецептора к ним [1]. СГХС повышает риск развития сердечно-сосудистых заболеваний (ССЗ) атеросклеротического генеза, клиническая манифестация которых происходит в молодом и даже детском возрасте и приводит к 20-кратному увеличению риска сердечно-сосудистой смерти [2]. Среди лиц с гиперхолестеринемией СГХС встречается в 5—10% случаев.
Генетическая природа СГХС обусловлена дефектами генов рецептора ЛПНП (LDLR), аполипопротеина В-100 (АpoВ), пропротеин-конвертазы субтилизин/кексина типа 9 (PCSK9), CYP7A1, располагающегося в 8-й хромосоме и кодирующего синтез 7α-редуктазы, а также АТФ-связанных кассетных (АВС) белков-транспортеров холестерина ABCG5 и ABCG8.
В настоящее время насчитывается более 1700 вариаций мутаций в гене LDLR, 4 — АpoВ и 167 — PCSK9 [1]. Мутации гена LDLR обусловливают от 85 до 90% случаев СГХС, гена АpoВ — 5—10%, гена PCSK9 — меньше 5%. Для носителей мутаций гена LDLR характерны более высокие уровни общего холестерина (ОХС) и ХС ЛПНП и более выраженные проявления атеросклероза, чем для носителей мутаций гена АpoВ. Уровни ХС ЛПНП у носителей миссенс-мутаций PCSK9 варьируют от умеренных до очень высоких. Мутации в генах LDLRAP1, ABCG5, ABCG8, CYP7A1 имеют рецессивный тип наследования и клинически проявляются только как гомозиготная форма СГХС (гоСГХС).
ЭПИДЕМИОЛОГИЧЕСКИЕ АСПЕКТЫ СЕМЕЙНОЙ ГИПЕРХОЛЕСТЕРИНЕМИИ
Вероятность выявления дефектного гена у родственников первой линии больного СГХС составляет 50%, что определяет достаточно высокую распространенность гетерозиготной формы заболевания в общей популяции — до 1:500. Согласно результатам последних исследований, частота встречаемости гетерозиготной СГХС (геСГХС) в европейских странах может достигать 1 случая на 200 человек [2]. В отдельных этнических группах распространенность СГХС еще выше: среди ливанцев — 1:170, на территории Северной Африки, в частности, у евреев-ашкенази 1:100.
По разным данным, в мире насчитывается от 15 до 34 млн больных гетерозиготной формой СГХС. Однако во многих странах количество диагностированных случаев СГХС составляет менее 1%. Наибольшего успеха в скрининге больных СГХС достигли в Нидерландах, где установленный диагноз имеет 71% из 33,3 тыс. больных геСГХС. Такое количество больных рассчитано исходя из предполагаемой распространенности заболевания в популяции 1:500. Далее следует Норвегия — 43% диагностированных случаев на 9,9 тыс. больных, Исландия — 19% на 600, Швейцария — 13% на 15,6 тыс., Великобритания — 12% из 123 тыс. больных [3].
Гомозиготная СГХС, являющаяся более тяжелой и прогностически неблагоприятной формой, встречается реже — с частотой от 1:500 тыс. до 1:1000 тыс. населения — и ассоциируется с ранней смертью в возрасте до 10 лет при отсутствии лечения. Значения ЛПНП у таких пациентов составляют 8,5 ммоль/л и выше [1]. Обычно эта форма СГХС диагностируется у детей от близкородственных браков [4].
С учетом приведенной выше статистики в России с численностью населения на 1 января 2020 г. 146,8 млн человек расчетное количество пациентов с гетерозиготной формой СГХС может достигать 730 тыс. (или около 294 тыс. из расчета 1 случай на 500 человек). При этом в нашей стране СГХС диагностируется крайне редко. Между тем, по данным исследования, проведенного в Москве в 2012 г., из 2400 человек, впервые обратившихся за медицинской помощью в поликлинику, уровень ОХС >7,5 ммоль/л был определен у 12%, а уровень холестерина ЛПНП (ХС ЛПНП) >4,9 ммоль/л — у 10% [5]. При этом в российском исследовании АРГО, включавшем 18 273 пациента с высоким и очень высоким сердечно-сосудистым риском, превышение целевого уровня ОХС было выявлено у 81,3% женщин и 78,9% мужчин [6]. Результаты совместного проекта Национального общества по изучению атеросклероза (НОА) и независимой лаборатории «ИНВИТРО» также свидетельствуют о высокой встречаемости гиперхолестеринемии: из 18 тыс. человек, посетивших офисы лаборатории в Москве и Московской области, значения ОХС ≥7,5 ммоль/л выявлены у 8% лиц [7]. В многоцентровом наблюдательном исследовании ЭССЕ-РФ в Тюменской и Кемеровской областях с участием 1630 и 1622 человек соответственно частота выявления лиц с определенным диагнозом геСГХС составила 0,24% (1:407), с вероятным диагнозом геСГХС — 0,68% (1:148) [8].
Таким образом, истинная распространенность СГХС в нашей стране, возможно, выше, нежели расчетная частота 1:500, однако точных сведений на этот счет нет в связи с отсутствием универсального скрининга данного заболевания, недостаточной осведомленностью врачей (особенно первичного звена здравоохранения) о проблеме СГХС, а также низким уровнем настороженности в отношении пациентов с ранними проявлениями ишемической болезни сердца (ИБС) и выраженной гиперхолестеринемией. Несмотря на достаточно широкую распространенность, СГХС часто остается нераспознанной, что свидетельствует о необходимости существенного улучшения информированности об этом заболевании как медицинских работников, так и населения в целом [9].
С целью объективной оценки эпидемиологической ситуации и организации медицинской помощи больным СГХС в 2013 г. был создан Российский многоцентровый регистр семейной гиперхолестеринемии (РоСГХС), в рамках которого сформирована большая выборка пациентов с СГХС из разных регионов страны [7, 10]. В 2017 г. он был преобразован в регистр РЕНЕССАНС (Регистр пациентов с СГХС и пациЕНтов очень высокого сЕрдечно-Сосудистого риска с недоСтАточной эффективНоСтью проводимой гиполипидемической терапии). Согласно данным регистра, распространенность гетерозиготной формы СГХС в России составляет приблизительно 1:250. Этот факт свидетельствует о вкладе СГХС в показатели высокой смертности от ССЗ в нашей стране. Результаты этой научно-исследовательской программы обеспечивают доказательную базу для изменения политики в сфере здравоохранения в отношении больных СГХС с целью снижения сердечно-сосудистого риска, заболеваемости и смертности в России [11].
ДИАГНОСТИЧЕСКИЕ КРИТЕРИИ СЕМЕЙНОЙ ГИПЕРХОЛЕСТЕРИНЕМИИ
Об актуализации проблемы СГХС свидетельствует появление в течение последних лет обобщенного руководства по лечению семейной гиперхолестеринемии Международного фонда СГХС (2014) [12], новых рекомендаций Европейского общества кардиологов (ЕОК) и Европейского общества атеросклероза (ЕОА) по диагностике и лечению дислипидемий (2019), в которых отдельный раздел посвящен терапевтической тактике при СГХС [13], а также выпуск в 2017 г. Российских рекомендаций по диагностике и лечению этого заболевания [14].
Согласно отечественным рекомендациям, лечебно-диагностический алгоритм при СГХС базируется на четырех этапах: выявление лиц с подозрением на СГХС, установление диагноза, подбор терапии, диспансерное наблюдение [14].
Существует два дополняющих друг друга диагностических подхода к выявлению больных СГХС:
- выявление фенотипических признаков, обусловленных выраженностью и длительностью гиперхолестеринемии;
- исследование генотипа с определением функционально значимых мутаций в генах рецептора ЛПНП, ApoB-100, PCSK9 [15].
 «Классическая» картина СГХС подразумевает высокие уровни ОХС и ХС ЛПНП в плазме крови при условии двукратного измерения натощак (у лиц старше 16 лет — ОХС ≥7,5 ммоль/л или ХС ЛПНП ≥4,9 ммоль/л, у детей и подростков — ОХС ≥6,5 ммоль/л или ХС ЛПНП ≥4,1 ммоль/л) в сочетании с наличием кожных и сухожильных ксантом, липоидной дуги роговицы и/или быстрым развитием атеросклеротического поражения сосудов [16]. С учетом генетической обусловленности этой патологии раннее развитие атеросклеротических заболеваний у членов семьи пациента с подозрением на СГХС является диагностически значимым.
«Классическая» картина СГХС подразумевает высокие уровни ОХС и ХС ЛПНП в плазме крови при условии двукратного измерения натощак (у лиц старше 16 лет — ОХС ≥7,5 ммоль/л или ХС ЛПНП ≥4,9 ммоль/л, у детей и подростков — ОХС ≥6,5 ммоль/л или ХС ЛПНП ≥4,1 ммоль/л) в сочетании с наличием кожных и сухожильных ксантом, липоидной дуги роговицы и/или быстрым развитием атеросклеротического поражения сосудов [16]. С учетом генетической обусловленности этой патологии раннее развитие атеросклеротических заболеваний у членов семьи пациента с подозрением на СГХС является диагностически значимым.
Фенотипические признаки, данные генетического анализа и отягощенный индивидуальный или семейный анамнез лежат в основе критериальных систем диагностики СГХС. Однако ни одна из них не получила повсеместного международного признания [17, 18, 19].
Критерии голландской сети клиник для лечения нарушений липидного обмена (DLCNC — Dutch Lipid Clinic Network Criteria) (табл. 1) используются для определения численного показателя (суммы баллов), позволяющего оценить вероятность наличия заболевания. Они получили широкое признание благодаря относительной простоте, доступности и полноте [13, 17]. Вычисляемый показатель является весьма чувствительным, сумма баллов более 5 указывает на высокую вероятность наличия СГХС.
Система британских критериев Саймона Брума (Simon Broome Registry) сравнима с DLCNC по эффективности прогнозирования мутаций, ассоциированных с СГХС, но не включает оценку липоидной дуги роговицы и менее надежна у пациентов без явной гиперхолестеринемии (табл. 2) [20]. Тем не менее система британских критериев диагностики СГХС продемонстрировала высокую чувствительность (93%) и специфичность (82%) в российской популяции [14].
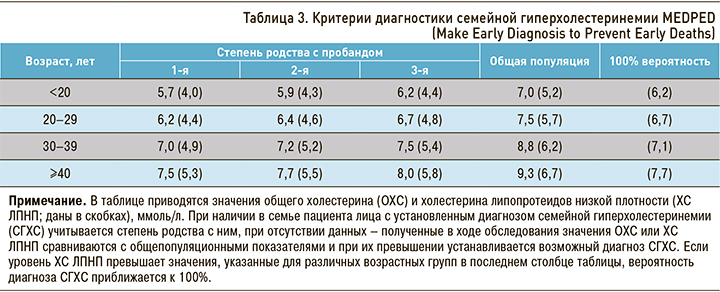
Американская система MEDPED (Make Early Diagnosis to Prevent Early Deaths — MEDPED) применяется для постановки диагноза СГХС у родственников индексного пациента. Она проста в использовании, так как предполагает использование только значений общего холестерина (ОХС) и ХС ЛПНП, стандартизованных по степени родства и возрасту обследуемого. MEDPED может быть менее специфичной в прогнозировании наличия мутаций, чем другие методы (табл. 3) [17, 20].
Японские критерии, которые сравнимы с системой Саймона Брума, используют в качестве порогового уровень ХС ЛПНП >4,7 ммоль/л в определенной популяции и допускают использование методов лучевой диагностики ксантом ахиллова сухожилия [19].

У детей и подростков в возрасте до 16 лет используют британские критерии. В возрасте до 19 лет возможно также применение модифицированных критериев экспертов Европейского общества по атеросклерозу (EAS) [13].
Для установления простых и гармонизированных критериев клинической диагностики СГХС необходимы дальнейшие международные исследования.
ОСОБЕННОСТИ ДИАГНОСТИКИ СЕМЕЙНОЙ ГИПЕРХОЛЕСТЕРИНЕМИИ У ПРОБАНДА И РОДСТВЕННИКОВ
Прогноз при СГХС во многом зависит от своевременности распознавания заболевания, чему способствуют различные виды скрининга: таргетный, оппортунистический, универсальный и каскадный [9]. При таргетном (прицельном) скрининге больных СГХС выявляют среди взрослых с преждевременным развитием ССЗ (до 50 лет — у мужчин и до 60 лет — у женщин). Такой скрининг целесообразно проводить в кардиологических стационарах и отделениях сердечно-сосудистой хирургии [21, 22]. При оппортунистическом скрининге проводится исследование концентрации ХС ЛПНП (с учетом пола и возраста) у взрослых, обращающихся в медицинские организации первичного звена. Универсальный скрининг проводится у лиц моложе 20 лет и детей до начала полового созревания [23]. Одна из проблем диагностики СГХС в России состоит в том, что на сегодня определение как ОХС, так и его фракций не входит в стандарты обследования детей; это исключает возможность универсального скрининга.
После выявления индексного пациента с СГХС необходим каскадный скрининг, который начинают с ближайших родственников (родителей, братьев, сестер и детей), а затем обследуют родственников 2-й и 3-й степеней родства [13]. Дети с признаками гомозиготной СГХС или находящиеся в группе риска должны проходить скрининг как можно раньше [24]. Каскадный скрининг в Российских рекомендациях назван наиболее целесообразным способом диагностики СГХС, так как он позволяет определить заболевание на доклиническом этапе, начать своевременное лечение и предупредить развитие ССЗ и осложнений.
Возможны две стратегии каскадного скрининга родственников пробанда: генетическая и фенотипическая. Молекулярно-генетическое обследование позволяет определить наличие СГХС даже в случае, если уровень ХС ЛПНП ниже диагностических значений, характерных для этого заболевания [13].
Спектр мутаций гена рецептора ЛПНП характеризуется выраженной гетерогенностью, включая миссенс-мутации, сплайсинг-мутации и крупные делеции, и специфичностью для разных этнических групп [23]. В результате исследований, проведенных в разных городах России (Санкт-Петербург, Москва, Новосибирск, Петрозаводск), выявлено отсутствие мажорных мутаций в гене рецептора ЛПНП [25—29], что подтверждает генетическую гетерогенность структурных изменений гена и свидетельствует о необходимости изучения спектра мутаций в регионах.
Для подтверждения диагноза геСГХС при наличии ≥6 баллов по шкалам DLCN или Simon Broome желательно проведение молекулярно-генетического исследования пробанда с выявлением патогенных вариантов генов LDLR, ApoB, PCSK9 [13]. Полученные данные могут быть полезными в диагностике заболевания у родственников пробанда.
Вместе с тем в реальных клинических условиях проведение генетического тестирования нередко затруднительно по причинам экономического или технического характера. В этих случаях при проведении каскадного скрининга среди родственников пробанда предлагается ориентироваться на стандартизованные по полу и возрасту пороговые значения ХС ЛПНП [30].
При этом показатели могут отличаться в различных этнических группах, и, если пороговые уровни ХС ЛПНП применимы для выявления пациентов с СГХС в странах, где присутствуют одна или несколько тяжелых мутаций общих для большинства населения (Финляндия, Южная Африка), они могут оказаться неэффективными в регионах с генетическим многообразием [31, 32]. Поэтому возможность применения конкретного уровня ХС ЛПНП в качестве порогового и сама стратегия скрининга СГХС могут отличаться в разных странах.
Более того, уровни ХС ЛПНП отличаются у носителей и неносителей мутации рецептора ЛПНП среди пациентов с СГХС. При этом уровень ХС ЛПНП, выше которого увеличивается число пациентов с мутациями рецептора ЛПНП, отличается в различных популяциях. Например, в Западной Австрии значения ХС ЛПНП 5,9 ммоль/л предсказывают наличие патогенной мутации у индексного пациента с максимальной чувствительностью и специфичностью, в то время как у пациентов с СГХС в Бразилии этот уровень составляет 6,5 ммоль/л [33].
Следует отметить, что в России в настоящее время отсутствуют стандартизованные по полу и возрасту значения ХС ЛНП, которые можно было бы использовать для диагностики СГХС. По данным исследования А.Н. Мешкова с соавт. (2011), разработанные в Великобритании пороговые значения ХС ЛНП с чувствительностью 93% и специфичностью 82% могут быть использованы для постановки диагноза СГХС в российской популяции [34] (рис.).
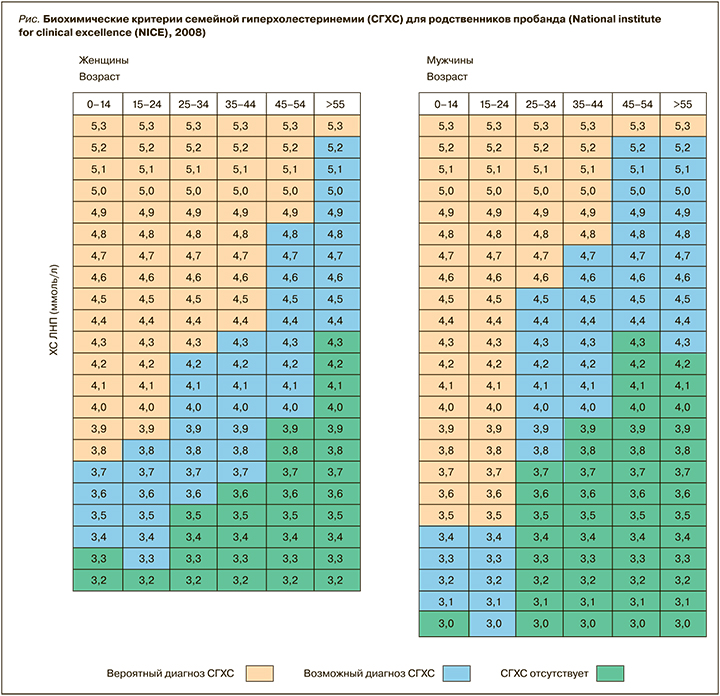
Однако, учитывая этническое разнообразие российской популяции, следует предполагать вариабельность уровней ХС ЛПНП в нашей стране, что определяет необходимость процесса стандартизации на уровне регионов.
Следует отметить, что даже при наиболее неблагоприятной, гомозиготной форме заболевания наблюдается разнообразие уровней ЛПНП и клинических проявлений. Так, по результатам исследования, выполненного в Академическом медицинском центре Амстердама на выборке, включавшей 104 682 пациента, выявлено, что уровень ХС ЛПНП зависел от локализации мутации: ниже всего показатели ХС ЛПНП были у гомозигот с мутациями в гене АроB-100. При этом у 49% больных даже в отсутствие гиполипидемической терапии значения ХС ЛПНП составляли менее 13,0 ммоль/л [35]. Также обращает на себя внимание тот факт, что заболевания, связанные с атеросклерозом, имелись только у 29% пациентов, несмотря на их зрелый средний возраст [36]. Для подтверждения гоСГХС рекомендуется проведение молекулярно-генетических исследований с выявлением патогенных вариантов нуклеотидной последовательности в генах LDLR, АроВ, PCSK9, LDLRAP1, ABCG5, ABCG8, CYP7A1 [13].
ОЦЕНКА СЕРДЕЧНО-СОСУДИСТОГО РИСКА ПРИ СЕМЕЙНОЙ ГИПЕРХОЛЕСТЕРИНЕМИИ
Хотя, по данным группы американских исследователей, мутации в генах, связанных с развитием СГХС, обнаружены менее чем у 2% лиц с тяжелой гиперхолестеринемией (ХС ЛПНП >190 мг/ дл), наличие мутаций у этой категории пациентов приводит к увеличению сердечно-сосудистого риска в 22 раза [36]. Даже при более низких уровнях ХС ЛПНП у лиц, имеющих мутации в генах LDLR, риск ССЗ был значительно выше, чем у тех, кто не имел подобных генетических изменений [36].
С этими данными согласуются результаты, полученные в карельской популяции. При наличии мутации гена LDLR ИБС развивалась в среднем на 5 лет раньше. При этом у пациентов, имеющих показатели ХС ЛПНП менее 8,5 ммоль/л, при повышении уровня ХС ЛПНП на 1 ммоль/л частота ИБС возрастала на 4,5% [37]. При исследовании 219 больных геСГХС установлено, что частота мутаций у пациентов с уровнем ХС ЛПНП более 6,5 ммоль/л почти в 3 раза выше, чем у пациентов с ХС ЛПНП менее 6,5 ммоль/л (ОР 3,4; 95% ДИ [1,4; 8,1], р=0,006) [38]. При этом анализ гендерных особенностей значений ХС ЛПНП у пациентов с СГХС выявил характерные возрастные тренды для мужчин (нарастание с плато к возрасту 45 лет и последующим некоторым снижением после 60 лет) и женщин (плавное возрастание уровня холестерина с возрастом), сходные с общепопуляционными значениями [38].
Таким образом, выявление мутаций в генах, ассоциированных с СГХС, позволяет уточнить сердечно-сосудистый риск у пациентов с выраженной гиперхолестеринемией и соответственно выбрать для них оптимальную тактику лечения.
Сердечно-сосудистый риск при СГХС связан не только с влиянием генов, отвечающих за рецептор-опосредованную элиминацию ЛПНП из крови, но и совокупным воздействием многих других факторов — как генетических, так и средовых. В исследовании, включавшем 253 пациента с геСГХС, показано, что традиционные факторы сердечно-сосудистого риска также оказывают влияние на формирование ИБС и ее осложнений у этой категории больных [37]. Основными нелипидными факторами риска, по данным российского исследования, являлись артериальная гипертензия, возраст старше 40 лет и отягощенная по сердечно-сосудистой патологии наследственность [37].
Кроме того, независимым предиктором развития ССЗ и повышения риска осложнений при СГХС может считаться потенцирование атерогенеза в результате накопления липопротеида (а). Так, по данным В.А. Корневой с соавт., уровень липопротеида (а) повышен у 41,9% больных СГХС [39]. У больных СГХС, имеющих уровень липопротеида (а) ≥1,2 мг/дл, ИБС диагностировалась чаще (в 32,4% случаев) по сравнению с пациентами с нормальным уровнем (в 19,1% случаев). Частота встречаемости острого инфаркта миокарда (ОИМ) у пациентов с повышенным уровнем липопротеида (а) была выше, чем у лиц с нормальным уровнем: 23,5 и 8,5% соответственно (ОР 3,3; 95% ДИ [1,1; 9,8]; р=0,03). ОИМ у лиц моложе 40 лет был выявлен только среди лиц, имеющих повышенный уровень липопротеида (а) [39]. Недавно опубликованный авторским коллективом Национального медицинского исследовательского центра кардиологии Минздрава России клинический случай также продемонстрировал роль выраженной гиперлипопротеидемии (а) как фактора риска быстропрогрессирующей ИБС и ОИМ у молодой женщины с гетерозиготной СГХС [40]. Полученные результаты свидетельствуют о целесообразности определения уровня липопротеида (а) у больных СГХС для комплексной оценки риска сердечно-сосудистых осложнений.
Не вызывает сомнений, что своевременная и точная диагностика СГХС позволит повысить эффективность лечебно-профилактических мер в отношении ССЗ и их осложнений. Европейский опыт показал, что оптимальная гиполипидемическая терапия приводит к предотвращению 101 сердечно-сосудистой смерти на 1000 больных СГХС. При этом каскадный скрининг и интенсивная терапия статинами у больных СГХС сопоставимы по своим затратам с маммографией, используемой для выявления рака молочной железы [41]. Точный клинико-экономический анализ и разработка единых алгоритмов диагностики и лечения СГХС в нашей стране зависит от успешной реализации исследования в рамках регистра РЕНЕССАНС. Однако, согласно результатам программы, опубликованным в 2019 г., для СГХС в России характерны несвоевременная диагностика при высокой распространенности, низкая информированность врачей и пациентов, а также плохая приверженность гиполипидемической терапии с редким достижением целевого уровня ХС ЛПНП [11]. Так, из 1208 больных СГХС только 27% находились на гиполипидемической терапии к моменту включения в исследование. Целевого уровня ХС ЛПНП <2,5 ммоль/л, соответствующего категории высокого риска, достигли 13% пациентов, уровня ХС ЛПНП <1,8 ммоль/л — 6% больных [11].
ЗАКЛЮЧЕНИЕ
Очевидно, что для реализации возможностей лечения и профилактики осложнений СГХС необходимо создание и внедрение в клиническую практику программы развития различных видов скрининга этого заболевания с целью доклинической диагностики, коррекции факторов риска развития и прогрессирования атеросклероза, а также длительного динамического наблюдения выявленных больных.



