Сосудистый эндотелий является активной динамической структурой, представления о функциях которой значительно расширились в течение последних 15 лет [1].
Эндотелиальные клетки обеспечивают защиту сосудистой стенки от воздействия активных гуморальных факторов крови, регулируют целостность внутренней сосудистой выстилки. Эндотелий выступает активным эндокринным органом, продуцирующим в кровь биологически активные вещества, регулирующие сосудистый тонус [2–4]. При этом механизм его участия в возникновении и развитии различных сердечно-сосудистых заболеваний связан не только с регуляцией сосудистого тонуса, но и вовлеченностью в процессы атерогенеза, тромбообразования, защиты целостности сосудистой стенки [5]. Тромборезистентность эндотелия обеспечивается контактной инертностью эндотелиального монослоя, который вырабатывает вазоактивные тканевые гормоны (возодилататоры и вазоконстрикторы), модуляторы роста (индуцирующие и ингибирующие) и модуляторы воспалительных реакций, а также регуляторы гемостаза и активаторы тромбоза [6, 7].
В качестве основных причин, приводящих к формированию эндотелиальной дисфункции, рассматривают артериальную гипертензию (АГ), сахарный диабет, возраст, курение, гиперлипидемию, генетические дефекты и ишемическо-реперфузионные повреждения эндотелия. Механизмы, лежащие в основе эндотелиальной дисфункции при АГ, могут зависеть от наличия и степени гиперхолестеринемии [8, 9].
При гиперхолестеринемии происходит аккумуляция холестерина и перекисно-модифицированных липопротеидов низкой плотности (ЛПНП) на стенках артерий [10, 11], что на фоне дефицита антиоксидантых ферментов инициирует нарастание свободно-радикальных процессов и формирование патологического замкнутого круга с генерированием свободных радикалов, повреждающих сосудистый эндотелий. В итоге эндотелиальная дисфункция в своих поздних стадиях морфологически проявляется утолщением медии, уменьшением просвета сосуда, снижением эластичности сосудистой стенки (этому способствует повышенный уровень ангиотензина) и началом формирования атеросклеротической бляшки [12]. Эндотелиальная дисфункция тесно связана с параметрами жесткости сосудистой стенки, которые отражают степень ремоделирования сосудистого звена как органа-мишени у больных АГ [13]. Учитывая важную роль воспалительных реакций в развитии эндотелиальной дисфункции и атерогенеза при АГ, уровень С-реактивного белка [14] и содержание остеопонтина на фоне гипертонии могут рассматриваться как важные маркеры сосудистого ремоделирования [15, 16].
Одним из эффективных фармакологических способов нормализации функции сосудистого эндотелия может служить применение статинов, обладающих, наряду с гиполипидемическим эффектом [17], способностью уменьшать экспрессию эндотелиина-1 (мощного вазоконстриктора) и интенсивность воспалительных процессов в сосудистой стенке [18]. Наибольшей гиполипидемической активностью среди этого класса лекарственных средств обладают аторвастатин и розувастатин, при этом аторвастатин несколько уступает последнему по способности снижать уровень ХС ЛПНП [19, 20]. Однако оценка сравнительной способности этих препаратов улучшать функциональную активность сосудистого эндотелия не проводилась, хотя ее практическое значение не вызывает сомнения [21].
В связи с этим цель предлагаемой работы – провести сравнительную оценку влияния розувастатина в нескольких дозовых режимах и аторвастатина на параметры дисфункции сосудистого (артериального) эндотелия у больных АГ с высоким и очень высоким сердечно-сосудистым риском в составе комплексной терапии при длительном амбулаторном применении.
МАТЕРИАЛ И МЕТОДЫ
В исследование было включено 140 больных АГ II стадии, II–III степени тяжести, с продолжительностью болезни от 5 до 12 лет, которые на фоне антигипертензивной терапии (эналаприл по 20–40 мг/ сут, индапамид ретард по 1,5 мг/сут, метопролол по 100–150 мг/сут) в условиях амбулаторно-поликлинического наблюдения в течение года получали аторвастатин (Липримар) по 20 мг/сут, но не достигли целевого уровня общего холестерина (ОХС) и ХС ЛПНП. В связи с этим у данных пациентов аторвастатин был заменен на розувастатин (Розукард) в дозе 10 мг/сут. В случае недостижения целевого уровня ОХС и ХС ЛПНП в течение 4 нед доза розувастатина увеличивалась до 20 мг/сут, а если цель не достигалась и в последующие 4 нед – до 40 мг/ сут. Продолжительность лечения розувастатином и всего наблюдения составляла 18 мес, при этом дозу 10 мг/сут получали 90 (1-я группа), 20 мг/сут – 24 (2-я группа), 40 мг/ сут – 26 (3-я группа) пациентов.
Эндотелиальную дисфункцию определяли с помощью оценки эндотелийзависимой вазодилатации плечевой артерии (ПА) по методу Celermajer D.S. et al. (1992) [23]. Исследование проводилось в утренние часы, после 10 мин отдыха пациента в положении лежа на спине с помощью линейного датчика 7 МГц в триплексном режиме (В-режим, цветное допплеровское картирование потока) на аппарате Vivid S5 (General Electric, США). В исходном состоянии измеряли диаметр (D) правой ПА (сканировалась в продольном сечении на 3–5 см выше локтевого сгиба с топографической привязкой места расположения датчика к анатомическим ориентирам) и максимальную скорость артериального кровотока. Для получения увеличенного кровотока накладывали манжету сфигмоманометра на предплечье (дистальнее места сканирования артерии) и накачивали ее 5 мин до давления, на 50 мм рт. ст. превышавшего систолическое АД; после этого выполняли декомпрессию с измерением скорости кровотока в артерии в течение первых 15 с и регистрацией диаметра артерии в течение 60 с.
Степень изменения диаметра ПА (∆D, %) при реактивной гиперемии вычисляли по формуле:
∆D02 = (D0 - D2) × 100/D0, где D0 – диаметр ПА исходно; D2 – диаметр ПА при реактивной гиперемии.
Для определения степени изменения скорости кровотока в ПА (∆V, %) использовалась формула:
∆V02 = (V0 - V2) × 100/V0, где V0 – скорость кровотока в ПА исходно; V2 – скорость кровотока при реактивной гиперемии.
Также рассчитывалось напряжение сдвига кровотока на эндотелий (τ, дин/см2):
τ = 4 ВК × V max/D, где ВК – вязкость крови (Пуаз); V max – максимальная систолическая скорость кровотока (см/с); D – внутренний диаметр артерии (см).
Коэффициент эндотелиальной дисфункции устанавливался по формуле:
K= ((D0 - D2)/D0)/((τ0 - τ2)/τ0), где (D0 - D2) – изменение диаметра ПА в процессе реактивной гиперемии; τ – напряжение сдвига кровотока на эндотелий (дин/см2) [7].
Статистическая обработка результатов проводилась с использованием программы STATISTICA 10. Нормальность распределения подтверждалась расчетом коэффициента асимметрии, эксцесса, критерием Колмогорова–Смирнова. Данные представлялись в виде M ± m, где М – средняя арифметическая исследуемых величин, m – ошибка репрезентативности. Доверительные границы составляли p <0,05. Достоверность отличий сравниваемых групп оценивалась с применением критерия χ2.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Анализ изменения линейной скорости кровотока в результате терапии аторвастатином показал, что величина ∆V02 сократилась на 10,1% только у больных 2-й группы, переведенных впоследствии на розувастатин в дозе 20 мг/ сут; в других группах изменений зафиксировано не было. Замена аторвастатина на розувастатин в течение 6 мес сопровождалась (здесь и далее – в сравнении с уровнем к началу терапии розувастатином) снижением величины ∆V02 на 9,3% при приеме препарата в дозе 10 мг/сут и на 17,7% – 20 мг/сут; на фоне приема розувастатина в дозе 40 мг/сут изменение этого параметра не наблюдалось. Терапия розувастатином в дозе 10 мг/сут в течение 12 мес сопровождалась снижением ∆V02 на 11,2%, 18 мес – на 23,7%. Прием розувастатина в дозе 20 мг/сут приводил к незначительному дальнейшему снижению ∆V02 к 12-му месяцу терапии – на 15,2%; к 18-му месяцу аналогичное изменение составляло 13,8%. Применение розувастатина 40 мг/сут не приводило к достоверным изменениям ∆V02 в сравнении с результатом приема аторвастатина.
Таким образом, умеренное снижение ∆V02 наблюдалось только в группах, получавших розувастатин в малых и средних дозах (табл.).
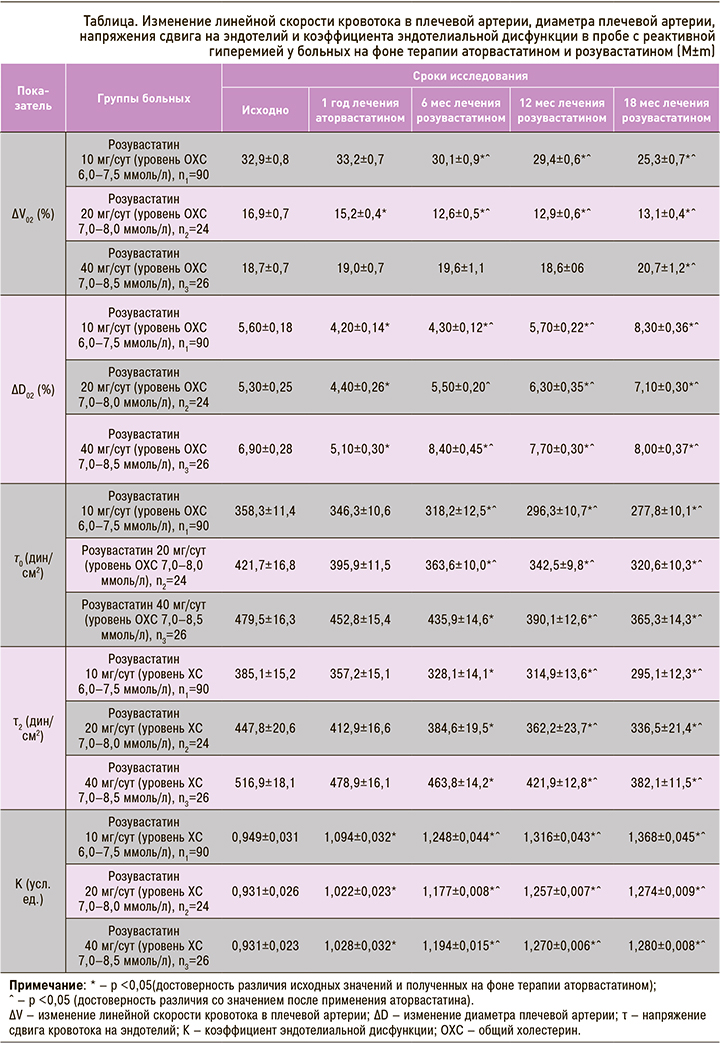
Средние значения ∆D02 после года терапии аторвастатином уменьшились на 25% от исходных в 1-й группе пациентов, впоследствии получавших розувастатин 10 мг/сут. Во 2-й группе пациентов (впоследствии получавших розувастатин 20 мг/сут) ∆D02 снизилось на 17%, в группе больных, впоследствии применявших розувастатин 40 мг/сут, – на 27%. Замена аторвастатина на розувастатин 10 мг/ сут через 6 мес сопровождалась снижением величины ∆D02 на 23,2%; при приеме розувастатина в дозе 20 мг/ сут этот показатель через тот же период времени сохранялся на уровне, близком к исходному значению, а при использовании дозы 40 мг/сут увеличился на 21,7%. При терапии розувастатином в течение 12 мес в дозе 10 мг/ сут величина ∆D02 сохранялась на близком к исходному значению уровне, в дозе 20 мг/ сут увеличилась на 18,9%, в дозе 40 мг/сут – на 11,6%. В случае 18-месячного курса приема розувастатина увеличение ∆D02 для дозировок 10, 20 и 40 мг/сут составило 48,2, 33,9 и 15,9% соответственно
Таким образом, увеличение ∆D02 наблюдалось в группах, получавших розувастатин во всех дозовых режимах (см. табл., рис.).
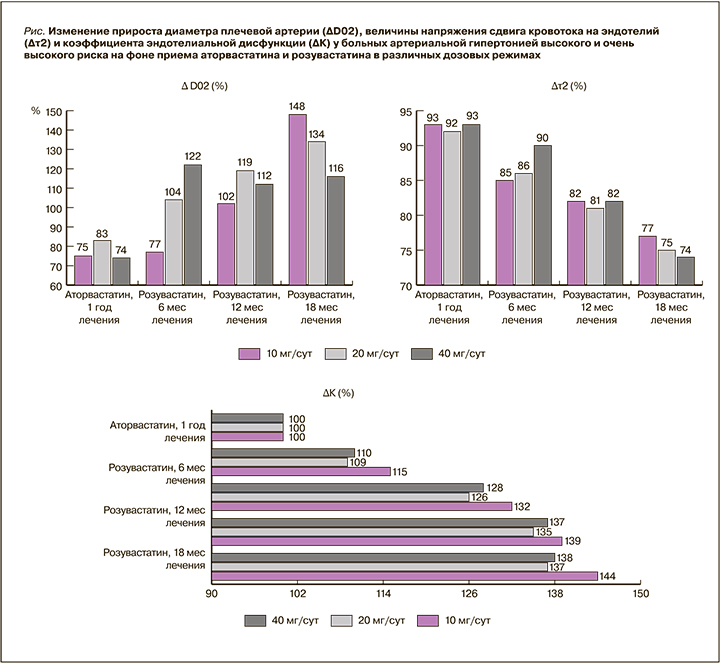
Анализ динамики величин τ0 и τ2 показал, что на фоне терапии аторвастатином в любом из дозовых режимов отсутствуют изменения со стороны указанных параметров. При приеме розувастатина в различных дозовых режимах (10, 20, 40 мг/сут) отмечалось снижение напряжения сдвига в покое (τ0) к 6-му месяцу терапии на 11,2; 13,8 и 9,1% соответственно, к 12-му месяцу – на 17,3; 18,8 и 18,6% соответственно, к 18-му месяцу – на 22,5; 23,9 и 23,8% (p <0,05) соответственно.
В 1-й группе пациентов, которые после года лечения аторвастатином принимали розувастин 10 мг/сут, к 6-му месяцу терапии отмечалось снижение τ2 на 14,8%, к 12-му месяцу – на 18,2%, к 18-му месяцу – на 23,4%. Среди участников исследования, получавших розувастин 20 мг/сут (2-я группа), снижение данного показателя на тех временных отрезках составило 14,1; 19,1 и 24,9% соответственно, среди пациентов, применявших препарат в дозировке 40 мг/сут (3-я группа), –10,3; 18,4 и 26,1% соответственно.
Таким образом снижение степени напряжения сдвига кровотока на эндотелий в пробе с реактивной гиперемией не зависело от дозового режима (см. табл., рис.).
Коэффициент эндотелиальной дисфункции (К) во всех трех группах пациентов (переведенных с аторвастатина на розувастатин в дозах 10, 20 и 40 мг/сут) через год терапии увеличился на 15,3; 9,8 и 10,4% соответственно (различия между группами достоверны, p <0,05). Различия между 2-й и 3-й группами пациентов в степени снижения К отсутствовали (p >0,05). Замена аторвастатина на розувастатин 10 мг/ сут через 6 мес сопровождалась возрастанием величины К на 31,5%, через 12 мес – на 38,7%, через 18 мес – на 44,2%. Для группы, получавшей розувастатин 20 мг/ сут, аналогичные показатели увеличения К составили 26,4; 35,0 и 36,8% соответственно, для группы розувастатина 40 мг/сут – 28,3; 36,4 и 37,5% соответственно. Таким образом, различия между группами в степени снижения К отсутствовали (см. табл., рис.).
Некоторое снижение величины ∆D02 на фоне приема аторвастатина в течение 12 мес при отсутствии динамики ∆V02 может свидетельствовать о недостаточном влиянии этого статина на реактивность сосудистой стенки и продолжающемся прогрессировании эндотелиальной дисфункции. Описанное в нашем исследовании увеличение ∆D02 и некоторое снижение величины ∆V02 на фоне терапии розувастатином, вероятно, обусловлены более выраженным усилением функциональной активности сосудистого эндотелия, что подтверждается существенным приростом величины К под влиянием этого препарата.
Таким образом, результаты измерения К, характеризующего эндотелийзависимую вазодилатацию, свидетельствовали о восстановлении функциональной активности эндотелия сосудов у больных АГ с высоким и очень высоким сердечно-сосудистым риском при длительном применении как аторвастатина, так и розувастатина. Однако розувастатин во всех исследуемых дозовых режимах оказывает более выраженное влияние на параметры эндотелиальной дисфункции. Полученные данные говорят о более выраженной вазопротективной активности розувастатина в сравнении с аторвастатином, что проявляется в деремоделировании сосудистого русла, а также способности уменьшать при длительном применении содержание С-реактивного белка [1]. Учитывая приведенные выше данные, розувастатин может служить препаратом выбора в профилактике и коррекции дисфункции сосудистого эндотелия у больных АГ высокого и очень высокого кардиоваскулярного риска [22, 23].
ЗАКЛЮЧЕНИЕ
1. Розувастатин при длительном приеме у больных АГ с высоким и очень высоким сердечно-сосудистым риском в составе комплексной терапии уменьшает эндотелиальную дисфункцию сосудистой стенки.
2. По влиянию на параметры функциональной активности сосудистой стенки розувастатин в различных дозовых режимах (10, 20, 40 мг/сут) превосходит аторвастатин в дозовом режиме 20 мг/сут.



