Во всем мире ежегодно регистрируются неутешительные темпы роста количества больных хронической обструктивной болезнью легких (ХОБЛ), причем пациенты с этим заболеванием занимают лидирующие позиции по наличию отягощенного коморбидного фона [1]. Наиболее часто встречаемой коморбидной патологией являются заболевания сердечно-сосудистой системы [2–5]. Стоит отметить, что в настоящее время основа коморбидной кардиореспираторной патологии рассматривается не просто с точки зрения общих факторов риска, а в контексте сердечно-легочного континуума, основой которого служит хроническое системное воспаление при ХОБЛ [6–8].
Наиболее частой причиной летального исхода у больных ХОБЛ становится острый инфаркт миокарда (ИМ), а развитие осложнений значительно повышает соответствующий риск [9]. На фоне осложненного ИМ больные ХОБЛ также имеют высокий риск развития сердечной недостаточности и аритмий, что, безусловно, способствует прогрессированию самой ХОБЛ [10]. В связи с этим изучение взаимоотягощающих механизмов/факторов и предикторов, лежащих в основе острого ИМ у больных ХОБЛ, по праву считается актуальным направлением современных исследований.
Одним из перспективных предикторов осложненного течения ИМ является белок Клото. Изменение его уровня отражает выраженность воспаления, оксидативного стресса, состояния сосудистого эндотелия, апоптоза [11], а, как известно, именно эти процессы служат основой как ХОБЛ, так и ИМ. Взаимосвязь между изменениями уровня белка Клото и рядом клинико-анамнестических характеристик больных ХОБЛ и ИМ подтверждена результатом широкого спектра исследований [12, 13]. Однако в доступной литературе не представлено исследований по изучению уровня белка Клото у пациентов с коморбидной патологией в форме ИМ на фоне ХОБЛ.
При оценке индивидуального прогноза течения заболеваний многообещающим представляется создание прогностических алгоритмов, учитывающих значимые анамнестические, клинические и лабораторно-инструментальные предикторы [14–16].
Цель исследования – прогнозирование развития осложненного течения ИМ (вероятности развития его осложнений – отека легких и кардиогенного шока) у больных с сопутствующей ХОБЛ.
МАТЕРИАЛЫ И МЕТОДЫ
 Обследовано 60 больных мужского пола, госпитализированных с диагнозом «острый ИМ» на фоне ХОБЛ. Все пациенты были госпитализированы в региональный сосудистый центр Александро-Мариинской областной клинической больницы (Астрахань).
Обследовано 60 больных мужского пола, госпитализированных с диагнозом «острый ИМ» на фоне ХОБЛ. Все пациенты были госпитализированы в региональный сосудистый центр Александро-Мариинской областной клинической больницы (Астрахань).
В качестве возможных предикторов осложненного течения ИМ рассматривались возраст, длительность симптомов ишемической болезни сердца (ИБС), наличие стенокардии, артериальной гипертензии (АГ) в анамнезе, сроки госпитализации, выраженность бронхообструкции, длительность ХОБЛ, индекс курения (пачка/лет), количество пораженных коронарных сосудов, уровень белка Клото в плазме крови (табл. 1).
Также в качестве возможных предикторов осложненного течения ИМ рассматривалась подгруппа пациентов с ХОБЛ. В зависимости от степени тяжести симптомов (САТ – тест COPD Assessment Test), выраженности одышки по шкале mMRC (Modified Medical Research Council Dyspnea Scale) и риска обострений ХОБЛ обследуемые в соответствии с классификацией GOLD от 2019 г. были распределены на 4 подгруппы:
- подгруппа А – больные с невыраженными симптомами и редкими обострениями (n=5; 8%);
- подгруппа В – с выраженными симптомами и редкими обострениями (n=6; 10%);
- подгруппа С – с невыраженными симптомами и частыми обострениями (n=22; 37%);
- подгруппа D – с выраженными симптомами и частыми обострениями (n=27; 45%).
Наряду с этим определялся фенотип ХОБЛ: у 18 пациентов (30%) наблюдался эмфизематозный фенотип заболевания, у 23 (38%) – бронхитический, у 19 (32%) – смешанный. Количество больных с эмфизематозным фенотипом было сопоставимо с числом пациентов, имеющих бронхитический (χ2=0,45; df=1; p=0,500) и смешанный фенотипы (χ2=0,02; df=1; p=0,886), а количество больных с бронхитическим фенотипом сравнимо с числом больных, имеющих смешанный фенотип (χ2=0,28; df=1; p=0,595).
Проведение клинического исследования было одобрено Региональным независимым этическим комитетом (протокол № 9 от 15.11.2018). От всех обследуемых лиц было получено письменное информированное согласие на участие в исследовании.
Определение содержания уровня белка Клото (нг/мл) в образцах плазмы осуществлялось методом иммуноферментного анализа с помощью коммерческой тест-системы Klotho (KL) (UscnLifeScienceInc. Wuhan. Каталожный номер № E97757Hu).
Для статистической обработки данных использовалась программа SPSS-16 (Statistical Package for the Social Sciences). Для каждого предиктора множественной логистической регрессионной модели были рассчитаны следующие показатели: β-коэффициент, стандартная ошибка, статистика критерия Вальда, p – значения вероятности (статистической значимости связи предикторов с переменной отклика), отношение шансов и 95% доверительный интервал (ДИ). Оценка алгоритма производилась с использованием Omnibus Test.
Для математической модели производился расчет диагностической чувствительности, диагностической специфичности, диагностической точности, прогностической ценности положительного (+) и отрицательного (-) результатов. С целью оценки качества математической модели применялось построение ROC-кривой (Receiver Operator Characteristic). Также определялся показатель AUC (areaunder ROC curve – площадь под ROC-кривой) и значение 95% ДИ соответствующей площади под кривой. Для оценки качества созданной модели использовали меру определенности Naglekerkes (псевдокоэффициент детерминации), которая характеризует часть дисперсии, объясняемую с помощью построенной модели логистической регрессии. Также были установлены так называемые точки разделения (cut off) – диагностически значимые уровни белка Клото при прогнозировании жизнеугрожающих осложнений у больных ИМ на фоне ХОБЛ.
РЕЗУЛЬТАТЫ
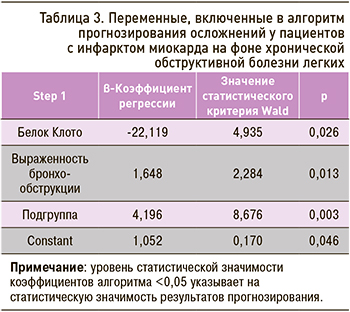
При помощи пошаговой логит-регрессии нами производился отбор факторов-предикторов (см. табл. 1) для создания прогностического алгоритма с наибольшей точностью предсказания. Такими факторами-предикторами среди анализируемых стали уровень белка Клото, выраженность бронхообструкции и подгруппа ХОБЛ (A–D).
В качестве исхода в алгоритме рассматривались два варианта развития событий в остром периоде ИМ: 1 – осложнения развивались; 0 – осложнений не было.
Порог отсечения был принят равным 0,5. Если в результате расчетов полученное значение вероятности было меньше этого уровня, то предполагалось, что событие не наступит; если же оно было равно или превышало 0,5, то предполагалось, что событие произойдет.
Полученный алгоритм имел следующий вид:
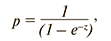
где р – вероятность наступления исхода (развития осложнений – отек легких и кардиогенный шок) в долях единицы; e – число Эйлера, равное 2,71828; z – показатель степени в логистической функции.
Показатель z определялся по формуле:
z = 1,052 – 22,119 × белок Клото + 1,648 × выраженность бронхообструкции + 4,196 × подгруппа ХОБЛ,
где 1,052– константа; -22,119 – коэффициент первой переменной; белок Клото – уровень белка Клото, нг/мл; 1,648 – коэффициент второй переменной; выраженность бронхообструкции: 0–II степень, I–III степень; 4,196 – коэффициент третьей переменной; подгруппа – подгруппа ХОБЛ (A–D), установленная на основе анамнестических данных о выраженности клинических симптомов и частоте обострений заболевания. Поскольку при проведении статанализа было установлено, что лишь подгруппа D оказывала значимое влияние на развитие осложнений, данная характеристика (подгруппы) была дихотомизирована. Подгруппа D кодировалась как 1, иные подгруппы (A, B, С) как 0.
 Оценка алгоритма производилась с использованием Omnibus Test (χ2=36,930, df=3; р <0,001), результаты которого указывают на статистическую значимость алгоритма.
Оценка алгоритма производилась с использованием Omnibus Test (χ2=36,930, df=3; р <0,001), результаты которого указывают на статистическую значимость алгоритма.
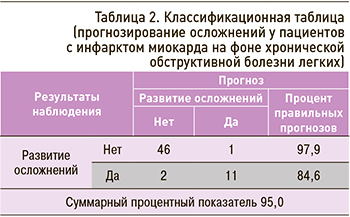
В классификационной таблице 2 приведены наблюдения за больными острым ИМ на фоне ХОБЛ (0 – осложнения не развивались, 1 – развивались) и результаты, спрогнозированные при помощи разработанного алгоритма.
Как свидетельствуют данные таблицы 2, из 60 (100%) пациентов, отобранных для наблюдения, «строго положительные» результаты (спрогнозированы жизнеугрожающие осложнения – развились жизнеугрожающие осложнения) получены в отношении 11 пациентов (18,3%), «ложноотрицательные» (спрогнозировано отсутствие жизнеугрожающих осложнений, притом что реально имело место их развитие) – в отношении 2 (3,3%). «Строго отрицательные» результаты (точный прогноз отсутствия осложнений) получены у 46 больных (76,7%), «ложноположительные» (спрогнозировано развитие жизнеугрожающих осложнений, реально – отсутствие таковых) – у 1 (1,7%). Таким образом, правильно было распознано 57 случаев, что составило 95,0%.
 Диагностическая чувствительность прогностического алгоритма составила 97,9%, диагностическая специфичность – 84,6%, диагностическая эффективность – 95,0%. Прогностическая ценность положительного результата была равна 91,7%, прогностическая ценность отрицательного результата – 95,8%.
Диагностическая чувствительность прогностического алгоритма составила 97,9%, диагностическая специфичность – 84,6%, диагностическая эффективность – 95,0%. Прогностическая ценность положительного результата была равна 91,7%, прогностическая ценность отрицательного результата – 95,8%.
Проверка значимости коэффициентов проводилась при помощи статистики Вальда (табл. 3).
При пошаговом введении предикторов в алгоритм уровень точности прогноза с одним предиктором (белок Клото) достигал 80%, с двумя (белок Клото, подгруппа ХОБЛ) – 91,7%, с тремя (белок Клото, подгруппа ХОБЛ, выраженность бронхообструкции) – 95,0%.
R квадрат Naglekerkes (псевдокоэффициент детерминации), который, как уже говорилось, характеризует часть дисперсии, объясняемой с помощью построенной модели логистической регрессии, составил 70,9%.
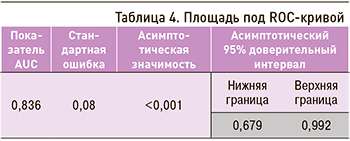
 Площадь под ROC-кривой, соответствующей взаимосвязи прогноза осложнений острого периода ИМ на фоне ХОБЛ и значения регрессионной функции, составила 0,836±0,08 с 95% ДИ 0,679–0,992; это указывает на очень хорошее качество разработанного алгоритма (рис., табл. 4).
Площадь под ROC-кривой, соответствующей взаимосвязи прогноза осложнений острого периода ИМ на фоне ХОБЛ и значения регрессионной функции, составила 0,836±0,08 с 95% ДИ 0,679–0,992; это указывает на очень хорошее качество разработанного алгоритма (рис., табл. 4).
С целью установления пороговых значений для прогноза развития осложнений (кардиогенного шока, отека легких) у пациентов с острым ИМ на фоне ХОБЛ с помощью ROC-анализа была определена «точка разделения» (cut off) для белка Клото. Значимый пороговый уровень этого белка был равен 0,185 нг/мл, при этом площадь под ROC-кривой составила 0,69±0,052 с 95% ДИ 0,561– 0,712 (р <0,001). При уровне белка Клото ниже указанного значения прогнозируются осложнения острого периода ИМ. Чувствительность и специфичность ROC-анализа при определении «точки разделения» (cut off) для белка Клото составили 69,2 и 100,0% соответственно.
 ЗАКЛЮЧЕНИЕ
ЗАКЛЮЧЕНИЕ
Предложенный алгоритм прогнозирования развития осложнений ИМ (отека легких и кардиогенного шока) у больных с сопутствующей ХОБЛ обладает высокой чувствительностью и прогностической значимостью. Информация о предполагаемом высоком риске развития осложнений поможет целенаправленно подобрать объем профилактических и лечебных мероприятий пациентам с острым ИМ на фоне ХОБЛ для минимизации этого риска.
Также полученные данные свидетельствуют о перспективности изучения изменения уровня белка Клото у больных с коморбидной патологией в форме ИМ на фоне ХОБЛ и возможности дальнейшего его использования в качестве профилактической и терапевтической мишени.



