Динамичное повышение качества оказания медицинской помощи жителям России, страдающим сердечно-сосудистыми заболеваниями, а также кажущееся улучшение общих и специальных профилактических мероприятий пока не привели к заметному изменению показателей статистики: общее число кардиологических больных из года в год не снижается (в среднем 31,8 млн человек, по данным на 2016 г.), при этом количество пациентов с ишемической болезнью сердца (ИБС) ежегодно составляет около 7,4 млн [1].
В последнее время во многих зарубежных и российских публикациях все большее значение отводится коронарному атеросклерозу как ключевому патогенетическому звену при комплексном анализе механизмов развития ИБС [2–5].
Современные диагностические подходы не позволяют выявить значимость стеноза коронарных артерий по одним лишь клиническим данным. Болевая симптоматика как при незначимом, так и значимом коронарном атеросклерозе может быть одинаковой, при этом прогноз больных ИБС без значимой коронарной обструкции лучше, чем у пациентов с ее наличием [6].
Цель исследования – установить признаки, связанные с наличием значимого коронарного атеросклероза, у пациентов, направленных на коронароангиографию, при помощи факторного анализа.
МАТЕРИАЛ И МЕТОДЫ
В исследовании приняли участие 336 пациентов (178 женщин и 158 мужчин) в возрасте от 47 до 75 лет (средний возраст 61,8±8,1 лет) с диагнозом ИБС, который был верифицирован стандартизированными валидизированными критериями и клинико-функциональными методами. Пациенты, включенные в исследование, находились на лечении в кардиологическом отделении № 2 БУЗ ВО «Витебская городская клиническая больница скорой медицинской помощи № 1».
Наличие ИБС подтверждалось проведением диагностической коронароангиографии по методике Judkins с расчетом индекса Gensini [7].
Всем пациентам в стационаре выполнялся полный спектр обследования с проведением антропометрии и расчетом индекса массы тела (ИМТ), определением показателей липидного профиля – общего холестерина (ОХС), холестерина липопротеидов низкой плотности (ХС ЛПНП), холестерина липопротеидов высокой плотности (ХС ЛПВП), триглицеридов (ТГ).
В соответствии с индексом Gensini участники были разделены на 3 группы:
- GS0 (0 баллов по индексу Gensini) – 162 пациента без признаков коронарного атеросклероза;
- GS1 (1–15 баллов) – 80 пациентов с гемодинамически незначимым коронарным атеросклерозом;
- GS2 (>15 баллов) – 94 пациента с гемодинамически значимым коронарным атеросклерозом.
Оценку окислительной модификации белков (ОМБ) в сыворотке крови проводили по методике Дубининой [8]. Оптическую плотность 2,4-динитрофенилгидразонов регистрировали на спектрофотометре СФ-36: при длине волны 356 и 370 нм определялось содержание альдегидо- и кетонопроизводных динитрофенилгидразонов нейтрального характера (АДФГн и КДФГн), при длине волны 430 и 530 нм – альдегидо- и кетонопроизводных основного характера (АДФГо и КДФГо). Активность супероксиддисмутазы (СОД) оценивалась спектрофотометрическим методом. С целью определения уровня гомоцистеина использовали тест-систему для количественного определения общего L-гомоцистеина в человеческой сыворотке или плазме (фирма-производитель Axis-Shield, фирма-поставщик «БиоХимМак», Россия). Уровень высокочувствительного С-реактивного белка (вч-СРБ) устанавливался c помощью набора High sensitive Elisa Kit for C reactive protein (производитель Cloud-Clone Corp.). Уровень белков теплового шока 70 (БТШ 70) определяли с помощью набора ELISA (SEA873Hu – 96 определений; фирма-производитель Cloud-Clone Corp.).
Статистическая обработка результатов исследования выполнялась с помощью пакетов программ SPSS Statistics 20. Различия между группами определялись с помощью критерия Манна–Уитни (достоверные различия при p <0,05). Описание признаков с распределением, отличным от нормального, представлено в виде Me [Q25; Q75], где Ме – медиана, Q25 и Q75 – 25-й и 75-й квартили. Для оценки корреляционных связей между параметрами использовался критерий Спирмена. Коэффициент корреляции считался значимым при р <0,05.
Для поиска и идентификации параметров, сопоставимых с фактом наличия значимого коронарного атеросклероза у пациентов в исследовании, был проведен факторный анализ, включающий все исследуемые параметры. Для определения наиболее значимых параметров использовали критерий Кайзера и применяли метод вращения «варимакс» [9].
РЕЗУЛЬТАТЫ
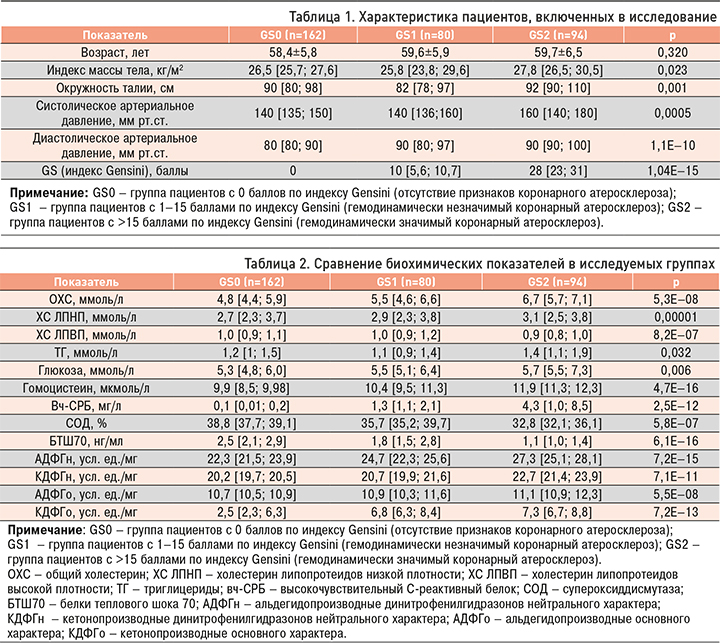
Клинико-функциональная характеристика пациентов, включенных в исследование, представлена в таблице 1.
При оценке биохимических показателей (табл. 2) установлены достоверные межгрупповые различия по критерию Краскела–Уоллеса в уровнях ОХС и ХС ЛПНП: наиболее высокие их значения были отмечены в группе GS2. Также в группе GS2 выявлены самые высокие уровни показателей окислительной модификации белков (гомоцистеина и вч-СРБ) и самые низкие значения БТШ70 и активности СОД, что свидетельствует о выраженности окислительного и клеточного стресса.
При проведении корреляционного анализа установлены достоверные взаимосвязи между уровнями гомоцистеина и вч-СРБ (r=0,608; р=2,5Е-18), АДФГн (r=0,872; р=2,4Е-53), КДФГн (r=0,670; р=3,4Е-23), КДФГо (r=0,698; р=7,2Е-26), АДФГо (r=0,545; р=2,2Е-14), СОД (r=-0,620; р=3,2Е-19), БТШ70 (r=-0,806; р=1,1Е-39).
По результатам факторного анализа нами было выделено 6 основных факторов развития значимого коронарного атеросклероза, которые объяснили 75,5% совокупной дисперсии. Результаты вращения по методу «варимакс» приведены в таблице 3, где признаки сгруппированы по величине нагрузок.
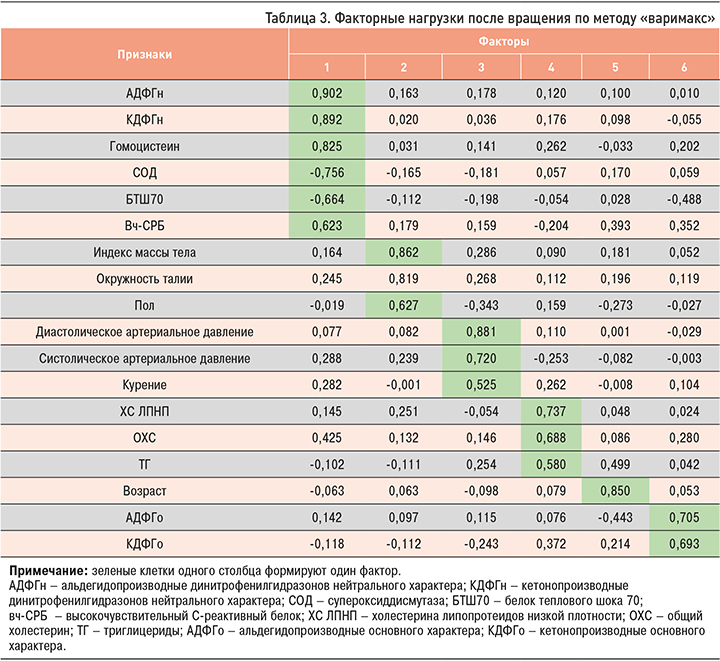
Первый фактор включил 6 переменных: АДФГн, КДФГн, гомоцистеин, СОД, БТШ70 и вч-СРБ. Этот фактор объяснял 31% вариабельности признака, что дает возможность интерпретировать его составляющие как биохимические факторы риска (факторы дисфункции эндотелия).
Второй фактор включил ИМТ, окружность талии и мужской пол (конституциональный фактор): он отвечал за 11,4% дисперсии.
Третий фактор, объясняющий 8,9% дисперсии, включил уровни артериального давления и курения (модифицируемые факторы риска).
Четвертый фактор включил показатели липидного профиля (липидный фактор), пятый – только возраст, шестой – АДФГо и КДФГо (прооксидантный фактор)
ОБСУЖДЕНИЕ
В качестве основного метода статистической обработки полученных результатов нами был использован факторный анализ с применением критерия Кайзера. Такой методический подход позволяет выявить взаимосвязи между множеством исследуемых факторов и выделить среди них наиболее значимые.
Среди множества оцененных критериев оказалось 6 факторов, чьи собственные значения компонент были больше 1. Важно подчеркнуть, что распределение дисперсии между анализируемыми критериями было достаточно неровным, что говорит о преобладании одного над другим и большей значимости факторов, описывающих больший процент дисперсии. Также в ходе анализа было установлено четкое распределение параметров по факторам: ни один параметр не дублировался в анализируемых критериях.
Наиболее значимым оказался первый фактор (фактор дисфункции эндотелия). Сильную корреляционную взаимную связь продемонстрировали показатели окислительной модификации белков, гомоцистеин, СОД, БТШ70 и вч-СРБ.
В нашем исследовании было показано, что чем ниже уровень БТШ70, тем выраженнее коронарный атеросклероз. В ряде исследований также выявлена обратная связь между экспрессией БТШ70 и выраженностью коронарного атеросклероза [10, 11]. Гиперэкспрессия БТШ70 в сыворотке крови может отражать системное воспаление и окислительный стресс, а увеличение БТШ70 может ослаблять опосредованные Т-клетками воспалительные реакции при коронарном атеросклерозе [12].
Окислительный стресс играет важную роль в патогенезе атеросклероза и усиливается общепризнанными сердечно-сосудистыми факторами риска [13]. Значимой проблемой формирования ОМБ является последующая инактивация ферментов. Альдегиды инактивируют белки теплового шока, участвующие в процессах фолдинга белков [14, 15]. ОМБ – один из процессов, усиливающих окислительный стресс и патологическое повреждение стенки артерии [16].
Повышенное содержание гомоцистеина провоцирует увеличение продукции окисленных боковых цепей ХС ЛПНП. Это приводит к увеличению образования свободных радикалов, что, в свою очередь, может вызвать повреждение эндотелия, инициирующее атеросклероз [17].
Гиперпродукция продуктов окислительной модификации белков обнаруживается уже при незначительном увеличении уровня гомоцистеина, при этом отмечается ингибирование активности антиоксидантных ферментов СОД и глутатионпероксидазы [18, 19].
Вч-СРБ опосредованно влияет на образование окисленных ХС ЛПНП, тем самым ухудшая функцию эндотелия и усиливая провоспалительные эффекты [20].
ЗАКЛЮЧЕНИЕ
Использование факторного анализа для статистической обработки полученных многомерных данных позволило выявить и изучить патогенетические взаимосвязи между переменными, определить наиболее значимые для диагностики коронарного атеросклероза критерии и рассчитать гипотетические значения выделенных совокупных факторов индивидуально для каждого больного. Значимый коронарный атеросклероз был ассоциирован с повышенным уровнем АДФГн, КДФГн, гомоцистеина, вч-СРБ и пониженными значениями СОД и БТШ70. В дальнейшем полученные результаты позволят создать алгоритм персонализированной диагностики степени выраженности коронарного атеросклероза.


