Патогенез коронавирусной инфекции (COVID-19), вызванной SARS-CoV-2, еще недостаточно изучен, однако значимая роль отводится нарушениям системной микроциркуляции, что связывают с повреждением эндотелия и развитием эндотелиита, а также возникновением распространенных васкулитов и тромбозов [1–3].
Одним из путей попадания SARS-CoV-2 в клетки организма могут служить рецепторы трансмембранного ангиотензинпревращающего фермента-2 (АСЕ-2), которые расположены в клетках эндотелия артерий, вен, эпителии респираторного тракта, альвеолярных моноцитах и макрофагах, различных тканях глазного яблока и др. [1, 4, 5, 7]. Внедрение вируса в клетки сопровождается повреждением эндотелия, эндотелиальной дисфункцией, а также периваскулярным воспалением, которое усиливает повреждение эндотелия [6].
Заболевание носит преимущественно респираторный характер, но может быстро вызвать поражение желудочно-кишечного тракта, почек, сердца, нервной системы и других органов с сопутствующей тромбоцитарно-эндотелиальной дисфункцией и развитием быстрого, опасного для жизни свертывания крови и воспаления [1, 5, 8].
Существующие данные о патогенезе COVID- 19 свидетельствуют, что исследование состояния микроциркуляции как в острой стадии, особенно в отделении интенсивной терапии [9], так и у переболевших этим заболеванием представляет научный и практический интерес [10, 13, 16]. В ряде исследований, проведенных разными неинвазивными методами in vivo, установлено нарушение показателей микроциркуляции у пациентов с COVID-19, однако полученные результаты носили неоднозначный характер.
Так, у пациентов с тяжелой пневмонией COVID-19, осложненной острым респираторным дистресс-синдромом (ОРДС), при проведении сублингвальной ручной видеомикроскопии было выявлено уменьшение доли перфузируемых сосудов и снижение скорости кровотока в сочетании с высокой плотностью капиллярной сети. Авторы делают вывод о том, что высокая плотность сосудов, вероятно, связана с усилением ангиогенеза или увеличением количества функционирующих капилляров, которое могло быть вызвано гипоксией [11].
В более ранней работе, выполненной тем же методом, другие исследователи показали обратную корреляцию плотности сублингвальных микрососудов с уровнем Д-димера у 12 пациентов с тяжелой пневмонией SARS-CоV-2. У пациентов с более высоким уровнем Д-димера наблюдалась значительно более низкая плотность перфузируемых сосудов. Эти данные, по мнению авторов, подтверждают связь между коагулопатией и нарушениями микрососудистой перфузии [12].
При измерении кожной микроциркуляции методом лазерной допплеровской флоуметрии с применением тепловой и дыхательной проб у 3 больных COVID-19 на стадии разрешения полисегментарной пневмонии выявлено снижение реактивности кожной микроциркуляции у пациента с более тяжелым течением коронавирусной инфекции [13].
С помощью контрастно-усиленной ультрасонографии было обнаружено нарушение кровоснабжения, в том числе снижение капиллярной перфузии, в печени, почках и других органах у 5 больных с тяжелыми формами течения COVID-19 [14].
Представляет интерес сравнительное исследование микроциркуляторного русла с помощью видеокапилляроскопии ногтевого ложа у 28 госпитализированных пациентов с пневмонией COVID-19 и 54 пациентов, перенесших пневмонию COVID-19 и обследованных в амбулаторных условиях (через 1,5–2 мес от появления первых симптомов) [15]. У пациентов обеих групп обнаружено значительное количество микрососудистых нарушений. Интересно, что распространенность аномалий, которые наблюдали исследователи, различалась в зависимости от стадии заболевания. В частности, распространенность отложений гемосидерина в результате микрокровоизлияния или микротромбоза, наличие перикапиллярного отека и сладж-феномена были значительно выше у пациентов с пневмонией COVID-19 по сравнению с пациентами, уже выписанными из больницы. И наоборот: у пациентов после острой стадии заболевания при амбулаторном обследовании была выявлена более высокая встречаемость изменений капиллярного русла в виде расширенных капилляров, извилистых капилляров и низкой плотности капиллярной сети с пустыми кожными сосочками.
Однако в связи с отсутствием четких критериев стандартизации авторы считают, что необходимы дальнейшие исследования с участием большего числа пациентов. Кроме того, большой интерес представляло бы также сравнение результатов капилляроскопии пациентов до и после COVID-19 и проведение оценки показателей микроциркуляции в группе риска, включенной в последующие клинические исследования.
На сегодня исследования микроциркуляции можно проводить неинвазивным способом in vivo с применением капилляроскопов не только в капиллярах ногтевого ложа, но и капиллярах бульбарной конъюнктивы и лимба. Изучение последних предпочтительно, так как капилляры ногтевого ложа хуже визуализируются и больше подвержены внешним влияниям. Кроме того, микрососуды конъюнктивы глазного яблока достаточно объективно отражают состояние капиллярного кровотока во всем организме [16].
В центре терапевтической офтальмологии (ЦТО) широко используется капилляроскопия бульбарной конъюнктивы и лимба глаза на офтальмологическом капилляроскопе «ОКО» (патент от 2013 г. № 132699) для оценки состояния микроциркуляции у пациентов с различными заболеваниями, в том числе заболеваниями терапевтического профиля.
Офтальмологический капилляроскоп оснащен специальной оптической системой и камерой, которая обеспечивает бесконтактную съемку капилляров, артериол и венул с возможностью определять как количественные, так и качественные показатели микроциркуляции. К количественным показателям мы относим диаметр артериол (ДА, мм) и венул (ДВ, мм), соотношение ДА и ДВ (артериоло-венулярный коэффициент, АВК), а также скорость кровотока в артериолах (СкА, микрон/с) и венулах (СкВ, микрон/с). Среди качественных показателей оцениваются наличие эритроцитарных агрегатов (сладжей) и их стаза, плотность капиллярной сети лимба, а также наличие шунтов между артериолами и венулами (АВШ), которые обеспечивают прохождение крови, минуя капилляры («синдром обкрадывания»). Нормальное состояние микрососудов принимается за 0, все наблюдаемые изменения оцениваются в баллах: степень отклонения, равная 1, характеризуется как слабо выраженная, 2 – как сильно выраженная (16).
К преимуществам исследования микроциркуляции с помощью капилляроскопа офтальмологического «ОКО» относятся быстрота проведения исследования (15 с), бесконтактность, получение не только фото (с 200-кратным увеличением), но и видеоизображения (скорость видеосъемки 100 кадров/с), компьютерная обработка данных с получением заключения сразу же после проведения исследования. Исследование проводится на обоих глазах.
При осмотре пациентов, перенесших COVID-19, которые обратились в ЦТО, были отмечены выраженные изменения показателей микроциркуляции бульбарного кровотока. В связи с этим на осмотр был вызван пациент, у которого имелись исходные данные бульбарной капилляроскопии до того, как он перенес новую коронавирусную инфекцию.
ОПИСАНИЕ КЛИНИЧЕСКОГО НАБЛЮДЕНИЯ
Пациент Д., 45 лет, наблюдается в ЦТО с диагнозом «OD: первичная оперированная открытоугольная, глаукома 2А. Начальная катаракта. Миопия средней степени. OS: Первичная оперированная открытоугольная глаукома 3В. Начальная катаракта. Миопия средней степени. Гипертоническая болезнь, степень 3, стадия 2, риск 4. Ожирение, степень 1. Аутоиммунный тиреоидит с исходом в гипотиреоз, в стадии медикаментозной компенсации».
На момент обращения в ЦТО (29.02.2021) предъявлял жалобы на умеренную общую слабость, снижение работоспособности (работает мастером по ремонту квартир).
Пациент заболел COVID-19 25.12.2020: отмечалось повышение температуры тела до 37,5 °C, на следующий день полностью исчезло обоняние, однако температура нормализовалась. Через неделю температура вновь повысилась (до 38,8 °C), появилось чувство «невозможности сделать глубокий вдох», артериальное давление (АД) увеличилось до 180/100 мм рт.ст. Повышение АД больной купировал приемом эналаприла 5 мг.
При компьютерной томографии (КТ) легких, выполненной амбулаторно 03.01.2021, были выявлены признаки двусторонней полисегментарной интерстициальной (вирусной) пневмонии (КТ- 1, легкой степени, вовлечение паренхимы легких менее 10%, правосторонний незначительный плеврит). Пациенту проводилось лечение азитромицином по 500 мг/сут в течение 7 дней, ривароксабаном по 10 мг/сут, парацетамолом до 3 таб./ сут при повышении температуры (максимальная температура в период заболевания 39,7 °C). Наряду с этим больной продолжал прием лизиноприла по 10 мг/ сут и амлодипина по 10 мг/сут по поводу гипертонической болезни.
10.01.2021 у пациента были выявлены антитела к коронавирусу SARS-CoV-2 (нуклеокапсидному белку), IgG, коэффициент позитивности (КП) – 7,6 (<1,4 – положительно: антитела обнаружены); антитела к коронавирусу SARS-CoV-2 (нуклеокапсидному белку), IgM, КП – 23,4 (<1,0 – положительно: антитела обнаружены).
Результаты общего анализа крови: гемоглобин – 130 г/л; эритроциты – 4,4×1012/л; лейкоциты – 5,55×109/л; формула без особенностей; тромбоциты – 200×109/л; СОЭ – 18 мм/ч.
Результаты биохимического анализа крови: общий белок – 75 (64–83) г/л; креатинин – 92 (63–116) мкмоль/л; мочевая кислота – 461 (210–420) мг/дл; глюкоза – 5,1 (3,8–5,8) ммоль/л; аланинаминотрансфераза (АЛТ) – 38 ед./л (до 44); аспартатаминотрансфераза (АСТ) – 33 (10–40) ед./л; холестерин – 4,61 (3,0–6,0) ммоль/л.
К середине января самочувствие больного улучшилось: вернулось обоняние, нормализовалась температура, АД удерживалось на уровне 130–140/90–100 мм рт.ст.
При контрольной КТ легких (19.01.2021) отмечалась положительная динамика – признаки двусторонней полисегментарной интерстициальной пневмонии в стадии разрешения.
Результаты коагулограммы от 22.01.2021 на фоне приема ривароксабана по 10 мг/сут: протромбиновое время – 13,4 с (10,0–13,2); протромбин 75% (80–120); международное нормализованное отношение (МНО) – 1,16; активированное частичное тромбопластиновое время (АЧТВ) – 51,7 с (25,4–36,9); фибриноген – 3,1 г/л (2,0–4,0); тромбиновое время 13,3 с (10,3–16,6); D-димер – 50 нг/ мл (<243).
Данные осмотра: рост 182 см, вес 100 кг, индекс массы тела (ИМТ) 30,2 кг/м2. Кожные покровы обычной окраски и влажности, чистые. В легких дыхание с жестким оттенком, хрипы не выслушиваются. Тоны сердца приглушены, частота сердечных сокращений (ЧСС) 76 уд./мин, АД 130/90 мм рт.ст. Живот мягкий, безболезненный. Печень и селезенка не пальпируются. Отеков нет. Стул в норме.
Из анамнеза: в течение последних 8 лет пациент страдает гипертонической болезнью с максимальными показателями АД 190/108 мм рт.ст. По поводу гипертонической болезни принимал лозартан по 50 мг/сут. В настоящее время принимает лизиноприл по 10 мг/сут, амлодипин по 10 мг/сут, ривароксабан по 10 мг/сут.
В течение последних 8 лет принимает L-тироксин по 75/100 мкг через день по поводу аутоиммунного тиреоидита с исходом в гипотиреоз. На фоне проводимой терапии наблюдался эутиреоз.
Данные электрокардиограммы: синусовый ритм с ЧСС 76/мин, нормальное положение электрической оси сердца (ЭОС). Признаки гипертрофии левого желудочка.
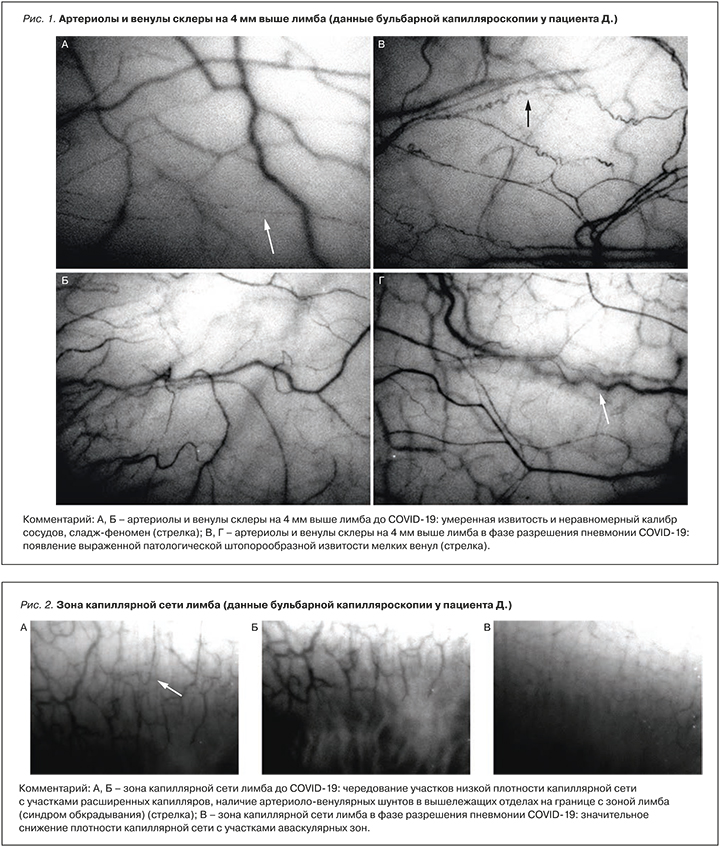
Пациенту была повторно проведена оценка кровотока в артериолах и венулах бульбарной конъюнктивы и лимба на обоих глазах на капилляроскопе офтальмологическом «ОКО». При оценке результатов, по сравнению с предыдущими данными от 29.09.2021, отмечалось ухудшение количественных показателей кровотока, а именно: за счет расширения венул уменьшился артериоло-венулярный коэффициент, который стал 0,26, снизилась скорость кровотока как по артериолам с обеих сторон (на 17%), так и по венулам (на 25%). Качественные характеристики также продемонстрировали отрицательную динамику: появилась патологическая штопорообразная извитость венул, увеличилась степень выраженности сладжирования эритроцитов и очагового стаза эритроцитов, значительно уменьшилась плотность капиллярной сети с появлением аваскулярных участков в зоне капиллярной сети зоны лимба, возросло количество артериоло-венулярных шунтов (табл., рис. 1, 2).
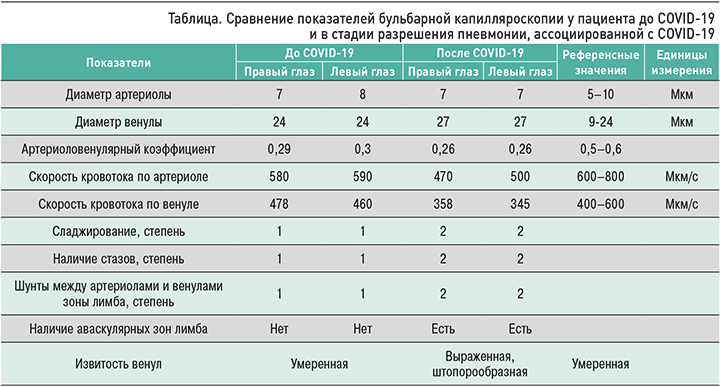
Необходимо отметить, что ранее полученные данные бульбарной капилляроскопии до заболевания COVID-19 (см. табл. 1, рис. 1, 2) интерпретировались исследователями как нарушение процессов микроциркуляции, которые являются следствием эндотелиальной дисфункции у пациента с факторами риска сердечно-сосудистых заболеваний (артериальная гипертензия, ожирение, гиперурикемия) и глаукомой.
Пациенту рекомендовано уменьшение дозы ривароксабана до 5 мг/сут в связи с удлинением времени АЧТВ, контроль коагулограммы через 2 нед, продолжение приема антигипертензивных препаратов. Также назначен курс озонотерапии с учетом опыта проведения в ЦТО такого лечения у пациентов, имевших нарушения в микроциркуляторном русле, и на основании данных литературы об эффективности озонотерапии при новой коронавирусной инфекции [17, 18].
ОБСУЖДЕНИЕ
Таким образом, у пациента в стадии разрешения пневмонии, ассоциированной с COVID-19, обнаружено значимое ухудшение параметров конъюктивальной микроциркуляции. Оно выражалось застойными явлениями в венулярном звене микроциркуляторного русла; увеличением внутрисосудистой агрегации эритроцитов по типу сладж-феномена и капиллярного стаза; значительным снижением плотности капиллярной сети с появлением аваскулярных участков на лимбе, отражающим ишемию этой зоны; появлением патологической штопорообразной извитости венул и увеличением количества артериоло-венулярных шунтов, свидетельствующих о нарастании синдрома обкрадывания.
Динамика изменений морфофункциональных показателей бульбарного кровотока однозначно подтверждает роль микроциркуляторных нарушений в патогенезе COVID-19 и в целом согласуется с данными других авторов, полученными методом капилляроскопии ногтевого ложа у пациентов, перенесших пневмонию COVID-19 [15]. Однако в нашем исследовании метод бульбарной капилляроскопии позволил более широко оценить динамику показателей всех составляющих микрососудистого русла, а не только состояние капиллярной сети.
ЗАКЛЮЧЕНИЕ
Полученные данные согласуются с представлениями о роли нарушений микроциркуляции, вызванных повреждением эндотелия, в патогенезе COVID- 19. Как показало наше наблюдение, использование бульбарной капилляроскопии – доступный и наглядный способ оценки состояния микроциркуляции, который может стать дополнительным методом для определения степени тяжести нарушений в микроциркуляторном русле у пациентов с COVID-19.
В дальнейшем, по нашему мнению, такой метод оценки микроциркуляции может быть применим в том числе для выявления групп риска тяжелых микрососудистых осложнений при заболевании новой коронавирусной инфекцией, а также для контроля эффективности терапии. Вместе с тем необходимы новые исследования применения этой методики среди пациентов с COVID-19.



