ВВЕДЕНИЕ
Пневмония – наиболее распространенное и выраженное проявление коронавирусной инфекции [1–3]. Развитие острой дыхательной недостаточности вследствие диффузного альвеолярного повреждения остается основной причиной госпитализации пациентов в стационар и формирования тяжелого течения COVID-19 (Coronavirus disease 2019). Максимальные усилия специалистов направлены на своевременную диагностику и эффективное лечение воспаления легких. Предложены и постоянно обновляются рекомендации по ведению пациентов с COVID-19. Тем не менее высокая частота тяжелого течения коронавирусной инфекции обусловливает необходимость поиска возможных факторов риска неблагоприятных клинических исходов у таких пациентов [4, 5].
В настоящее время для визуализации поражения органов грудной клетки у пациентов с COVID-19-пневмонией широко используют компьютерную томографию (КТ) [6]. Специфическими КТ-признаками этого заболевания считают периферические изменения в легких по типу матового стекла с ретикулярными уплотнениями или без них. Многократное повышение частоты применения КТ по всему миру, кроме увеличения чувствительности оценки состояния легких по сравнению со стандартной рентгенографией, сопровождалось ростом регистрации необычных осложнений у инфицированных пациентов [7–9]. Среди таких осложнений проникновение воздуха в плевральную полость (пневмоторакс), средостение (пневмомедиастинум) и/или мягкие ткани тела больного (подкожная эмфизема). Ведущими причинами таких ситуаций долгое время считают баротравму, обусловленную неправильным подбором параметров искусственной вентиляции легких (ИВЛ) или борьбой пациента с респиратором, а также ятрогенное повреждение плевры при установке центрального венозного катетера или интубации трахеи. Как показала практика, для тяжелого течения COVID-19 характерно спонтанное развитие пневмоторакса и/или пневмомедиастинума, в том числе у больных, которым не проводили респираторную поддержку, будь то инвазивная или неинвазивная ИВЛ. Предполагают, что воздух попадает в средостение или плевральное пространство через бронховаскулярные оболочки после разрыва альвеол (эффект Маклина) [10, 11]. Частота возникновения таких осложнений среди пациентов с коронавирусной инфекцией неизвестна, в литературе представлены лишь единичные клинический наблюдения. Сообщалось о повышении заболеваемости пневмомедиастинумом до 5–13%. В публикациях были представлены летальные исходы, которым способствовали спонтанные пневмоторакс, пневмомедиастинум или массивная подкожная эмфизема [7]. Основным методом лечения пневмоторакса является дренирование плевральной полости; подкожная эмфизема и пневмомедиастинум чаще разрешаются самостоятельно и не требуют оперативного вмешательства. Особый практический интерес представляет диагностика и определение факторов риска спонтанного пневмомедиастинума (СПМ), так как возникновение данного осложнения может значительно ухудшить течение заболевания, при этом никак не проявляясь клинически длительное время после его возникновения.
Цель нашего исследования – определение основных клинических и лабораторных характеристик, а также факторов риска тяжелого течения заболевания у пациентов с COVID-19-пневмонией, осложнившейся развитием СПМ, не связанного с инвазивной вентиляцией легких.
МАТЕРИАЛ И МЕТОДЫ
В период с октября 2020 г. по август 2021 г. в Клиническом центре COVID-19 Университетской клиники ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России было пролечено 12 522 пациента с коронавирусной инфекцией, подтвержденной тестом полимеразной цепной реакции (ПЦР). Всем пациентам выполняли КТ органов грудной клетки при поступлении в стационар, затем через 7–10 сут после начала лечения или сразу при ухудшении состояния больного.
У 130 обследованных пациентов был выявлен СПМ. КТ органов грудной клетки проводили на КТ-сканнере Somatom Definition AS 64 (Siemens) с реконструкцией среза по 1 мм, построением MPR в легочном и мягкотканном окне. Количественно распространенность СПМ оценивали по наличию и поперечному размеру включений плотностью воздуха в клетчатку средостения на уровне сердца и магистральных сосудов: более 10 мм – распространенный, большого объема, менее 10 мм – небольшого объема, только периваскулярно – локальный СПМ. Особо отмечали связь локализации эмфиземы мягких тканей и пневмомедиастинума со временем и стороной установки центрального венозного катетера (ЦВК). При наличии сопутствующего пневмоторакса его объем измеряли в кубических сантиметрах.
Демографические показатели пациентов включали возраст, пол, статус курения, сопутствующие заболевания и индекс массы тела (ИМТ). К клиническим переменным относились результаты обследования пациентов при поступлении в стационар: термометрия (t, 0С), сатурация по данным пульсоксиметрии (SpO2, %), среднее артериальное давление (мм рт.ст.), наличие специфических симптомов, включая озноб, кашель, одышку, а также сроки начала заболевания. Изучались результаты динамического обследования при лечении в стационаре, оценивался объем медицинской помощи, в том числе методов интенсивной терапии. Лабораторные показатели охватывали стандартный набор клинического, биохимического анализов крови, коагулограммы с акцентом на количество лейкоцитов (Лей) и абсолютное количество лимфоцитов в плазме крови, а также уровни лактатдегидрогеназы (ЛДГ), С-реактивного белка (СРБ), D-димера, ферритина, соотношение аспартатаминотрансферазы/аланинаминотрансферазы (АЛТ/АЛТ), прокальцитонина.
В исследование вошли 130 пациентов с диагностированным в стационаре СПМ, у которых отсутствовали эпизоды ИВЛ до развития пневмомедиастинума, визуализированного по данным КТ органов грудной клетки. Для сравнительного анализа факторов риска использовали результаты обследования 30 пациентов с COVID-19-пневмонией 3–4-й степени тяжести и объемом поражения легких более 55% без признаков пневмомедиастинума и пневмоторакса за все время госпитализации. Всем больным проводили стандартную терапию в соответствии с Временными методическими рекомендациями «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID- 19)» Минздрава России.
Статистическую обработку результатов выполняли с использованием программ Excel (Microsoft) и Statistica 10.0 (StatSoft). Данные представлены в формате М±s (M – средняя арифметическая, s – стандартное отклонение) при нормальном распределении. Применялись непараметрические методы статистического анализа. Оценку внутригрупповых различий проводили при помощи критерия Уилкоксона. Межгрупповые сравнения осуществляли при помощи критерия Манна–Уитни. Различия считали достоверными при уровне критерия значимости (р) <0,05. При необходимости указывались отношения шансов (ОШ) и доверительные интервалы (ДИ).
РЕЗУЛЬТАТЫ
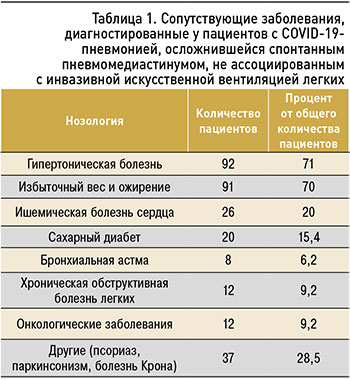
Обследованные пациенты были доставлены в стационар бригадой скорой медицинской помощи из дома на 7,0±4,2 сут от начала заболевания. Средний возраст 130 пациентов, у которых развился СПМ, не связанный с инвазивной ИВЛ, составил 61±15,3 года, соотношение мужчин и женщин было 73:57. Ни один из пациентов не сообщил о курении в анамнезе. ИМТ равнялся 28,0±5,8. Наиболее распространенными сопутствующими заболеваниями являлись гипертоническая болезнь, избыточный вес и ожирение, ишемическая болезнь сердца, сахарный диабет, хроническая обструктивная болезнь легких, онкологические заболевания, бронхиальная астма и др. (табл. 1).
На момент госпитализации в стационар температура тела больных составила 37,6±1,3°C, сатурация по данным пульсоксиметрии – 91,0±8,6%, среднее артериальное давление – 111,5±20,3 мм рт.ст.
Среди симптомов заболевания наиболее часто встречались одышка или чувство нехватки воздуха – у 28 больных (91%), кашель – у 107 пациентов (82%), лихорадка (температура тела >38,0 °C) – у 47 пациентов (36%), озноб – у 35 больных (27%; табл. 2).

Лабораторные показатели обследованных пациентов имели характерные изменения для COVID- 19 пневмонии: были повышены значения ЛДГ, СРБ, D-димера и ферритина в плазме крови (табл. 3). При первичном лабораторном контроле пациентов мы выявили умеренно повышенный уровень прокальцитонина на фоне нормального количества лейкоцитов в плазме крови, что может свидетельствовать о наличии бактериального воспаления. Однако обследованные больные на момент поступления в стационар не имели явных клинических признаков инфекционных осложнений.

По данным КТ органов грудной клетки у всех пациентов были визуализированы уплотнения паренхимы легких по типу матового стекла, участки консолидации, ретикулярные изменения, что свидетельствовало о COVID-19-пневмонии. СПМ был выявлен в стадии прогрессирования с увеличением объема поражения легких до КТ 3 (20%) и КТ 4 (80%; табл. 4). Сроки развития СПМ от начала заболевания составили 13,0±7,3 сут.

Среди пациентов, у которых развился СПМ при последующем рентгенологическом наблюдении, в 29 случаях (22%), помимо пневмомедиастинума, развились односторонний и двусторонний пневмоторакс различного объема: у 28 пациентов – плащевой пневмоторакс объемом менее 50 см3, у 1 – объемом 180 см3. У 118 больных (91%) на одной и той же компьютерной томограмме были обнаружены или развились одновременно подкожная эмфизема и СПМ, что позволяет предположить общий механизм возникновения таких осложнений.
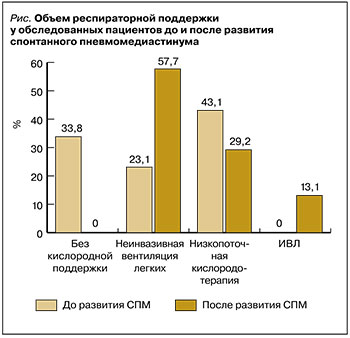
Дополнительную кислородную поддержку до выявления СПМ получали 86 пациентов (66,2%): 30 больным (23,1%) применяли неинвазивную вентиляцию легких (НИВЛ) в режиме высокого потока дыхательной смеси (High Flow Oxygen Therapy – HFOT) до 60–80 л/мин или с постоянным положительным давлением в конце выдоха (Сontinuous Positive Airway Pressure – CPAP) на уровне 8–12 см вод.ст. и фракцией кислорода в дыхательной смеси 50–80%; у 56 больных (43,1%) использовалась кислородотерапия с низким потоком до 15 л/ мин через назальные канюли или лицевую маску. Не требовали поддержки кислородом до развития СПМ 44 пациента (33,8%). За время наблюдения на НИВЛ были переведены 75 пациентов (57,7%), на инвазивную искусственную вентиляцию легких – 17 пациентов (13,1%). 38 больным (29,2%) не потребовалась дополнительная респираторная поддержка, кроме низкопоточной кислородотерапии (рис.).
У 42 пациентов (32,3%) был установлен ЦВК, однако хронологический связи между катетеризацией и возникновением пневмомедиастинума мы не выявили. Интубация трахеи и перевод на ИВЛ потребовались 17 пациентам через 4,5±3,4 дня после развития СПМ. Установку дренажной трубки в средостение не выполняли ни у одного пациента. Летальный исход был зафиксирован у 60 пациентов (46%) через 10,2±5,7 сут после диагностирования СПМ. Причинами смерти стали прогрессирование дыхательной недостаточности и развитие полиорганной недостаточности. Суммарный койко-день нахождения обследованных больных в стационаре составил 27,0±15,8 сут.
Логистическая регрессия показала, что предрасполагающие факторы (ОШ 3,94; 95% ДИ: 1,13–13,6; p=0,031) и радиологическая тяжесть (ОШ 6,63; 95% ДИ: 1,36–32,3; p=0,019) были независимо связаны с риском формирования пневмомедиастинума. Более высокий индекс сопутствующих заболеваний был связан со снижением риска пневмомедиастинума (ОШ 0,28, 95% ДИ: 0,092–0,86; p=0,027). При ограничении анализа пациентами, у которых развился СПМ без ИВЛ, наличие предрасполагающих факторов стало уникальным независимым предиктором его возникновения (ОШ 8,74; 95% ДИ: 2,15–35,44; p=0,002).
Пневмомедиастинум был независимо связан с более высоким риском госпитальной летальности (ОШ 11,70; 95% ДИ: 2,74–50,1; p=0,001). Другими признаками неблагоприятного исхода заболевания служили пожилой возраст (p=0,001), более высокая радиологическая степень тяжести поражения легких COVID-19 (p <0,001) и более высокий индекс коморбидности (p <0,001).
ОБСУЖДЕНИЕ
Синдром утечки воздуха, включающий пневмомедиастинум, пневмоперикард, пневмоторакс или подкожную эмфизему, нередко встречается у пациентов в тяжелом состоянии. Основными причинами его развития выступают травма грудной клетки, последствия кардиоторакальной хирургии, осложнения трансторакального доступа, перфорация пищевода, вентилятор-ассоциирование повреждение легких [12, 13]. Спонтанная утечка альвеолярного воздуха является редким осложнением, которое связывают с повышенным внутриальвеолярным давлением на фоне диффузного повреждения альвеол [14–16]. Сочетание таких факторов приводит к спонтанному перемещению воздуха из альвеолярного пространства в окружающие ткани (эффект Маклина) [16]. За счет градиента давлений воздух может перемещаться в средостение, плевральные и перикардиальные пространства [13]. В некоторых случаях воздух может выходить через входное отверстие в грудной клетке и вызывать подкожную эмфизему (ПЭ). Помимо диффузного альвеолярного повреждения, несколько факторов могут способствовать развитию синдрома утечки воздуха у пациентов с COVID-19. Сильный кашель с внезапным чрезмерным растяжением альвеол на фоне повышения внутриальвеолярного давления приводит к разрыву альвеол [9, 13, 17]. Кортикостероиды, которые активно используются для лечения пациентов с COVID-19 пневмонией, способствуют ослаблению интерстициальной ткани легких, что становится дополнительным фактором повреждения альвеол [13]. Появляются данные, свидетельствующие о том, что различные проявления синдрома утечки воздуха из альвеол служат предиктором крайне тяжелого течения COVID-19, требующего инвазивной ИВЛ и сопровождающегося увеличением числа летальных исходов.
В нашем исследовании мы обнаружили тенденцию к развитию СПМ среди госпитализированных пациентов с COVID-19, которым не применяли инвазивную ИВЛ. Пациенты с более высоким профилем коморбидности были менее склонны к развитию пневмомедиастинума. Возможным объяснением такому развитию ситуации является крайне тяжелое течение COVID-19 у этих пациентов, сопровождающееся декомпенсацией состояния и развитием полиорганной недостаточности в течение первых 7–14 сут от начала заболевания. Появление СПМ среди обследованных пациентов мы наблюдали преимущественно в стадии консолидации поражения легких, в среднем через 13 сут от начала COVID-19. У многих больных с коморбидностью летальный исход заболевания наступил ранее этого срока из-за осложненного течения коронавирусной инфекции.
Мы не выявили каких-либо специфических клинических и лабораторных признаков при госпитализации пациентов в стационар, свидетельствующих о высоком риске формирования СПМ. Большинство обследованных больных отмечало одышку и умеренное снижение сатурации по данным пульсоксиметрии, имели характерные для COVID-19 изменения маркеров воспаления с повышенными уровнями ЛДГ, СРБ, D-димера, ферритина и прокальцитонина [14, 18]. Профиль пациентов, у которых течение заболевания осложнилось СПМ, соответствовал пожилому мужчине с избыточным весом. У большинства пациентов диагностировали артериальную гипертензию. Данный факт согласуется с исследованиями, в которых эти характеристики были определены как факторы риска прогрессирования COVID-19 пневмонии [19–21]. Все пациенты в нашей когорте были некурящими. Для небольшой выборки это было неожиданно, учитывая отчеты, демонстрирующие связь между курением, диффузным поражением альвеол, СПМ и пневмотораксом [22, 23].
75 пациентов, у которых развился СПМ, получали НИВЛ. Многие исследователи отмечают более высокий риск баротравмы на фоне НИВЛ у пациентов с COVID-19 по сравнению с больными, у которых поражение легких не было вызвано коронавирусной инфекцией [24, 25]. Предполагают, что применяемое положительное давление в конце выдоха на фоне спонтанной дыхательной активности пациента увеличивает градиент давления между альвеолами и интерстициальным пространством, вызывая разрыв альвеол с распространением воздуха в средостение, плевру и подкожные ткани. В нашем исследовании мы не выявили прямой связи между НИВЛ и развитием СПМ. Возникновение синдрома утечки воздуха возможно связано с сочетанием диффузного повреждения альвеол, снижением податливости легочной ткани на отдаленных сроках заболевания и в меньшей степени дополнительной респираторной поддержкой с различной степенью агрессивности. Подтверждением нашей концепции служат клинические случаи 13 больных со СПМ, которые не получали какой-либо вспомогательной вентиляции легких. Спонтанное развитие синдрома утечки воздуха, не связанное с интубацией трахеи или ИВЛ с положительным давлением, ранее наблюдались при таких респираторных инфекциях, как пневмоцистная пневмония, поражение легких золотистым стафилококком, цитомегаловирусом, острый бронхиолит, тяжелый острый респираторный дистресс-синдром (SARS) [14, 26, 27]. Предрасполагающими факторами таких осложнений были бронхиальная астма в анамнезе, применение кортикостероидов, различных раздражителей дыхательных путей, наличие анатомических аномалий (трахеомаляций, бронхоэктазов или буллов в легких) [28–31].
Нарушение оксигенации в результате разрыва альвеол и интерстициальной эмфиземы легких (ИЭЛ) может играть значимую роль в гипоксии, характерной для COVID-19-пневмонии, из-за прогрессирования нарушений вентиляционно-перфузионных соотношений в легких. Идентификация ПЭ и пневмомедиастинума при рентгенографии может быть одним из немногих объективных признаков значительного разрыва альвеол и развития ИЭЛ. Наши результаты показывают, что рентгенологические проявления ПЭ и пневмомедиастинума почти всегда происходят одновременно, в большинстве случаев без сопутствующего пневмоторакса. Мы предполагаем, что СПМ имеется во всех ситуациях, когда у пациента зарегистрированы те или иные проявления синдрома утечки альвеол, но он может быть трудно визуализирован при рентгенографии. Потенциально трудными для диагностики являются небольшие верхушечные пневмотораксы, которые могли присутствовать у пациентов с COVID-19-пневмонией. Предполагают, что в результате воспаления легочной ткани формируются спайки между париетальным и висцеральным слоями плевры, которые могут защитить от развития пневмоторакса. Для подтверждения этого механизма приводят концепцию плевродеза, когда плевральная полость искусственно облитерируется, а затем спаивается для лечения рецидивирующего спонтанного пневмоторакса [32].
Недавние исследования продемонстрировали проникновение вируса COVID-19 через рецептор ангиотензинпревращающего фермента-2 (АПФ-2) в клетки-мишени, включая пневмоциты II типа, продуцирующие поверхностно-активные вещества, например сурфактант [33]. Нарушению регуляции продукции сурфактанта может дополнительно способствовать развитию ПЭ и пневмомедиастинума из-за нарушения эластичности легких. Повышенная регуляция экспрессии АПФ- 2, обнаруженная у пациентов при длительной артериальной гипертензии и диабете, потенциально может объяснить, почему они являются наиболее распространенными сопутствующими заболеваниями в нашей популяции пациентов с COVID-19-пневмонией [34].
ЗАКЛЮЧЕНИЕ
Развитие СПМ возможно у пациентов с COVID- 19-пневмонией, которым не применяли инвазивную ИВЛ, на фоне спонтанного дыхания с различной степенью респираторной поддержки. Наиболее распространенными сопутствующими заболеваниями у пациентов с COVID- 19-пневмонией, осложнившейся СПМ, являются гипертоническая болезнь, избыточный вес и ожирение, ишемическая болезнь сердца, сахарный диабет, хроническая обструктивная болезнь легких, онкологические заболевания, бронхиальная астма. У пациентов с COVID-19, которым не применяли инвазивную ИВЛ, СПМ возникает в стадии прогрессирования, с увеличением объема поражения легких по данным КТ до 3-й и 4-й степени. Сроки развития СПМ составляют 13,0±7,3 сут от начала заболевания. Формирование СПМ ассоциировано с увеличением тяжести течения COVID-19 пневмонии, повышением частоты применения инвазивной ИВЛ, более высоким риском летального исхода.


