ВВЕДЕНИЕ
В конце 2019 г. в китайском Ухане началась пандемия новой коронавирусной инфекции, не утихающая до сегодняшнего дня и кардинальным образом изменившая привычное течение жизни медицинского сообщества и человечества в целом. В феврале 2020 г. Всемирная организация здравоохранения (ВОЗ) определила официальное название инфекции, вызванной новым коронавирусом, – COVID-19. Тогда же Международный комитет по таксономии вирусов присвоил возбудителю инфекции имя SARS-CoV-2.
С самого начала пандемии стали появляться сообщения о неврологических осложнениях нового инфекционного заболевания. Неврологические расстройства присутствуют как сразу после заражения, так и спустя длительное время после регресса респираторного синдрома. Для врачей разных специальностей важно иметь представление о наиболее частых неврологических проявлениях SARS-CoV-2 и понимать механизмы их развития.
Уже в начале 2020 г. Mao L. et al. описывали неврологические симптомы в серии наблюдений 214 пациентов из г. Ухань. Такие симптомы отмечались у 78 (36,4%) пациентов, причем у 5 (5,7%) человек их непосредственной причиной был ишемический инсульт [1]. Последующие работы свидетельствовали об еще более высокой частоте встречаемости неврологических расстройств. Так, по данным Lu Y. et al., Miners S. et al., разнообразные формы поражения нервной системы выявляются у половины или даже у двух из трех инфицированных SARS-CoV-2 [2, 3]. Среди них чаще всего встречаются снижение обоняния и вкуса (35,6%), упорные и не соответствующие тяжести общей интоксикации головная боль (10,7%) и миалгии (18,5%), инсульты (8,1%), головокружение (7,9%), нарушения сознания (7,8%) и эпилептические припадки (1,5%). К более редким неврологическим последствиям COVID-19 относятся менингоэнцефалиты, периферические невропатии, синдром Гиенна–Барре, синдром Миллера Фишера, внутримозговые кровоизлияния и мышечная дистония [4–6].
Ряд симптомов COVID-19 может сохраняться в течение нескольких недель или даже месяцев после регресса респираторных расстройств, а у некоторых пациентов вовсе не отмечается регресс симптоматики [7]. При этом затяжное течение описано в том числе у пациентов с легкой формой заболевания. В связи с этим в научный лексикон был введен термин «постковидный синдром» (англ. post-acute COVID-19 syndrome, post-COVID-19 syndrome), под которым в настоящее время понимается совокупность объективных и субъективных симптомов, сохраняющихся более 12 нед после заражения вирусом SARS-CoV-2. Постковидный синдром (ПКС) может протекать волнообразно или оставаться стабильным на протяжении длительного времени. Важное условие его диагностики – отсутствие иных заболеваний, которые могли бы объяснить имеющуюся симптоматику. В новой редакции Международной классификации болезней 10-го пересмотра ПКС кодируется шифром U09.9 [7, 8].
По данным многочисленных клинических наблюдений, ведущее место в структуре ПКС занимают неврологическая симптоматика, кожные проявления, связанные с васкулитом, психические расстройства и нарушения функции отдельных органов и систем [8]. На настоящий момент нет точных сведений об эпидемиологии и патогенезе этого синдрома. В качестве одной из гипотез развития ПКС рассматривается длительная персистенция вируса и стойкая виремия при слабом иммунном ответе [7]. Предполагается также, что ведущим патогенетическим механизмом ПКС выступает развитие хронического воспаления, прежде всего системного васкулита, и вирус-индуцированных аутоиммунных реакций [7, 8].
Davido B. et al. [9] описали возвратный ПКС, когда после короткого периода клинического выздоровления у больных появлялись такие симптомы, как миалгия, выраженная утомляемость, ощущение жара, одышка, чувство стеснения в груди, тахикардия, головные боли, беспокойство. Подобное течение ПКС чаще встречалось у молодых женщин (соотношение полов 4:1) около 40 лет.
Специалистами Московского городского научного общества терапевтов (МГНОТ) в марте 2021 г. был проведен опрос по оценке длительности ПКС в закрытой группе «Нетипичный коронавирус» социальной сети Facebook с использованием автоматизированного опросника (n=231). Длительность ПКС у опрашиваемых составила: 1–2 мес – 28 человек (12%), 3–4 мес – 79 человек (34%), 5–6 мес – 91 человек (39,4%), 9–10 мес – 21 человек (9%), 11–12 мес – 12 человек (5,1%) [8].
По информации Национального офиса статистики Великобритании (Office for National Statistics, ONS), примерно у 1,1 млн пациентов ПКС сохранялся в течение 4 и более недель после «выздоровления» от COVID-19, причем имеющиеся симптомы не могли быть объяснены другими причинами (по результатам опроса, проведенного с 3 февраля по 6 марта 2021 г.) [10]. Результаты опроса показали, что ПКС отрицательно сказывался на повседневной активности 674 000 человек (из опрошенных 1,1 млн), при этом 196 000 из этих респондентов сообщили, что их повседневная активность сильно ограничена [10].
СЕМИОТИКА НЕВРОЛОГИЧЕСКИХ НАРУШЕНИЙ ПОСЛЕ COVID-19
По данным Национальной службы здравоохранения Великобритании (The National Health Service, NHS), клинические проявления ПКС включают повышенную усталость и утомляемость, одышку, тахикардию, боли или ощущение стеснения в груди, снижение памяти и трудности концентрации внимания («мозговой туман»), нарушения сна, головокружение, депрессию и тревогу, выраженное беспокойство и эмоциональную лабильность, шум в ушах, головные боли, миалгии, изменения обоняния и/или вкуса, ощущения покалывания (парестезии), диарею, снижение аппетита, боли в животе, артралгии и кожные высыпания [11].
Taquet M. et al. [12] проанализировали международную медицинскую базу данных TriNetX, в которой содержится медицинская информация по общей популяции более 81 млн человек. В базе данных были зарегистрированы 236 379 пациентов в возрасте 10 лет и старше, переболевших COVID-19. Авторы приводят частоту встречаемости различных неврологических диагнозов, которые впервые в жизни выставлялись этим пациентам в течение 6 мес после заражения COVID-19. Самыми распространенными неврологическими диагнозами оказались периферические невропатии (2,85%), острые нарушения мозгового кровообращения (2,66%), деменция (0,67%), миастения (0,45%), паркинсонизм (0,11%) и энцефалит (0,1%) [12].
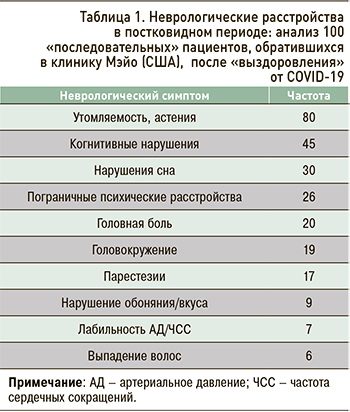
Vanichkachom G. et al. (США) представили данные 100 «последовательных» пациентов, обратившихся к врачу по любой причине в первые нескольких месяцев после COVID-19. Условием включения в исследование было отсутствие до COVID-19 каких-либо хронических заболеваний. Возраст большинства исследуемых был моложе 65 лет, средний возраст составил 45,0±4,2 года. Пациенты обращались в клинику в различные сроки после перенесенного инфекционного заболеваний, в среднем через 93,4±65,2 дня после заражения. Согласно результатам цитируемой работы, самыми частыми неврологическими симптомами, послужившими причиной обращения к врачу в постковидном периоде, являются астения, когнитивные нарушения, расстройства сна и легкая психопатологическая симптоматика, головная боль, головокружение и парестезии (табл. 1). При этом большинство пациентов имело одновременно несколько неврологических симптомов. Важно отметить, что постковидные неврологические нарушения у обследованных больных вызывали существенные затруднения в повседневной жизни. Только треть из проанализированных пациентов смогла вернуться к труду в том же объеме, что и до болезни [13].
В настоящее время Всемирная федерация неврологии (World Federation of Neurology, WFN) работает над Международным регистром неврологических проявлений COVID-19 [7]. Другая инициатива, в которой участвуют 30 стран совместно с Alzheimer’s Association и под руководством ВОЗ, заключается в создании международного мультидисциплинарного консорциума для сбора и оценки краткосрочных и долгосрочных последствий SARS-CoV-2 в отношении центральной нервной системы (ЦНС). В данную программу планируется включить 22 млн клинических случаев, анализ которых позволит лучше представлять отсроченное влияние COVID-19 на церебральные функции, включая когнитивную сферу, оценить связь новой коронавирусной инфекцией с болезнью Альцгеймера и другими нейродегенеративными заболеваниями [14].
ЛЕЧЕНИЕ НЕВРОЛОГИЧЕСКОГО ПОСТКОВИДНОГО СИНДРОМА
Большое значение у пациентов с COVID-19 имеет профилактика острых нарушений мозгового кровообращения, а также постковидных когнитивных и астенических нарушений.
Профилактика цереброваскулярных событий
Один из основных механизмов поражения центральной и периферической нервной системы при COVID-19 – коронавирусный эндотелиит с развитием множественных артериальных и венозных тромбозов [7, 8]. Учитывая относительно недолгую историю новой коронавирусной инфекции, не удивительно, что общепринятой и основанной на доказательствах регламентации подхода к профилактике церебральных тромботических осложнений на фоне COVID-19 пока не разработано. При осложненном течении коронавирусной инфекции и/или у пациентов с сопутствующими сердечно-сосудистыми заболеваниями эмпирически нередко назначаются пероральные антикоагулянты. Однако многие пациенты, заболевающие новой коронавирусной инфекцией, уже получают антиагрегантную терапию, назначенную до коронавирусной инфекции. Закономерно возникает вопрос о влиянии такой терапии на риск тромботических осложнений и течение COVID-19.
Этот вопрос анализировался в достаточно большом числе исследований, опубликованных к настоящему моменту. Многочисленные клинические исследования, в которых приняло участие в общей сложности более 30 000 пациентов, как правило, свидетельствуют о благоприятном влиянии антиагрегантной терапии на течение коронавирусной инфекции [15–21]. В подавляющем большинстве случаев для профилактики повторных ишемических событий использовалась ацетилсалициловая кислота (АСК), назначенная еще в доковидном периоде. Следует отметить, что АСК, помимо антиагрегантных свойств, оказывает также противовоспалительный и, по некоторым данным, противовирусный эффект. Клинические наблюдения показали, что прием этого лекарственного средства способствовал статистически достоверному и достаточно существенному в количественном отношении (до 25–47%) снижению показателей краткосрочной и среднесрочной летальности. Потребность в проведении искусственной вентиляции легких (ИВЛ) на фоне применения АСК также возникала достоверно реже, чем в отсутствие антитромбоцитарной терапии. Так, по данным Chow J. et al. (2021), отношение рисков ИВЛ у пациентов, получающих и не получающих аспирин, составило 0,57 [15]. Abdelwahab H.W. et al. (2021) сообщают также о достоверном снижении риска композитного показателя тромботических событий, включая тромбоз глубоких вен нижних конечностей, тромбоэмболию легочной артерии, окклюзию периферических артерий, ишемический инсульт, инфаркт миокарда с подъемом сегмента ST или ишемию кишечника [18].
В некоторых других работах не было получено доказательств благоприятного влияния антиагрегантной терапии на течение коронавирусной инфекции [22–24]. В частности, это касается единственного на сегодняшний день проспективного исследования ACTIV-4B, в рамках которого пациентам с COVID-19 для оценки профилактического эффекта впервые назначались АСК в малых дозах, антикоагулянт или плацебо [25]. Отметим, что антикоагулянтная терапия в этой работе также не продемонстрировала своих преимуществ. Вероятно, это объясняется особенностями выборки: в исследовании ACTIV-4В участвовали нетяжелые амбулаторные пациенты со стабильным течением COVID-19. Таким образом, на сегодняшний день не представляется возможным сделать обоснованный вывод о целесообразности назначения антиагрегантной терапии в случае COVID-19; необходимы дальнейшие исследования в этом направлении, в том числе с использованием двойного слепого метода. В то же время следует подчеркнуть, что не вызывает сомнений безопасность антиагрегантной терапии при коронавирусной болезни. Поэтому все авторы сходятся в том, что во время COVID-19 следует продолжать ранее назначенную антиагрегантную терапию.
Лечение когнитивных и астенических нарушений
Учитывая отсутствие доказательных клинических исследований, лечение когнитивных и астенических нарушений в постковидном периоде основывается на представлениях о патогенезе этих неврологических расстройств. В повседневной практике пациентам без деменции обычно назначаются препараты с вазотропным и нейрометаболическим эффектом. Исходя из мультимодального плейотропного эффекта пентоксифиллина (Вазонит), этот препарат может рассматриваться в качестве патогенетически обоснованной терапии у пациентов с неврологическим ПКС.
Пентоксифиллин представляет собой производное диметилксантина. Преимуществом этого препарата является системный эффект в отношении микроциркуляции: он воздействует как на церебральные, так и периферические сосуды, не вызывая «эффекта обкрадывания». Механизм действия пентоксифиллина заключается в ингибировании фосфодиэстеразы (ФДЭ) 4-го типа, что приводит к увеличению содержания циклического аденозинмонофосфата (цАМФ) в гладкомышечных клетках сосудистой стенки и форменных элементах крови. Накопление цАМФ в тромбоцитах и эритроцитах вызывает некоторый антиагрегантный эффект, способствует увеличению деформируемости форменных элементов крови, уменьшает выраженность их адгезии к эндотелию сосудов [26–29]. Применение пентоксифилина сопровождается также снижением уровня фибриногена.
Согласно последним исследованиям, пентоксифиллин обладает и противовоспалительными свойствами. В обзоре Dhameliya Н.А. et al., посвященном опыту применения пентоксифиллина с 1985 по 2020 г., приводятся данные о том, что препарат ингибирует активацию Т- и В-лимфоцитов, подавляет уровень транскрипции и экспрессии ряда провоспалительных цитокинов, продукция которых повышается при «цитокиновом шторме», включая интерлейкины-1 и -6, фактор некроза опухоли альфа (ФНО-α). Как известно, именно ФНО-α является ключевым провоспалительным цитокином при иммунном пневмоните, наблюдаемом при COVID-19. В результате неспецифического ингибирования ФДЭ происходит снижение выработки провоспалительных цитокинов, что влечет за собой уменьшение объема тканевого поражения при «цитокиновом шторме», вызванном SARS-CoV-2 [29].
Клинические эффекты пентоксифиллина, оказывающие положительное влияние на течение симптомов COVID-19, представлены в таблице 2 [28–32].
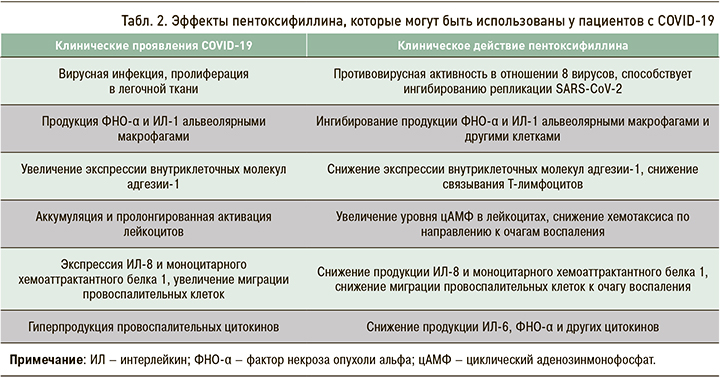
Ряд авторов описывает некоторую эффективность пентоксифиллина в отношении аносмии у пациентов с новой коронавирусной инфекцией вследствие усиления васкуляризации обонятельных нервов. Важный положительный эффект применения препарата –увеличение активности коллагеназы в фибробластах: это приводит к снижению продукции коллагена 1-го типа, фибронектина и глюкозаминогликана и, таким образом, способствует уменьшению выраженности фиброза тканей, особенно в легких. Также в некоторых исследованиях описан бронхорасширяющий эффект пентоксифиллина и снижение выраженности респираторного дистресс-синдрома [28–32]. Так, Rainsford K.D. (2006) отметил некоторую эффективность препарата Вазонит при лечении легочных осложнений, вызванных птичьим гриппом H5N1 [33].
Wall G.C. et al. (США) [34] провели ретроспективное исследование по оценке эффективности и безопасности использования пентоксифиллина и теофиллина у пациентов с коронавирусной пневмонией, находящихся на стационарном лечении и нуждающихся в кислородной поддержке или ИВЛ. Пациентам с пневмонией, вызванной COVID-19, в качестве адъювантной терапии назначались пентоксифиллин или теофиллин в течение 7 дней, группа сравнения получала только стандартную терапию. Оценивались уровень C-реактивного белка (СРБ) и соотношение сатурации кислорода и фракции кислорода вдыхаемого воздуха к частоте дыхания на первый и четвертый день терапии (ROX index). Всего в исследовании участвовало 209 пациентов с подтвержденной COVID-19-пневмонией (средний возраст 60 лет). Среди них 41 пациент получал пентоксифиллин, 17 (с бронхиальной астмой или хронической обструктивной болезнью легких в анамнезе) – теофиллин. Оставшиеся 151 человек составляли группу сравнения. На 4-й день терапии у пациентов, получавших пентоксифиллин, было отмечено увеличение ROX индекса и снижение уровня СРБ. Риск смертности в группе сравнения возрастал в 1,69 раз (95% доверительный интервал: 0,85–3,4) по отношению к группе, получающей пентоксифиллин в качестве адъювантной терапии.
Вазонит назначают в дозе 1200 мг/сут перорально по 600 мг 2 раза/сут; меньшая кратность приема препарата улучшает приверженность пациентов терапии.
В связи с потенциальным воздействием пентоксифиллина на несколько звеньев патогенетического процесса при COVID-19 целесообразны дальнейшие исследования его эффективности в отношении профилактики и лечения неврологического ПКС с использованием двойного слепого метода.



