ВВЕДЕНИЕ
Разнообразные проявления астенического синдрома (АС), с одной стороны, относятся к наиболее распространенным жалобам в современной клинической практике, особенно на приеме у врачей первичного звена (терапевтов и кардиологов), а с другой – являются одними из самых сложных для курации, поскольку включают спектр симптомов, выходящих за рамки традиционных соматических расстройств. Известно, что АС также представляют собой неотъемлемую часть клинической картины многих хронических неинфекционных заболеваний (ХНИЗ): сердечно-сосудистых (ССЗ), цереброваскулярных (ЦВЗ), сахарного диабета 2-го типа (СД2) и т.д. [1]. Следует отметить, что частота жалоб на слабость, повышенную утомляемость, раздражительность, снижение физической и интеллектуальной работоспособности среди пациентов с СД2, ССЗ или ЦВЗ значимо возрастает в периоды сезонных подъемов заболеваемости острыми респираторными инфекциями [2]. Как следствие этого, особенно актуальной проблемой АС стал в течение последних двух лет на фоне продолжающейся пандемии новой коронавирусной инфекции, вызванной вирусом SARS- CoV-2.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ АСТЕНИЧЕСКОГО СИНДРОМА И ЕГО ВЛИЯНИЕ НА ПРОГНОЗ
Классические клинические проявления АС, помимо быстрой утомляемости, немотивированного чувства сильной усталости и постоянной слабости, включают разнообразные когнитивные расстройства, такие как невозможность сконцентрировать свое внимание или длительно удерживать его, выполнять прежний объем интеллектуальной работы, ухудшение оперативной памяти, чувство постоянного «тумана в голове» и др.
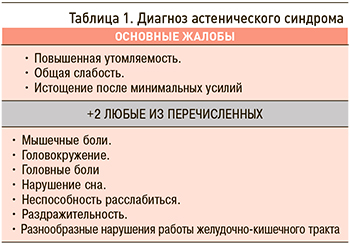
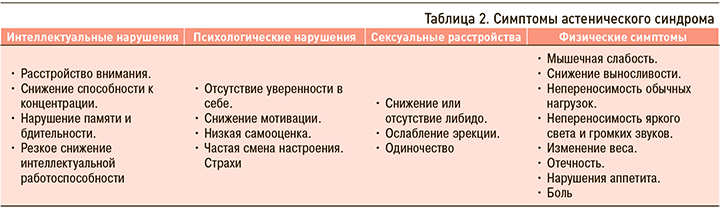
Для диагностирования АС необходимо выявить сочетание ведущих жалоб (на выраженную слабость, утомляемость) и как минимум двух дополнительных (табл. 1). Следует подчеркнуть, что, кроме вышеперечисленных симптомов, при АС часто встречаются нарушения или резкие перепады настроения, которые сочетаются с повышенной раздражительностью и возбудимостью, непереносимостью яркого света, громких звуков, часто усиливающихся на фоне нарушений сна, таких как дневная сонливость и бессонница ночью. В свою очередь, психоэмоциональные и когнитивные проявления АС обычно сопровождаются различными функциональными нарушениями работы желудочно-кишечного тракта или болевыми симптомами (мышечной либо головной болью; табл. 2) [3]. Сопутствуя течению ХНИЗ, АС, кроме безусловно негативного влияния на качество жизни пациентов, одновременно может оказывать неблагоприятное воздействие на прогноз, например, через уменьшение приверженности пациентов к терапии основного заболевания. Наряду с этим усиление симптомов АС может свидетельствовать об ухудшении течения СД2, ССЗ или ЦВЗ, что дает возможность врачу вовремя назначить/скорректировать терапию и предотвратить осложнения.
Согласно полученным данным, АС, впервые возникающий после перенесенной новой коронавирусной инфекции, не зависит от тяжести инфекционного процесса и характеризуется выраженной утомляемостью и резким снижением физического, интеллектуального и социального функционирования даже у пациентов молодого и среднего возраста. Это, по-видимому, может быть связано с высокой повреждающей способностью вируса SARS-CoV-2 [2, 4]. Таким образом, яркие проявления АС, ранее традиционно выявлявшиеся на фоне декомпенсации основного соматического заболевания, чаще ХНИЗ, в эпоху пандемии новой коронавирусной инфекции приобрели масштаб серьезной проблемы. Это обусловлено как высокой частотой встречаемости жалоб астенического характера даже среди пациентов, переболевших в легкой или бессимптомной форме, так и длительностью сохраняющейся симптоматики [5].
ПОДХОДЫ К КОРРЕКЦИИ АСТЕНИЧЕСКОГО СИНДРОМА
Для коррекции АС обычно применяется разнообразный ассортимент биологически активных добавок или лекарственных препаратов с широким спектром действия, зачастую назначаемых вместе без учета рисков полипрагмазии [1]. Учитывая, что в патогенезе АС одними из ведущих патофизиологических процессов являются нарушения клеточного энергетического метаболизма и связанная с ними интоксикация организма, эффективное терапевтическое воздействие должно быть ориентировано в первую очередь на эти негативные процессы. То есть оптимальной терапевтической стратегией будет выбор препарата с целенаправленным влиянием как на процессы синтеза энергии в клетках, так и нейтрализацию последствий интоксикации продуктами обмена. Полностью соответствующим этому критерию можно считать препарат Стимол, содержащий в своем составе два компонента-синергиста: цитруллин и малат.
Эти вещества являются основными участниками клеточного энергетического и пластического метаболизма, влияя на ключевые патофизиологические нарушения, развивающиеся при АС. Так, малат (яблочная кислота) представляет собой важный субстрат для восьмой реакции цикла трикарбоновых кислот (цикла Кребса), когда под влиянием митохондриальной малатдегидрогеназы происходит окисление малата в оксалоацетат. Поскольку же цикл трикарбоновых кислот – это общий конечный путь окисления ацетильных групп, в которые в процессе метаболизма превращается большинство органических молекул (углеводов, жиров и белков), служащих источником энергии для клеток, становится очевидной роль малата в восстановлении и поддержании энергетического баланса в организме человека, особенно в периоды сильного напряжения и истощения. Дополнительный метаболический бонус комбинации малата с цитруллином – влияние первого на усиление процесса абсорбции цитруллина в желудочно-кишечном тракте независимо от кислотности желудка, а также бикарбонат-аниона в канальцах нефронов, что предотвращает развитие метаболического ацидоза [6].
Роль цитруллина крайне важна для выполнения дезинтоксикационной функции, которую он проявляет в орнитиновом цикле Кребса–Ганзелейта, представляющим собой основной механизм обезвреживания аммиака в организме через биосинтез мочевины. Подчеркнем, что между циклом трикарбоновых кислот и орнитиновым циклом существуют тесные взаимосвязи, определяющие в том числе скорость протекания реакций, которая зависит от энергетических потребностей клетки и концентраций конечных продуктов метаболизма [7].
Так, фумаpат, являющийся общим метаболитом для обоих циклов, в цикле трикарбоновых кислот превращается в малат, из которого затем получается оксалоацетат. Последний, в свою очередь, вступает в реакцию трансаминирования с образованием аспартата, в дальнейшем выступающего участником орнитинового цикла. Также при окислении малата до оксалоацетата в цикле трикарбоновых кислот образуются 3 молекулы АТФ, которые впоследствии используются в орнитиновом цикле [7]. Следовательно, при помощи этих метаболитов осуществляется переплетение реакций обоих циклов, что является необходимым условием нормального обеспечения жизнедеятельности клеток в организме человека.
Хорошо известны положительные метаболические эффекты цитруллина, позволяющие снизить выраженность чувства мышечного утомления после интенсивных тренировок, что дает основание для его применения в терапии АС [8]. Ключевой механизм действия цитруллина при выраженной утомляемости, характерной для АС, – его активное участие в интенсивной переработке и выведении из организма человека токсичных продуктов обмена, образующихся в результате распада белковых соединений. Другим важным положительным свойством цитруллина является участие в синтезе аргинина – предшественника оксида азота; это дает возможность осуществлять такие системные эффекты, как защита от атеросклероза и осложнений гипертонии, опосредуемых в том числе через улучшение состояния микроциркуляции [9].
ПО ДАННЫМ ХЕМОРЕАКТОМНОГО МОДЕЛИРОВАНИЯ
Недавно исследователями была получена важная информация при проведении сравнительного анализа свойств цитруллина малата с использованием новейшего направления современной фармакологии – хемореактомного моделирования [10]. Суть проведенного исследования заключалась в изучении потенциальных фармакологических эффектов молекул малата и цитруллина в составе препарата Стимол. Примененный хемоинформационный метод позволил сравнить химическую структуру цитруллина малата с молекулами ацетилкарнитина и мельдония – соединениями, чьи клинико-фармакологические свойства хорошо известны. Кроме такого сравнения, хемореактомный анализ дал возможность провести моделирование сходства молекул цитруллина и малата с молекулами метаболома, а также оценить профиль их сродства к белкам протеома человека. Полученные результаты помогли дать ответы на многие вопросы, связанные с многообразием положительных клинических эффектов препарата Стимол, описанных ранее, но не имевших подтверждения в фармакологических исследованиях.
Так, хемореактомный анализ продемонстрировал множественные взаимодействия молекулы цитруллина с рецепторами нейротрансмиттеров, указывающие на его потенциальные анксиолитические, анальгетические и антидепрессивные эффекты; в этом проявилось отличие цитруллина от молекул мельдония и ацетилкарнитина, не показавших подобных взаимосвязей. Метод моделирования позволил также выявить ингибирующий эффект взаимодействия молекулы цитруллина с молекулой – переносчиком дофамина [10]. Основным результатом данного взаимодействия цитруллина является ингибирование обратного захвата дофамина в нейрональных синапсах, что соответствует его дофаминергической активности, в отличие от молекул мельдония и ацетилкарнитина. Учитывая, что дефицитарность эффектов дофамина ассоциирована с различными когнитивными и психоэмоциональными расстройствами, способность цитруллина потенцировать дофаминрегическую активность может быть рассмотрена как дополнительный положительный результат терапии препаратом Стимол. Это свойство Стимола может быть особенно актуальным в период развития АС после перенесенной новой коронавирусной инфекции, характеризующейся, наряду с прочим, выраженной отрицательной когнитивной и аффективной симптоматикой.
Аналогичный результат хемореактомный анализ показал в отношении возможного влияния цитруллина на серотонинергическую активность в центральной нервной системе (ЦНС), непосредственно связанную с развитием нарушений настроения, и в первую очередь состояния депрессии. Цитруллин оказался потенциально способным оказывать ингибирующее действие на молекулу белка – переносчика серотонина, причем в значимо большей степени, чем мельдоний и ацетилкарнитин. Такой механизм серотонинергического действия свойственен современным антидепрессантам из группы ингибиторов обратного захвата серотонина в нейрональных синапсах, которые за счет этого обладают не только антидепрессивным, но и анальгетическим действием. Проведенное моделирование неврологической активности цитруллина подтвердило его способность влиять на увеличение уровня серотонина в синаптической щели и потенцировать противоболевые и антидепрессивные эффекты, что опять же имеет большое значение для коррекции симптомокомплекса АС в постковидный период [10]. Ранее проведенные экспериментальные исследования доказали наличие у молекулы цитруллина ноотропного и мнестического действия [11]. Также следует сказать о предполагаемом нейропротекторном эффекте цитруллина, который может быть обусловлен регуляцией нейропластичности [12].
Следующим важным результатом хемореактомного анализа стало получение доказательств противовоспалительных свойств цитруллина, связанных с блокированием фермента циклооксигеназы-2 (ЦОГ-2). Это нашло подтверждение в моделировании экспериментальных эффектов в моделях артрита и воспалительного отека. Кроме этого, были получены свидетельства о потенциальных комплексных эффектах цитруллина, обусловленных его антикоагулянтным, антигипертензивным, антигипергликемическим и гипохолестеринемическим действием. Данные эффекты были опосредованы ингибированием фактора свертывания X, влиянием цитруллина на рецептор вазопрессина и активацией ядерного рецептора PPAR-γ [10]. Выявление с помощью хемореактомного анализа способности цитруллина оказывать противомикробное и противогрибковое действие подчеркивает актуальность применения препарата Стимол у пациентов в период восстановления после перенесенной инфекции, в том после COVID-19. При проведении хемоинформационного анализа было продемонстрировано, что все описанные потенциальные фармакологические эффекты цитруллина значимо выраженнее, чем у молекул сравнения – мельдония и ацетилкарнитина.
Хемореактомный анализ молекулы малата, входящего в состав препарата Стимол, подтвердил синергичность двух его компонентов. Было установлено, что как для малата, так и цитруллина характерны следующие потенциальные положительные эффекты: антигипергликемический, гипохолестеринемический, антигипертензивный, противовоспалительный, антикоагулянтный и анксиолитический [10]. В результате исследователи пришли к выводу, что, обладая эффектами двух естественных метаболитов, с одной стороны, и их взаимопотенцирующим влиянием, с другой, препарат Стимол, в отличие от молекул сравнения (мельдония и ацетилкарнитина), оказывает комплексное патофизиологическое воздействие на основные проявления АС.
ЭФФЕКТЫ ПРИМЕНЕНИЯ ЦИТРУЛЛИНА МАЛАТА В РЕАЛЬНОЙ КЛИНИЧЕСКОЙ ПРАКТИКЕ
Следует особо подчеркнуть, что на сегодняшний день накоплен большой клинический опыт применения препарата Стимол не только в условиях проведения рандомизированных исследований, но и в реальной клинической практике врачей разных специальностей, в том числе помогающих пациентам с различными проявлениями АС [13–20]. Эффективность терапии АС препаратом Стимол показана как у взрослых пациентов, так и у детей.
Дополнительные положительные эффекты терапии препаратом Стимол были тесно связаны с улучшением самочувствия и качества жизни пациентов. Так, было установлено, что прием этого препарата достоверно увеличивал фракцию выброса левого желудочка у пациентов с хронической сердечной недостаточностью, причем у 35% пациентов отмечалось улучшение функционального класса [18]. У пациентов с вегетососудистой дистонией, сопровождавшейся эпизодами гипотонии и плохого самочувствия, терапия препаратом Стимол приводила к регрессии клинических проявлений АС и нормализации гемодинамических показателей [17]. У больных артериальной гипертензией прием Стимола нормализовал показатели суточной вариабельности артериального давления [20].
Учитывая, что любая вирусная или бактериальная инфекция за счет выделения собственных токсинов непосредственно стимулирует развитие выраженной усталости, а цитруллин обладает мощным дезинтоксикационным эффектом, применение препарата Стимол у пациентов с АС в постковидном периоде может считаться вполне обоснованным. Также следует добавить, что при многих инфекционных заболеваниях потребность в цитруллине резко возрастает, поскольку инфекционные возбудители акцептируют это соединение из организма человека, и это может приводить к иммунодефициту [21]. Поэтому на фоне сниженной обеспеченности организма цитруллином у пациентов, перенесших инфекционные заболевания, период восстановления может затягиваться на более длительное время. Терапия препаратом Стимол в течение 2 сут после начала инфекционного заболевания способствовала улучшению самочувствия и даже повышала переносимость физических нагрузок [22]. Также было показано, что его применение может быть перспективно у пациентов с саркопенией и мышечной дистрофией Дюшенна [23]. У здоровых спортсменов использование препарата Стимол достоверно снижало уровень лактата в крови и ускоряло восстановление после тренировок [24]. Наряду с этим у спортсменов Стимол может быть полезен для инактивации негативных последствий избыточного количества белка в рационе, влияющего в том числе и на развитие АС [25].
Препарат Стимол выпускается в виде раствора для приема внутрь. Для коррекции АС его следует принимать 3 раза в сутки: по 1 пакетику во время еды, смешивая содержимое с примерно 100 мл воды. Курс приема препарата составляет 10–12 дней. Повторные курсы возможны после перерыва (1–3 мес) или по рекомендации врача.
ЗАКЛЮЧЕНИЕ
Таким образом, получение новых знаний о положительных эффектах препарата Стимол может внести существенный вклад в улучшение оказания помощи пациентам, перенесшим новую коронавирусную инфекцию и страдающим от длительного АС. Сочетание доказанного детоксикационного действия препарата, его многочисленных положительных метаболических эффектов и благотворного влияния на ЦНС способно улучшать состояние и ускорять наступление полного восстановления у пациентов с АС, в том числе после новой коронавирусной инфекции.



